大鼠热应激对细胞免疫学的影响
周文芸,吕芷娴,曾黎峰,何 丹,胡国柱
(江西省人民医院临床医学研究所,南昌 330006)
热应激是指在高温环境中的机体对过热刺激所产生的非特异性生理反应,其中包括呼吸、心率加快、缺氧等;细胞氧化代谢及过氧化物产生增加;水和电解质平衡紊乱。然而热应激最初反应是神经内分泌紊乱,交感神经系统及脑垂体-丘脑下部-肾上腺系统功能亢进,免疫受到抑制。狗热应激42.3 ℃90 min,外周血淋巴细胞持续8 d减少,有丝分裂原刺激T细胞增殖也被抑制[1]。热应激的孕牛其产下的小牛4周内Toll样受体4(Toll-like receptor 4,TLR4)表达下降,淋巴细胞数量减少[2]。大鼠热应激肠系膜淋巴结CD3+CD4+T细胞减少,而CD3+CD8+T细胞增加[3]。20~40岁的男性志愿者热应激,其血浆去甲肾上腺素/肾上腺素、去甲肾上腺素/皮质醇,以及白细胞介素4/Ⅱ型干扰素(IL-4/IFN-γ)的比值升高,证明交感神经系统参与免疫抑制调节,同时免疫调节向辅助T细胞(Th2)方向发展[4]。动物慢性热应激增加了H5N1流感病毒感染的易感性,抑制了Th1和Th2 免疫反应,降低了H5N1流感病毒疫苗免疫接种后的保护作用,其原因是慢性热应激诱导动物CD4+CD25+Foxp3+调节性T(Treg)细胞产生,IL-10和TGF-β产生增加[5]。少突细胞髓鞘糖蛋白[MOG(35-55)]肽接种小鼠2 d开始热应激,结果实验性自身免疫性脑脊髓炎(EAE)的发生率减少了70%,且延迟发病,症状减轻,白细胞浸润减少,CD4+CD25+T细胞减少,MOG(35-55)活化的T细胞也下降[6]。
TLR4是识别细菌脂多糖(LPS)、一些病毒及原虫等病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的识别受体(pattern recognition receptors,PRR),主要表达于单核/巨噬细胞、树突状细胞、粒细胞及自然杀伤(NK)细胞,TLR4在脾和外周血白细胞表达最强。TLR4与PAMPs 结合起到清除病原微生物的天然免疫[7]和特异性免疫作用[8]。
TLR4具有天然免疫和特异性免疫双重作用。CD4+CD25+FoxP3+Treg和CD8+CD25+FoxP3+Treg均为Treg细胞[9]。因此,本文观察热应激大鼠脾脏细胞TLR4表达及外周血两种Treg细胞的变化,以期为高温高湿所致疾病的预防提供理论基础,现报道如下。
1 材料与方法
1.1材料 SPF级SD大鼠(上海市西普尔-必凯实验动物有限公司)72只,雄性,体质量(267.26±31.08)g,鼠龄9~15周。LPS和刀豆素A(Con-A,Sigma公司);抗PE-TLR4(Abcam公司)及抗PE-IgG2b k(eBioscience公司);抗PE-Cy5-CD4(BD Pharmingen公司)及抗PE-Cy5-IgG2a k(eBioscience公司);抗PE-CD25及抗PE-IgG1,抗FITC-Foxp3及抗FITC-IgG2a,抗FITC-CD8b及抗FITC-IgG1,抗PE-Cy5-Foxp3及抗PE-Cy5-IgG2a;Foxp3 Fixation/Permeabilization及Permeabilization缓冲液(eBioscience公司)。
1.2方法
1.2.1分组 (1)正常对照组(20 ℃组)36只大鼠分为非刺激组、LPS刺激组(腹腔注射LPS,1.0 mg/kg),Con-A刺激组(腹腔注射Con-A,5.0 mg/kg),每组12只,自然环境饲养,自由进食进水,湿度50%;(2)高温湿热组(37 ℃组)组36只大鼠分为非刺激组、LPS刺激组、Con-A刺激组,每组12只,37 ℃培养箱中饲养,自由进食进水,饱和湿度(100%);每组观察时间点为处理后1、12、48、168 h时间点(3只大鼠/时间点)。
1.2.2脾脏单个核细胞悬液制备 大鼠腹腔注射戊巴比妥钠麻醉,取脾脏用含1.0%小牛血清(FCS)+0.03% NaN3的0.01 mol/L PBS(pH 7.4)经200目不锈钢网研磨制成细胞悬液,离心洗涤2次,调整细胞浓度为1×107个/mL。
1.2.3脾脏TLR4+测定 采用流式细胞术方法:10.0 μL TLR4-PE抗体(1.0 μg)加至塑料试管底,再加同型对照抗体5.0 μL于另一管,然后每管加5×108个/L脾脏细胞混匀,室温孵育40 min;再加90.0 μL红细胞裂解液孵育10 min;最后加2.0 mL PBS 400×g离心力离心5 min,洗涤2次。加0.4 mL流式细胞仪鞘液混匀后进行流式细胞仪检测。
1.2.4Treg细胞检测 CD4+CD25+T细胞及CD4+CD25+Foxp3+T细胞,CD8+CD25+T细胞及CD8+CD25+Foxp3+Treg测定采用流式细胞术方法,具体步骤见参考文献[10]。
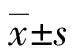
2 结 果
2.1高温湿热影响大鼠脾脏TLR4+细胞的数量 37 ℃高温湿热导致大鼠脾脏TLR4+细胞数量下降(P<0.05),即使LPS和Con-A刺激大鼠也无法逆转这种免疫抑制状态,提示高温湿热可破坏机体天然免疫功能,见表1~3。

表1 非刺激亚组不同时间点TLR4+细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05与同组1 h比较

表2 LPS刺激亚组不同时间点TLR4+细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h比较
2.2高温湿热影响大鼠外周血CD4+CD25+Treg细胞表达 37 ℃高温湿热各亚组外周血CD4+CD25+Treg细胞在1~48 h较20 ℃显著下降(P<0.05),只有LPS刺激168 h则较20 ℃显著升高(P<0.05),见表4~6。

表3 Con-A刺激亚组不同时间点TLR4+细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h比较

表4 非刺激亚组不同时间点外周血CD4+CD25+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,12 h,48 h比较

表5 LPS刺激亚组不同时间点外周血CD4+CD25+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,12 h比较;c:P<0.05,与同组1 h,12 h,48 h比较

表6 Con-A刺激亚组不同时间点外周血CD4+CD25+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,12 h,48 h比较
2.3高温湿热影响大鼠外周血CD4+CD25+Foxp3+Treg细胞表达 37 ℃高温湿热各亚组外周血CD4+CD25+Foxp3+Treg细胞所占CD4+CD25+Treg细胞的百分率在12 h高于20 ℃组(P<0.05),而168 h则显著低于20 ℃组(P<0.05),LPS刺激使12 h相对降低。168 h长期高温湿热导致外周血CD4+CD25+Foxp3+Treg细胞显著减少,可能改变机体的免疫状态,见表7~9。
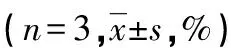
表7 非刺激亚组不同时间点外周血CD4+CD25+Foxp3+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,48 h,168 h比较;c:P<0.05,与同组1 h比较;d:P<0.05,与同组12 h,48 h比较
2.4高温影响大鼠外周血CD8+CD25+Treg细胞表达 37 ℃高温湿热各亚组在1 h和168 h外周血CD8+CD25+Treg细胞较20 ℃升高(P<0.05),LPS和Con-A刺激也未明显改变这种规律,见表10~12。
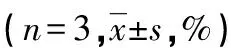
表8 LPS刺激亚组不同时间点外周血CD4+CD25+Foxp3+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,168 h比较
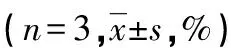
表9 Con-A刺激亚组不同时间点外周血CD4+CD25+Foxp3+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组12 h,48 h比较;c:P<0.05,与同组12 h,48 h比较
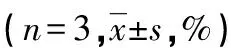
表10 非刺激亚组不同时间点外周血CD8+CD25+Treg细胞均数间的比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组12,48 h比较
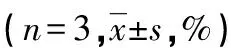
表11 LPS刺激亚组不同时间点外周血CD8+CD25+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组12 h,48 h比较
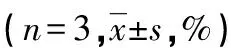
表12 Con-A刺激亚组不同时间点外周血CD8+CD25+Treg细胞均数间的比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组12 h,48 h比较
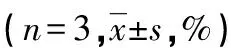
表13 非刺激亚组不同时间点外周血CD8+CD25+Foxp3+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,48 h,168 h比较
2.5高温湿热影响大鼠外周血CD8+CD25+Foxp3+Treg细胞表达 37 ℃高温湿热非刺激和LPS刺激亚组在12 h和168 h外周血CD8+CD25+Foxp3+Treg细胞较20 ℃显著升高(P<0.05),而Con-A刺激亚组在37 ℃ 168 h则恢复正常,见表13~15。
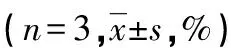
表14 LPS刺激亚组不同时间点外周血CD8+CD25+Foxp3+Treg细胞比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,48 h,168 h比较
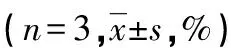
表15 Con-A刺激亚组不同时间点外周血CD8+CD25+Foxp3+Treg细胞均数间的比较
a:P<0.05,与同时间点20 ℃比较;b:P<0.05,与同组1 h,168 h比较
3 讨 论
TLR4存在于髓系非特异性免疫活性细胞上参与固有免疫和获得性免疫反应[8],因此免疫活性细胞TLR4表达下降不但导致非特异性免疫功能下降,同时也降低了特异性免疫反应。TLR4的刺激剂LPS能够刺激DCs表达TLR4增加,促进DCs上的TLR4对病原和异物进行内吞[11]。小鼠静脉注射LPS 1~5 h后脾组织TLR4、CD14和TNF-α的mRNA表达逐渐增加[12]。本研究证明大鼠在37 ℃饱和湿度(100%湿度)热应激时脾脏TLR4+免疫活性细胞数量在1~168 h均显著降低,TLR4的激动剂LPS也未能在1~12 h促进脾脏免疫活性细胞表达TLR4增加,在48~168 h也未能恢复,而T淋巴细胞有丝分裂原Con-A刺激更不能改变TLR4表达被抑制的状态,见表1~3。
热应激引起交感神经系统(去甲肾上腺素)和下丘脑-垂体-肾上腺系统(肾上腺素)的亢进,然而肾上腺素能促进LPS刺激的巨噬细胞吞噬指数增加、TNF-α、IL-1β分泌,以及CD14表达[13],也有报道证明肾上腺素抑制LPS诱导的单核细胞IL-1β、IL-8、MCP-1的产生,以及CD11b的表达[14]。本研究发现非刺激组及48~168 h的LPS亚组即使肾上腺素应激激素下降后脾脏免疫细胞TLR4表达率仍显著下降,说明高温高湿环境下大鼠天然免疫受抑制可能是多因素共同作用的结果。
去甲肾上腺素升高经β2肾上腺能受体导致人和小鼠脾脏T淋巴细胞增殖降低、CD8+细胞减少IFN-γ和TNF-α表达,出现免疫力降低[15-16]。CD4+CD25+T细胞和CD8+CD25+T细胞只有表达Foxp3后获得抑制功能[17],而单纯CD4+CD25+T细胞和CD8+CD25+T细胞仅仅是辅助和抑制或杀伤功能细胞。本研究发现大鼠热应激CD4+CD25+T细胞和CD4+CD25+Foxp3+细胞表现不尽相同,大鼠CD4+CD25+Treg细胞在37 ℃饱和湿度(100%)热应激1~48 h显著下降,增殖受到明显抑制,即使T淋巴细胞刺激剂Con-A刺激也不能改变抑制状态,更不用说LPS无关刺激;而CD4+CD25+Foxp3+Treg细胞在1~48 h 之内并不降低,其中12 h时间点在非刺激和Con-A刺激组仍显著升高,这种现象反映热应激早期(1~48 h)机体出现相对免疫抑制状态,将促进感染性疾病的发生;但是长期高温湿热应激(168 h),CD4+CD25+Treg细胞在非刺激和Con-A刺激组恢复正常,LPS组甚至显著高于正常对照(20 ℃),事实上LPS能够刺激DC促进CD4+T细胞增殖[18];而CD4+CD25+Foxp3+Treg细胞在168 h则较正常对照组显著下降,这可能与热应激激素下降有关,也许长期高温湿热容易导致免疫抑制减弱。
本研究还发现大鼠热CD8+CD25+Treg细胞在37 ℃饱和湿度(100%)热应激在非刺激、LPS刺激及Con-A刺激组1 h均显著高于20 ℃组,慢慢下降直到48 h达最低,168 h又显著升高,可能热应激导致应激激素增加后出现机体炎性反应和细胞毒性作用,然后随着机体免疫相对处于抑制状态(CD4+CD25+Foxp3+细胞相对增加),其CD8+增殖和活化受到抑制,但长期(168 h)高温湿热(100%)又显著升高,可能与同期CD4+CD25+Foxp3+Treg细胞降低,免疫抑制减弱相关,Con-A和LPS刺激也对CD8+CD25+Treg细胞无改变;而CD8+CD25+Foxp3+Treg细胞的表现与CD8+CD25+Treg细胞不一致,其在1 h和48 h显著降低,12 h显著升高,这可能与热应激激素作用相关,也进一步证明CD8+CD25+Treg细胞被作用后12~48 h显著降低,但长期(168 h)高温湿热(100%)CD8+CD25+Foxp3+Treg细胞在非刺激和LPS刺激组又显著升高,其与CD4+CD25+Foxp3+Treg细胞的下降产生互补,避免了免疫过强或变态反应发生,然而T细胞有丝分裂原Con-A刺激组则在长期高温湿热中CD8+CD25+Foxp3+Treg细胞并不增加,也许代表着T细胞在长期高温湿热中被抗原刺激容易导致免疫抑制减弱而出现免疫过强或变态反应发生。HENEKA等[6]证明,MOG(35-55)免疫接种小鼠2 d后开始热应激,结果实验性自身免疫性脑脊髓炎(EAE)的发病率减少了70%,且延迟发病,并发症减轻,白细胞浸润减少,CD4+CD25+T细胞减少,MOG(35-55)活化的T细胞也下降。
高温湿热应激机体CD4+CD25+Treg细胞及CD4+CD25+Foxp3+Treg细胞与CD8+CD25+Treg细胞及CD8+CD25+Foxp3+Treg细胞的表现不相同,因为这两大类细胞群体结构不同,功能作用方面也有差别,例如病毒感染高负荷时CD4+CD25+Foxp3+Treg细胞也高,而CD8+CD25+Foxp3+Treg细胞则在病毒高峰后数天才出现[19];与CD4+CD25+Foxp3+Treg细胞不同的是CD8+CD25+Foxp3+Treg细胞主要通过接触抑制[20]。CD4+CD25+Treg细胞与CD4+CD25+Foxp3+Treg细胞,以及CD8+CD25+Treg细胞与CD8+CD25+Foxp3+Treg细胞的表现也不相同,其原因是CD4+CD25+Treg细胞和CD8+CD25+Treg细胞并不与抑制免疫反应相关,他们是正常活化的辅助和杀伤及细胞毒功能细胞,而CD4+CD25+Foxp3+Treg细胞和CD8+CD25+Foxp3+Treg细胞才是抑制性Treg细胞。总之,在高温湿热应激中机体的免疫功能在早期有炎性因子产生和细胞杀伤导致炎性反应,而长时间持续高温湿热应激免疫抑制功能增强。
[1]OGLESBEE M J,DIEHL K,CRAWFORD E,et al.Whole body hyperthermia:effects upon canine immune and hemostatic functions[J].Vet Immunol Immunopathol,1999,69(2/4):185-199.
[2]STRONG R A,SILVA E B,CHENG H W,et al.Acute brief heat stress in late gestation alters neonatal calf innate immune functions[J].J Dairy Sci,2015,98(11):7771-7783.
[3]LIU X,LI H,LU A,et al.Reduction of intestinal mucosal immune function in heat-stressed rats and bacterial translocation[J].Int J Hyperthermia,2012,28(8):756-765.
[4]SHAHABI S,HASSAN Z M,MAHDAVI M,et al.Hot and cold natures and some parameters of neuroendocrine and immune systems in traditional Iranian medicine:a preliminary study[J].J Altern Complement Med,2008,4(2):147-156.
[5]MENG D,HU Y,XIAO C,et al.Chronic heat stress inhibits immune responses to H5N1 vaccination through regulating CD4+CD25+Foxp3+Tregs[J].Biomed Res Int,2013,2013(1):160859.
[6]HENEKA M T,SHARP A,MURPHY P,et al.The heat shock response reduces myelin oligodendrocyte glycoprotein-induced experimental autoimmune encephalomyelitis in mice[J].J Neurochem,2001,77(2):568-579.
[7]ROMANO C C,MAZZOLA N,PAOLILLO R,et al.Toll-like receptor-4(TLR4) mediates human beta-defensin-2(HBD-2) induction in response to Chlamydia pneumoniae in mononuclear cells[J].FEMS Immunol Med Microbiol,2009,57(2):116-124.
[8]DABBAGH K,DAHLME,STEP ICK-BIEK P,et al.Toll-like receptor 4 is required for optimal development of Th2 immune responses:role of dendritic cells[J].J Immunol,2002,168(9):4524-4530.
[9]KIM J M,RUDENSKY A.The role of the transcription factor Foxp3 in the development of regulatory T cells[J].Immunol Rev,2006,212(1):86-98.
[10]杨思俊,胡微煦,文珠,等.冷应激对大鼠细胞免疫的影响[J].现代预防医学,2014,41(12):2215-2219.
[11]ANDERSSON L I,HELLMAN P,ERIKSSON H.Receptor-mediated endocytosis of particles by peripheral dendritic cells[J].Hum Immunol,2008,69(10):625-633.
[12]万幸,王培训,周联,等.脂多糖刺激前后小鼠肺肝脾组织中Toll样等受体基因表达情况[J].中国危重病急救医学,2004,16(2):73-76.
[13]ZHOU J,YAN J,LIANG H,et al.Epinephrine enhances the response of macrophages under LPS stimulation[J].Biomed Res Int,2014,2014:254686.
[14]MARGARYAN S,HYUSYAN A,MARTIROSYAN A,et al.Differential modulation of innate immune response by epinephrine and estradiol[J].Horm Mol Biol Clin Investig,2017,30(3):46.
[15]CASE A J,ZIMMERMAN M C.Redox-regulated suppression of splenic T-lymphocyte activation in a model of sympathoexcitation[J].Hypertension,2015,65(4):916-923.
[16]ESTRADA L D,AGAÇ D,FARRAR J D.Sympathetic neural signaling via the β2-adrenergic receptor suppresses T-cell receptor-mediated human and mouse CD8+T-cell effector function[J].Eur J Immunol,2016,46(8):1948-1958.
[17]COSMI L,LIOTTA F,LAZZERI E,et al.Human CD8+CD25+thymocytes share phenotypic and functional features with CD4+CD25+regulatory thymocytes[J].Blood,2003,102(12):4107-4114.
[18]TAKENAKA M C,ARAUJO L P,MARICATO J T,et al.Norepinephrine controls effector T cell differentiation through β2-adrenergic receptor-mediated inhibition of NF-κB and P-1 in dendritic cells[J].J Immunol,2016,196(2):637-644.
[19]KARLSSON I,MALLERET B,BROCHARD P,et al.FoxP3+CD25+CD8+T-cell induction during primary simian immunodeficiency virus infection in cynomolgus macaques correlates with low CD4+T-cell activation and high viral load[J].J Virol,2007,81(24):13444-13455.
[20]MAHIC M,HENJUM K,YAQUB S,et al.Generation of highly suppressive adaptive CD8+CD25+FOXP3+regulatory T cells by continuous antigen stimulation[J].Eur J Immunol,2008,38(3):640-646.

