冬凌草甲素对小鼠溃疡性结肠炎内质网应激的作用研究*
曾庆钟,刘 颖,郐一贺,刘敏锋,易梦娟,王丽京,顾取良△
(广东药科大学:1.药学院;2.基础学院血管生物学研究所,广州 510006)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因和发病机制未明的炎症性肠病(inflammatory bowel disease,IBD),以腹痛、腹泻、里急后重和黏液脓血便等为主要症状,伴随周期性结肠黏膜溃疡、黏膜坏死和再生等病理学改变[1]。近年来,内质网应激(endoplasmic reticulum stress,ERS)在IBD发病过程中的重要作用受到很多研究关注[2-3]。冬凌草甲素是从我国传统药材冬凌草中提取出来的一种贝壳杉烯二萜类物质,具有多种药理学活性,如抗炎、抗菌、抗氧化及抗肿瘤作用等[4]。研究发现冬凌草甲素片对醋酸诱导的小鼠UC具有防治作用,但缺少相应分子机制方面的研究[5]。本研究从ERS的角度探讨冬凌草甲素对小鼠UC的防治效果及其作用机制。
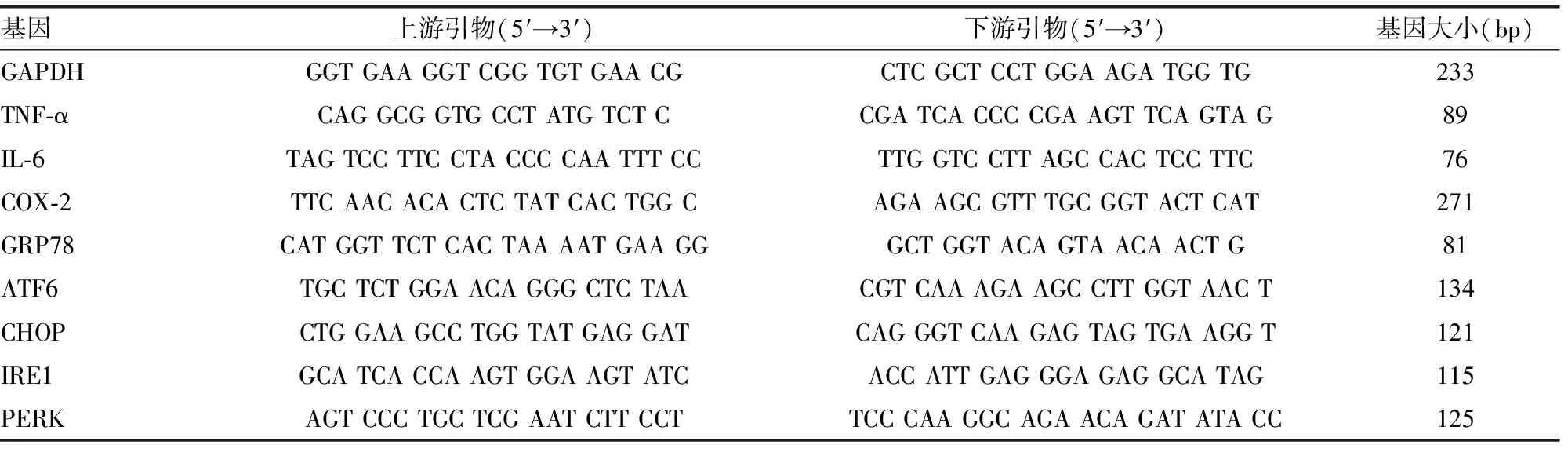
表1 PCR引物序列
1 材料与方法
1.1材料
1.1.1实验动物 8周龄C57BL/6雄性小鼠40只,SPF级,体质量18~22 g,广东省医学实验动物中心,许可证号:SCXK(粤)2013-0002。
1.1.2试剂与仪器 葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)购自美国MP Biomedicals公司,冬凌草甲素购自中国生物药品生物制品检定所,柳氮磺胺吡啶购自美国Sigma公司,TRIzol购自美国Invitrogen公司,反转录试剂盒购自日本Takara公司,RT-qPCR引物由上海生工合成。实时荧光定量PCR仪为Roche公司 LightCycler®96型号。
1.2方法
1.2.1UC模型制备及药物干预 将40只小鼠分为4组,即健康组(NOR)、模型组(DSS+生理盐水)、冬凌草甲素干预组(DSS+冬凌草甲素)、柳氮磺胺吡啶干预组(DSS+柳氮磺胺吡啶),每组10只。参照文献[6]的方法建立急性UC模型,即配制2% DSS水溶液供除健康组以外的实验小鼠自由饮用,连续饮用7 d,每2天更换1次新鲜DSS水溶液;健康组小鼠饮用正常无菌水。实验期间每天灌胃给药,冬凌草甲素剂量为15 mg·kg-1·d-1,柳氮磺胺吡啶剂量为500 mg·kg-1·d-1,模型组与健康组给予生理盐水20 mL·kg-1·d-1。
1.2.2疾病活动指数(disease activity index,DAI)评分 实验期间每天监测小鼠的体质量变化,观察大便性状,有无血便,有无隐血,按文献[7]进行DAI评分。
1.2.3结肠病理观察及组织病理形态学评分(histopathological score,HPS) 实验第7天给药2 h后麻醉条件下脱臼法处死小鼠,取小鼠结直肠,测量其长度。末端结直肠组织经4%多聚甲醛固定、脱水、石蜡包埋等常规程序后,组织切片进行苏木素-伊红(HE)染色。显微镜下观察结肠组织病理形态并按文献[6]进行病理评分。
1.2.4RT-qPCR法检测结肠组织肠道上皮组织中相关因子的表达 分离各组小鼠的结肠上皮组织,用TRIzol试剂分别提取各组小鼠结肠上皮组织的总RNA并用紫外分光光度法测定纯度与浓度。按照RT-qPCR试剂盒说明书操作,检测肿瘤坏死因子-α(tumor factor-α,TNF-α)、白细胞介素-6(interkekin-6,IL-6)、环氧合酶-2(cyclooxygenase 2,COX-2)、葡萄糖调节蛋白78(proteins glucose-regulated protein 78 kD,GRP78)、转录因子EBP同源蛋白(C/EBP homology protein,CHOP)、激活性转录因子6(activating transcription factor 6,ATF6)、蛋白激酶R样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)及肌醇酶1α(inositol requiring enzyme 1α,IRE1α)mRNA的表达。各指标RT-qPCR引物序列见表1。以GAPDH为内参,实验独立重复3次,采用2-ΔΔCt法分析数据。

2 结 果
2.1DAI评分及结直肠长度 与健康组比较,建模第7天时DSS诱导的模型组小鼠的体质量明显下降,出现腹泻、隐血或便血等典型UC症状,DAI评分明显高于健康组(P<0.01)。与未经干预的模型组相比,冬凌草甲素干预组与柳氮磺胺吡啶干预组的UC症状均有所减轻,DAI评分明显降低(P<0.01),两个药物干预组之间DAI评分差异无统计学意义(P>0.05)。取结直肠测量其长度,模型组结直肠较健康组明显缩短(P<0.01),冬凌草甲素干预组与柳氮磺胺吡啶干预组能明显减少结直肠缩短程度(P<0.05,P<0.01),不过柳氮磺胺吡啶的效果更显著,见图1。
2.2结肠HPS 建模第7天取结直肠进行病理组织形态学观察,健康组的结肠组织与腺体结构完整(图2A);模型组结肠黏膜则出现大量腺体溶解及大量的炎症细胞浸润,并伴有明显的溃疡(图2B);冬凌草甲素干预组与柳氮磺胺吡啶干预组结肠黏膜组织结构较为完整,有少量溃疡,部分腺体溶解(图2C和2D)。与健康组相比,模型组HPS明显升高(P<0.01);与模型组相比,冬凌草甲素干预组与柳氮磺胺吡啶干预组的HPS明显降低(P<0.01),且两个药物干预组之间HPS差异无统计学意义(P>0.05),见图2E。
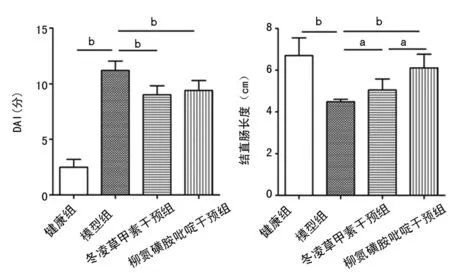
2.3结肠上皮组织TNF-α、IL-6与COX-2 mRNA的表达变化 与健康组相比,模型组结肠上皮组织中TNF-α、IL-6及COX-2 mRNA表达水平均明显上调(P<0.01);与模型组比较,冬凌草甲素干预组TNF-α、IL-6及COX-2 mRNA表达水平均明显下调(P<0.05或P<0.01);尽管柳氮磺胺吡啶对COX-2 mRNA表达水平的影响更明显(P<0.05),但两个药物干预组之间TNF-α和IL-6 mRNA表达水平差异无统计学意义(P>0.05),见图3。
2.4结肠上皮组织GRP78、CHOP、IRE1α、ATF6与PERK mRNA的表达变化 与健康组相比,模型组结肠上皮组织中GRP78、IRE1α、PERK、ATF6及CHOP mRNA表达均明显上调(P<0.05或P<0.01);与模型组相比,冬凌草甲素干预组GRP78、ATF6、CHOP及PERK mRNA表达水平均明显下调(P<0.05或P<0.01),但IRE1α mRNA表达水平差异无统计学意义(P>0.05),而较柳氮磺胺吡啶干预组IRE1α mRNA表达水平有明显上调(P<0.01),见图4。
a:P<0.05,b:P<0.01
图1各组小鼠的DAI评分与结直肠长度
A:健康组;B:模型组;C:冬凌草甲素干预组;D:柳氮磺胺吡啶干预组;E:HPS;a:P<0.01
图2结肠组织病理变化与HPS(HE×40)
a:P<0.05,b:P<0.01
图3结肠上皮组织炎症相关因子mRNA表达变化

a:P<0.05,b:P<0.01
图4结肠上皮组织ERS相关因子mRNA表达变化
3 讨 论
内质网是真核细胞中新生多肽折叠与组装、蛋白质修饰与加工的重要场所,具有很强的适应性。研究表明,患有IBD的人类与动物的肠道上皮细胞中存在ERS,ERS激活的未折叠蛋白反应(UPR)对于维持肠道上皮细胞的正常形态与功能均很重要,但过度ERS会导致细胞启动凋亡程序[2-3,8]。冬凌草甲素具有抗炎、抗菌、抗肿瘤、抗氧化及免疫调节等作用[4],近年亦有研究发现冬凌草甲素对肝癌HepG2细胞中ERS具有调节作用[9]。
本研究发现,冬凌草甲素干预DSS诱导的UC小鼠可使其结肠炎DAI评分和病理指标等明显缓解,其疗效与临床上应用于UC的柳氮磺胺吡啶相当,且结肠上皮组织中炎症相关因子TNF-α、IL-6和COX-2 mRNA表达亦明显降低,提示冬凌草甲素可能通过其抗炎与免疫调节作用对UC结肠具有保护作用。
GRP78能通过与内质网中错误折叠或未折叠蛋白结合的方式来恢复异常蛋白质的正确构象,作为内质网主要分子伴侣对细胞起保护作用[10]。在应激发生时GRP78表达显著增高,其表达水平在一定程度上反映细胞ERS的水平,可作为ERS的标志蛋白[11]。本研究发现,模型组小鼠结肠上皮组织中GRP78 mRNA表达水平较健康组有明显上调,表明DSS诱导UC小鼠的结肠上皮组织中伴随ERS发生,与文献报道一致。在使用冬凌草甲素或柳氮磺胺吡啶干预时GRP78 mRNA表达水平明显下降,并与健康组相当,一定程度上说明结肠上皮组织中ERS恢复到正常水平,提示冬凌草甲素能抑制UC小鼠ERS的作用。
IER1α、PERK和ATF6是哺乳动物的3种内质网跨膜蛋白,正常生理条件下与GRP78稳定结合,ERS发生时则与GRP78解离,引发UPR,发挥ERS状态下的保护细胞功能,但这3种蛋白质也会介导细胞凋亡[2-3]。本研究中,模型组小鼠结肠上皮组织细胞中IRE1α、PERK及ATF6 mRNA的表达水平较健康组明显上升,表明DSS诱导UC小鼠结肠上皮组织发生UPR;冬凌草甲素可以抑制其中PERK和ATF6 mRNA的表达升高,但对IRE1α mRNA却没有明显影响,而柳氮磺胺吡啶对这3种ERS相关蛋白mRNA表达均有明显下调作用。这一结果提示,尽管本研究中冬凌草甲素与柳氮磺胺吡啶防治UC疗效相当,但从ERS角度来说二者的作用机制存在一定差异,而且目前关于柳氮磺胺吡啶在ERS方面的作用少有报道。冬凌草甲素干预未能降低IRE1α mRNA高表达,提示可能存在其他机制抑制了高水平IRE1α介导的细胞凋亡通路。有研究报道,IRE1α缺失会出现CHOP表达增加,因此IRE1α高表达亦可能抑制CHOP表达,二者之间的平衡保护细胞适度ERS[12]。
ERS虽然可以维持内质网稳态,但过强或过久ERS则会启动细胞凋亡程序,CHOP则是其中的一条凋亡通道[13],CHOP基因敲除小鼠在由三硝基苯磺酸诱导发生结肠炎过程中细胞凋亡减弱[14]。本研究中,DSS诱导的UC模型组小鼠结肠上皮组织中CHOP mRNA的表达水平较健康组明显上调,与文献[15]报道一致;使用冬凌草甲素干预则显著降低增高的CHOP mRNA,表明冬凌草甲素将UC小鼠结肠上皮组织中ERS限制在适当程度内从而利于其发挥保护细胞作用。
综上所述,冬凌草甲素可以抑制小鼠结肠上皮组织中炎症相关因子表达,调控ERS,维持内质网稳定,这可能是冬凌草甲素防治UC的作用机制之一。目前国内外对冬凌草甲素在ERS方面作用的报道较少,因此仍需在动物水平和细胞水平上对其详细作用机制进行进一步的研究。
[1]安阿玥.肛肠病学[M].2版.北京:人民卫生出版社,2005:341.
[2]CHONG W C,SHASTRI M D,ERI R.Endoplasmic reticulum stress and oxidative stress:a vicious nexus implicated in bowel disease pathophysiology[J].Int J Mol Sci,2017,18(4):771-789.
[3]HOSOMI S,KASER A,BLUMBERG R S.Role of endoplasmic reticulum stress and autophagy as interlinking pathways in the pathogenesis of inflammatory bowel disease[J].Curr Opin Gastroenterol,2015,31(1):81-88.
[4]郭萍,李玉山,郭远强.冬凌草化学成分和药理活性研究进展[J].药物评价研究,2010,33(2):144-147.
[5]臧凯宏,杜丽东,刘晓梅,等.冬凌草甲素片对醋酸诱导的小鼠溃疡性结肠炎的治疗作用(英文)[J].中国现代应用药学,2012,29(9):781-785.
[6]郐一贺,王丽京,邓慧君,等.靶向抑制巨噬细胞Act1表达对溃疡性结肠炎的作用[J].中国实验动物学报,2016,24(6):585-590.
[7]MURANO M,MAEMURA K,HIRATA I,et al.Therapeutic effect of intracolonically administered nuclear factor kappa B(p65) antisense oligonucleotide on mouse dextran sulphate Sodium(DSS)-induced colitis[J].Clin Exp Immunol,2000,120(1):51-58.
[8]TRÉTON X,PÉDRUZZI E,CAZALS-HATEM D,et al.Altered endoplasmic reticulum stress affects translation in inactive colon tissue from patients with ulcerative colitis[J].Gastroenterology,2011,141(3):1024-1035.
[9]王辉,叶燕,禹志领.冬凌草甲素对HepG2细胞内质网应激蛋白IRE-1、PERK和CHOP的作用研究[J].中药新药与临床药理,2012,23(3):263-266.
[10]QIAN Y,TIFFANY-CASTIGLIONI E.Lead-induced endoplasmic reticulum(ER)stress responses in the nervous system[J].Neurochem Res,2003,28(1):153-162.
[11]RUTKOWSKI D T,KAUFMAN R J.That which does not kill me makes me stronger:adapting to ER stress[J].Trends Biochem Sci,2007,32(10):469-476.
[12]ZHANG H S,CHEN Y,FAN L,et al.The endoplasmic reticulum stress sensor IRE1(in intestinal epithelial cells is essential for protecting against colitis[J].J Biol Chem,2015,290(24):15327-15336.
[13]KASER A,ADOLPH T E,BLUMBERG R S.The unfold protein response and gastrointestinal disease[J].Semin Immunopathol,2013,35(3):307-319.
[14]NAMBA T,TANAKA K I,ITO Y,et al.Positive role of CCAAT/Enhancer-Binding protein homologous protein,a transcription factor involved in the endoplasmic reticulum stress response in the development of colitis[J].American Journal of Pathology,2009,174(5):1786-1798.
[15]CHOI Y,KOH S J,LEE H S,et al.Roxithromycin inhibits nuclear factor kappaB signaling and endoplasmic reticulum stress in intestinal epithelial cells and ameliorates experimental colitis in mice[J].Exp Biol Med,2015,240(12):1664-1671.

