在肠缺血再灌注下骨形成蛋白-4下调IL-7/IL-7R 信号促进肠上皮间淋巴细胞凋亡的研究*
罗彬予 张琴 张朝军 田云鸿 任明扬
(1.川北医学院第二临床医学院·南充市中心医院胃肠外科, 四川 南充 637000;2.遵义医学院附属医院康复医学科, 贵州 遵义563000; 3.中国人民解放军海军总医院普通外科, 北京100048)
肠缺血再灌注损伤是肠缺血再灌注(ischemic/reperfusion,I/R)在严重感染、创伤、心肺功能不全、器官移植等过程中常见组织器官损伤之一[1]。在I/R下使肠粘膜细胞受到损伤,进一步使屏障功能减弱。IELs作为一群主要由T淋巴细胞组成的特殊细胞群构建的肠免疫屏障[2]。白细胞介素-7(IL-7)细胞因子对淋巴细胞的生长、发育起重要作用[3]。前期实验在肠粘膜屏障中我们发现在I/R下肠上皮细胞来源(Intestinal epith- etlial cells IECs)的骨形成蛋白-4(Bone morphogenetic protein-4 BMP-4)分泌表达增加,通过与IELs上的BMP受体结合后,激活Smad信号通路促进IELs的凋亡[4]。有研究[5]发现胸腺上皮细胞来源的IL-7能够促进胸腺前体CD34+细胞增殖、发育,BMP-4和IL-7相互作用共同调节维持胸腺前体CD34+细胞的数量和功能,避免过度增殖和凋亡。在小肠中IL-7主要来源于IECs,对IELs的数量、功能维持其重要作用,前期实验发现[6-7]在TPN、IBD、I/R刺激下IELs的数量减少、功能减弱,肠道免疫功能受损,肠屏障功能减弱。本实验通过建立小鼠肠缺血再灌注模型和给予BMP4蛋白刺激IELs,观察IELs的保护因子IL-7/IL-7R信号通路的影响及其机制。
1 材料与方法
1.1 材料
1.1.1 动物及分组 选取6~8周龄C57BL/6J雄性小鼠32只,体质量20~30g,由第三军医大学新桥医院实验动物中心提供。随机分组为:①肠缺血再灌注组(I/R组):共16只,麻醉后,从腹正中线进腹,整理小肠,找到并分离肠系膜动脉根部后,用无创伤血管夹夹闭肠系膜动脉,25 min后松夹,缝合并关闭腹腔。造模成功后在规定时间点处死小鼠。②假手术组(Sham组):共16只,模型建立时只进行分离,不夹闭肠系膜上动脉,在规定的时间点处死小鼠。每组各取8只用于免疫荧光检测肠上皮IL-7表达,8只用于IELs分离提取,流式细胞术检测CD127及STAT5蛋白磷酸化变化。实验过程中对动物的处置符合动物伦理学标准。
1.1.2 主要试剂 重组人BMP4、NOGGIN蛋白(美国PeproTech公司);IL-7、P-STAT5、CD127、CD45、GAPDH抗体、山羊抗兔二抗(美国BD公司);膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)细胞凋亡检测试剂盒(碧云天生物试剂公司) Percoll液、细胞裂解液(上海前尘生物科技有有限公司);RPMI-1640培养基、胎牛血清、DMEM低糖培养基(美国Gibco公司);牛血清粉BSA、胰蛋白酶(sigma公司);IEL细胞分离液、流式缓冲液、Western blot主要试剂(第三军医大学新桥医院中心实验室)
1.2 方法
1.2.1 免疫荧光技术检测IECs内IL-7蛋白表达 在I/R刺激下空肠最为敏感,取部分空肠(距屈式韧带15cm)于预冷的生理盐水中轻洗、去除残留肠内容物。切取部分组织块(大小:1.0×0.5 cm),4%多聚甲醛中固定24h,石蜡包埋。组织石蜡切片二甲苯脱蜡和系列乙醇浓度梯度水化后,用磷酸盐缓冲液(PBS)冲洗;0.3%过氧化氢室温孵育10 min;10%山羊血清封闭,室温封闭10min;一抗IL-7(1:100),4℃过夜;二抗生物素标记的IgG(1:200),室温60min;PBS洗3次,加DAPI工作液,室温5 min;用荧光共聚焦显微镜观察肠上皮IL-7蛋白表达。
1.2.2 IEL细胞提取及培养 小肠取出放置在组织培养液(RPMI 1640,10%胎牛血清)。切成厚5mm切片,在60ml IELs分离液摇晃洗涤(37℃ 25 min),玻璃棉过滤组织碎渣,离心(4℃ 1500rpm/min 5min)。加15ml 40%等渗percoll液离心(4℃ 2200rpm/min 22 min),加20mlRPMI 1640组织培养基重悬离心。分离的IEL细胞数量纯度≥95%。将收集的细胞结种至六孔板内,加入RPMI-1640胎牛血清的全培养基培养,对应孔内加入30ng/ml BMP4、30ng/ml BMP4+NOGGIN、2ng/ml IL-7蛋白刺激6小时后,收集细胞。
1.2.3 IEC-6细胞培养及分组 大鼠小肠上皮细胞株IEC-6(中国科学院细胞所提供),加全培养基(DMEM低糖培养基+5%胎牛血清+胰岛素+青-链霉素双抗)在20% O2,5% CO2,75% N2,37℃恒温细胞培养箱常规无菌培养、传代。待IEC-6细胞贴壁生长状况良好,接种至六孔板内。分别标记A、B、C3组,A组作为空白对照组、B组内加入30ng/ml BMP4蛋白、C组加入30ng/ml BMP4+ NOGGIN蛋白培养6小时后,收集细胞。
1.2.4 Western blot检测IL-7蛋白 收集各组细胞加入细胞裂解液提取总蛋白,按照BCA法测定蛋白浓度,配制12%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,湿转法将蛋白转移至PVDF膜,5%脱脂奶粉封闭,TBST洗膜,加入一抗IL-7(1:100)、GAPDH(1:1000)4℃过夜孵育,TBST洗膜后加入山羊抗兔二抗(1:1000),摇床2小时,洗膜后加入Supersignal发光液,上机检测。
1.2.5 流式细胞术 将收集的细胞,在冰上PBS洗涤3次,离心沉淀细胞,加流式细胞缓冲液300ul,CD45-APC抗体(1:150)标记IEL细胞表型, CD127-FITC抗体(1:200)、P-STAT5-FITC抗体(1:100),4℃避光孵育45min,离心沉淀,PBS洗涤一次,加300ul流式缓冲液。上机检测。

2 结果
2.1 在I/R下肠上皮细胞内IL-7蛋白表达下调 建立小鼠肠缺血再灌注损伤模型,在肠I/R损伤6小时后取部分空肠组织固定、染色后,免疫荧光技术检测肠黏膜绒毛上皮细胞内IL-7蛋白表达变化,结果可见小鼠在I/R处理后,肠上皮细胞内IL-7蛋白表达较Sham组降低(P<0.05),见图1。

图1 小肠绒毛上皮细胞中IL-7蛋白(绿色)表达(免疫荧光染色FITC-绿色/PE-红色 ×1000) Figure 1 IL-7 protein (green) expression in small intestinal villus epithelium (immunofluorescence staining, FITC- green /PE-red x 1000)注:A.Sham组肠上皮细胞中IL-7蛋白表达明显;B.I/R组肠上皮细胞中IL-7蛋白表达明显减少
2.2 在I/R下肠上皮细胞间淋巴细胞内IL-7R信号下调 在小鼠I/R损伤6小时后,取全段小肠,分离提取IELs后,采用流式细胞术检测IELs中CD127、P-STAT5蛋白表达变化,结果IELs中CD127蛋白表达与Sham组比较减少(12.87±3.58)%,P-STAT5蛋白表达与Sham组比较减少(6.48±2.06)%, I/R组与Sham组比较差异均有统计学意义(P<0.05),见图2。
2.3 BMP4下调肠上皮细胞内IL-7蛋白表达 在I/R下IL-7/IL-7R信号通路下调,使IELs的保护功能减弱,肠道免疫功能受损[8],B组给予外源性BMP-4蛋白刺激IEC-6细胞6小时后,Westen Blot检测在肠上皮细胞内IL-7蛋白表达变化,结果肠上皮细胞内IL-7蛋白表达减少,C组给予BMP特异性拮抗剂NOGGIN刺激后可逆转BMP对IL-7的抑制作用,见图3。

图2 流式细胞术检测在I/R条件下IELs中CD127、P-STAT5表达变化 Figure 2 Flow cytometry used to detect the changes of CD127 and P-STAT5 expression in IELs under I/R注:CD127-白细胞介素-7受体,P-STAT5-磷酸化-信号转导和激活因子5;与Sham组比较,①P<0.05

图3 Western blot技术检测肠上皮细胞内IL-7蛋白在BMP4蛋白刺激下表达变化 Figure 3 Western blot detects the change of IL-7 protein in intestinal epithelial cells under the stimulation of BMP4 protein注:与A组比较,①P<0.05;与A组比较,②P>0.05
2.4 BMP-4下调肠上皮细胞间淋巴细胞内IL-7R信号下调 分离培养IELs,分别标记A、B、C三组,A组作为空白对照组,B组给予外源性BMP-4蛋白刺激IEL细胞6小时后,流式细胞术检测CD127、P-STAT5蛋白表达变化。与A组比较,给予BMP-4蛋白刺激下CD127表达明显减少(7.75±1.09)%,同时P-STAT5 蛋白在BMP-4刺激下表达下调(4.37±0.92)%,B组与A组比较差异有统计学意义(P<0.05),而C组给予拮抗剂NOGGIN和A组比较差异无统计学意义(P>0.05),见图4。

图4 流式细胞术检测IELs中CD127、P-STAT5蛋白在BMP4刺激下表达变化 Figure 4 Flow cytometry to detect the changes of CD127 and P-STAT5 proteins in IELs under BMP4 stimulation注:A.空白对照组;B.BMP4;C.BMP4+NOGGIN;与A组比较,①P<0.05;与A组比较,②P>0.05
2.5 BMP-4通过下调IL-7促进IELs凋亡 分离单独培养IELs细胞,分别标记A、B、C、D组,A组为空白对照组,B组给予外源性BMP4蛋白刺激培养6小时后,流式细胞术检测发现B组与A组比较,IELs细胞凋亡率增加(11.8±5.43)%;C组给予外源性IL-7蛋白刺激后,IELs的凋亡率降低(11.1±4.28)%。B组、C组与A组比较差异均有统计学意义(P<0.05),而D组给予BMP-4与IL-7蛋白联合刺激后与A组比较差异均无统计学意义(P>0.05),见图5。
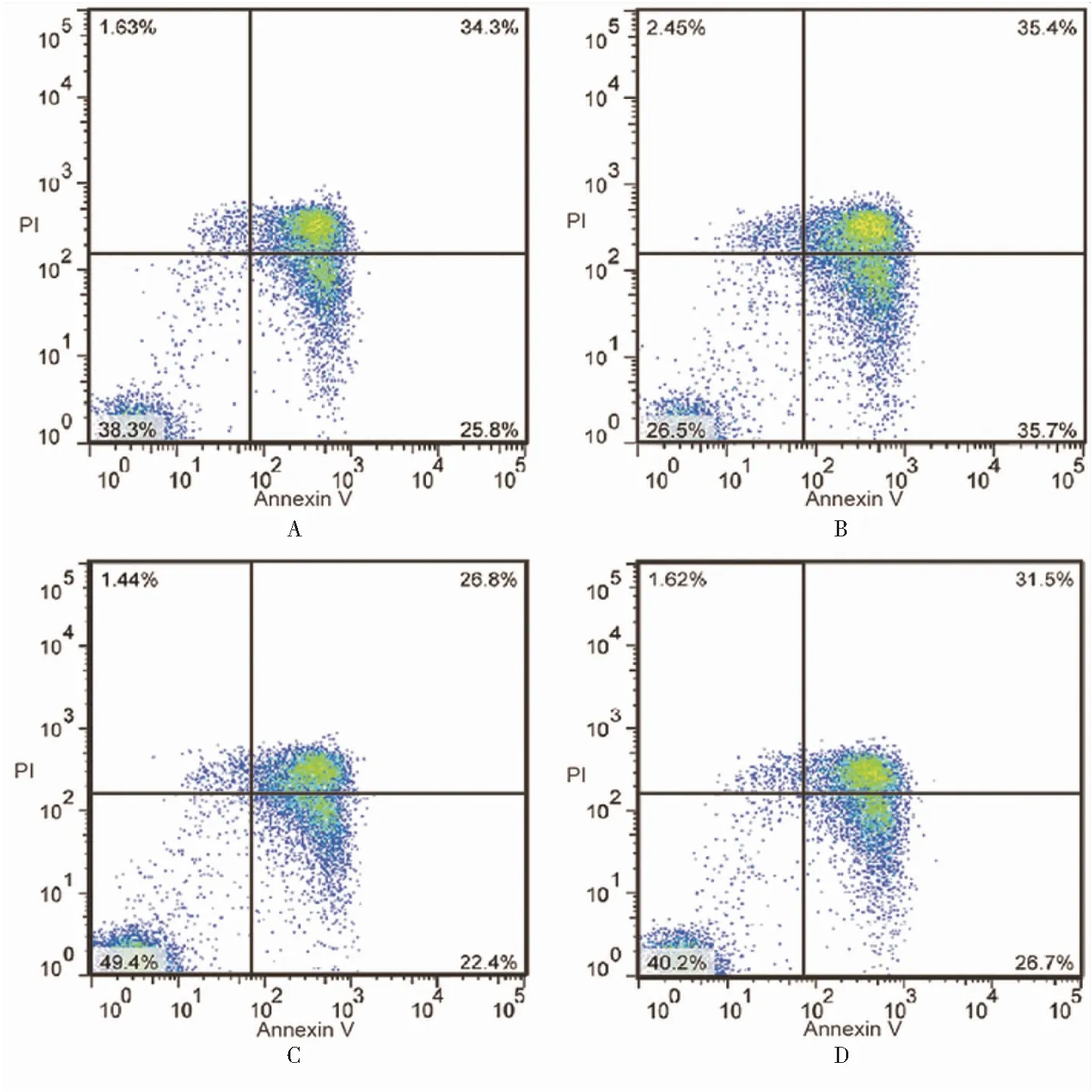
图5 流式细胞术检测IELs中各组凋亡变化 Figure 5 Flow cytometry to detect apoptosis in each group of IELs注:A.空白对照组;B.BMP4;C.IL-7;D.BMP4+IL-7
3 讨论
肠黏膜屏障是一个复杂的屏障结构,主要由机械屏障、免疫屏障、生物屏障、化学屏障等不同组分组成。其中由肠上皮细胞(intestinal epithelial cell,IEC)和肠上皮间淋巴细胞(intestianl intr aepithelial lymphocytes,IEL)为主组成的机械屏障和免疫屏障是决定肠屏障功能的核心因素[9]。在肠黏膜细胞中,IECs与IELs位置相互邻近,IECs可分泌细胞因子直接或间接的作用于IELs,影响IELs的增殖、分化、凋亡[10-11]。在肠I/R损伤条件下,IELs的功能减弱、数量减少、凋亡增加[12]。在小肠胃肠外营养(TPN)、DSS诱导下的结肠炎条件下发现在IECs内IL-7蛋白分泌表达减少,同时IELs上CD127表达也减弱,使IELs的数量与功能失衡,使肠道免疫屏障功能受损[7, 13-16]。
肠I/R损伤是一个复杂、多因素的损伤机制。在实验中发现在I/R下肠黏膜绒毛断裂、固有层细胞脱落,IEL细胞数量减少、功能减弱[4, 17]。本实验中,通过建立小鼠肠缺血再灌注(I/R)模型,通过免疫荧光技术发现在IECs中IL-7蛋白表达减少,同时流式细胞术检测发现IELs中IL-7受体CD127和下游信号通路蛋白STAT5磷酸化水平也下调。因此证实小肠在I/R刺激下,IL-7/IL-7R信号通路被抑制,使IELs的保护功能被减弱,加速了IELs的凋亡,在I/R下IL-7/IL-7R信号下调的机制目前还不是很清楚。实验中发现在I/R下肠上皮细胞中BMP-4分泌表达增加,与IELs上的BMP受体结合后,激活Smad信号通路,诱导炎症因子TNF-a、IL-6的释放,促进IELs的凋亡率增加[4, 18]。在胸腺细胞中发现BMP-4可通过下调CD127和STAT5蛋白磷酸化水平,来维持胸腺前体CD34+细胞的数量、功能的稳定性[5, 19]。我们假设在肠I/R损伤条件下肠黏膜细胞中IL-7/IL-7R信号通路的抑制与BMP的信号通路激活有关。通过外源性BMP4蛋白刺激IEC-6细胞培养6小时后,Western blot发现BMP-4抑制IL-7蛋白在IECs中的表达。在I/R下,IECs来源的BMP-4分泌表达增加,也会对邻近的IELs中IL-7R信号通路影响,单独分离培养IELs,给予BMP-4刺激6小时后,流式技术发现CD127、P-STAT5蛋白表达减少。给予BMP特异性拮抗剂NOGGIN联合刺激后IL-7/IL-7R信号无明显变化。我们结合前期研究,肠IECs来源的BMP4蛋白对IELs中IL-7/IL-7R信号通路下调,进一步加重肠黏膜屏障损伤。
4 结论
实验结果显示,在肠I/R下,IECs来源的BMP-4分泌表达增加,BMP-4抑制肠黏膜细胞中的IL-7/IL-7R信号通路,进一步使IELs的保护作用减弱,叠加BMP-4通过Smad、NF-kB的激活诱导TNF-a、IL-6等炎症因子的释放,促进IELs的数量减少、功能减弱,加重肠黏膜屏障功能的减弱[20]。为进一步探讨IECs-IELs的对话机制为研究预防肠黏膜屏障损害提供理论依据。
【参考文献】
[1]Guan Y, Worrell R T, Pritts T A,etal. Intestinal ischemia-reperfusion injury: reversible and irreversible damage imaged in vivo[J]. Am J Physiol Gastrointest Liver Physiol,2009,297(1):187-196.
[2]Ogata M, Itoh T. Gamma/delta intraepithelial lymphocytes in the mouse small intestine[J]. Anat Sci Int,2016,91(4):301-312.
[3]Yang H, Spencer A U, Teitelbaum D H. Interleukin-7 administration alters intestinal intraepithelial lymphocyte phenotype and function in vivo[J]. Cytokine,2005,31(6):419-428.
[4]罗彬予,陈康,冯奇,等. 缺血再灌注条件下肠上皮细胞来源的骨形成蛋白-4促进肠上皮间淋巴细胞凋亡的研究[J]. 中华实验外科杂志,2016,33(1):97-101.
[5]Varas A, Sacedon R L, Martinez V G,etal. Interplay between BMP4 and IL-7 in human intrathymic precursor cells[J]. Cell Cycle,2009,8(24):4119-4126.
[6]Ji T, Xu C, Sun L,etal. Aryl Hydrocarbon Receptor Activation Down-Regulates IL-7 and Reduces Inflammation in a Mouse Model of DSS-Induced Colitis[J]. Dig Dis Sci,2015,60(7):1958-1966.
[7]杨洋,杨桦. 肠上皮间淋巴细胞的特点及其在不同病理条件下变化规律的研究进展[J]. 中华实验外科杂志,2012,29(8):1642-1644.
[8]Cai Y J, Wang W S, Liang H Y,etal. Keratinocyte growth factor up-regulates Interleukin-7 expression following intestinal ischemia/reperfusion in vitro and in vivo[J]. Int J Clin Exp Pathol,2012,5(6):569-580.
[9]Witherden D A, Havran W L. Cross-talk between intraepithelial gammadelta T cells and epithelial cells[J]. J Leukoc Biol,2013,94(1):69-76.
[10] Andrade M E, Araujo R S, de Barros P A,etal. The role of immunomodulators on intestinal barrier homeostasis in experimental models[J]. Clin Nutr,2015,34(6):1080-1087.
[11] Ismail A S, Severson K M, Vaishnava S,etal. Gammadelta intraepithelial lymphocytes are essential mediators of host-microbial homeostasis at the intestinal mucosal surface[J]. Proc Natl Acad Sci U S A,2011,108(21):8743-8748.
[12] Qiu Y, Yu M, Yang Y,etal. Disturbance of intraepithelial lymphocytes in a murine model of acute intestinal ischemia/reperfusion[J]. Journal of Molecular Histology,2014,45(2):217-227.
[13] Yang H, Sun X, Haxhija E Q,etal. Intestinal epithelial cell-derived interleukin-7: a mechanism for the alteration of intraepithelial lymphocytes in a mouse model of total parenteral nutrition[J]. AJP: Gastrointestinal and Liver Physiology,2006,292(1):84-91.
[14] Yang H, Gumucio D L, Teitelbaum D H. Intestinal specific overexpression of interleukin-7 attenuates the alternation of intestinal intraepithelial lymphocytes after total parenteral nutrition administration[J]. Ann Surg,2008,248(5):849-856.
[15] Dalrymple N A, Mackow E R. Endothelial cells elicit immune-enhancing responses to dengue virus infection[J]. J Virol,2012,86(12):6408-6415.
[16] Ji T, Xu C, Sun L,etal. Aryl Hydrocarbon Receptor Activation Down-Regulates IL-7 and Reduces Inflammation in a Mouse Model of DSS-Induced Colitis[J]. Dig Dis Sci,2015,60(7):1958-1966.
[17] Villa X, Kuluz J W, Schleien C L,etal. Epidermal growth factor reduces ischemia-reperfusion injury in rat small intestine[J]. Crit Care Med,2002,30(7):1576-1580.
[18] Liu Y, Zuo G Q, Zhao L,etal. Effect of inflammatory stress on hepatic cholesterol accumulation and hepatic fibrosis in C57BL/6J mice[J]. Zhonghua Gan Zang Bing Za Zhi,2013,21(2):116-120.
[19] Furmanski A L, Crompton T. Shh, BMP4 and IL-7 in the maintenance and differentiation of human CD34+ progenitor cells in the thymus[J]. Cell Cycle,2009,8(23):3810.
[20] Chen K, Xie W, Luo B,etal. Intestinal Mucosal Barrier Is Injured by BMP2/4 via Activation of NF-κ B Signals after Ischemic Reperfusion[J]. Mediators of Inflammation,2016,2014(3):901530.

