猪Beclin1基因调控伪狂犬病病毒诱导细胞自噬和凋亡的机制分析
胡 林,南良康,张 敏,许苏童,杨了寒,李帅峰,王 凯,刘正飞,张淑君*(.华中农业大学动物科学技术学院,农业动物遗传育种与繁殖教育部重点实验室,武汉 430070;.华中农业大学动物医学院农业微生物学国家重点实验室,武汉 430070)
伪狂犬病病毒(pseudorabies virus,PRV)是α疱疹病毒亚科的重要成员,病毒粒子由囊膜蛋白、二十面体衣壳蛋白和线性双链DNA组成,具有嗜神经性和潜伏感染的特点[1-2]。自然宿主有猪、羊和犬等。
细胞自噬可看作是一种特殊的细胞程序性死亡,以自噬体和自噬溶酶体的聚集为特征[3]。细胞自噬和细胞凋亡过程均由细胞内的调控网络精确调节。其中,Bcl-2和Bcl-xL不仅能够与BAX/BAK样蛋白结合调节细胞凋亡,也可以与高度保守的自噬相关蛋白Beclin1互作而调控细胞自噬[4-5]。此外,Bcl-2能负调控PI3K/AKT信号和正调控mTOR信号通路从而抑制细胞自噬[6],JNK信号通路通过诱导Bcl-2多个位点(Thr69、Ser70和Ser87)的磷酸化同时调控细胞自噬和凋亡[7]。研究表明,Beclin1能被Caspases切割,切割后的Beclin1丧失诱导细胞自噬的功能,但获得促凋亡作用[8]。还原形式的HMGB1[9]、氧化形式的HMGB1[9]、ATG5[10]、被Caspase-3剪切的ATG4D[11]和Flice抑制蛋白[12]等都参与了细胞自噬或凋亡过程的调节。
细胞自噬是机体维持稳态和参与宿主对病原体反应的重要内在机制。研究表明,猪繁殖与呼吸综合征病毒(PRRSV)感染MARC145会引起细胞自噬和凋亡,当自噬被抑制时病毒复制减弱,而凋亡被抑制时病毒复制加强[13];PRRSV诱导细胞自噬,并且抑制自噬体和溶酶体的融合,从而有利于自身的复制[14]。进一步的研究结果表明,细胞自噬可以通过形成BAD/Beclin1复合物而推迟凋亡,促进PRRSV复制[15]。人巨细胞病毒(HCMV)感染人胚肺成纤维细胞MRC5后,早期细胞自噬被激活,后期病毒抑制细胞自噬,病毒蛋白TRS1和IRS1能与Beclin1 互作调控细胞自噬,当细胞自噬增强时有利于病毒复制,相反抑制细胞自噬可减少病毒感染[16],此外,HCMV感染人胚胎成纤维细胞后可通过激活mTOR信号通路显著抑制自噬体的形成,以阻止感染期间诱导的细胞自噬的发生[17]。日本脑炎病毒(JEV)在病毒感染早期诱导细胞自噬,并且将病毒粒子转运到自噬体用于病毒感染后续阶段[18]。口蹄疫病毒(FMDV)能诱导细胞自噬从而促进自身的增殖[19]。细胞自噬可以降解细胞质成分并对水疱性口炎病毒(VSV)起到直接的抗病毒作用,且该抗病毒反应由PI3K/AKT信号通路控制[20]。单纯疱疹病毒1型(HSV1)感染髓细胞BM-DCs可激活IFN基因诱导细胞自噬,伪狂犬病病毒(PRV)感染BM-DCs同样可以激活BM-DCs自噬[21]。
PRV宿主较多、病毒株易重组和变异等特点给有效预防病毒的传播和根除该病带来了困难。细胞自噬对抵抗病毒侵袭或促进病毒增殖具有重要的调控作用,而其调控机制非常复杂。目前对人单疱疹病毒1型(HSV1)感染与细胞自噬相互作用机制的研究[22]较多,而对同样属于疱疹病毒科的PRV的相关研究较少。鉴于此,本研究以猪伪狂犬病毒(PRV)为对象,以宿主猪细胞PK-15为研究材料,研究PRV感染在宿主细胞自噬和凋亡中的作用,探讨PRV感染过程中PRV诱导的细胞自噬和凋亡水平变化以及调控的途径,分析Beclin1与猪宿主凋亡家族基因的相互作用、PRV诱导细胞自噬的可能性机制,以期阐明猪Beclin1基因在细胞自噬和凋亡中的调节作用,为相关研究提供参考。
1 材料与方法
1.1 病毒与细胞
伪狂犬病毒鄂a株(PRV-Ea)由农业微生物国家重点实验室刘正飞老师提供。猪肾上皮细胞(porcine kidney-15 cell line,PK-15)为本实验室保存。PK-15细胞呈贴壁生长,为梭形上皮细胞系,细胞间连接紧密,生长迅速,培养于37 ℃,5% CO2条件下;细胞培养基为高糖DMEM,添加10%胎牛血清。
1.2 主要试剂与仪器
细胞裂解液RIPA、苯甲基磺酰氟PMSF、Cocktail、磷酸酶抑制剂、SDS-PAGE蛋白质缓冲液(5×)和Protein A+G Agarose均购于碧云天生物技术公司。LC3A (NO4599P)、SQSTM1/P62(P0068)、Beclin1 (NO4122S)、Cleaved Caspase-9 (NO9509) 、Cleaved Caspase-8 (NO9496) 、Bcl-2 (NO4223) 和Bcl-xL (NO2764) 单克隆抗体购于CST公司。伪狂犬病病毒的衣壳蛋白抗体VP26由农业微生物学国家重点实验室制备和馈赠。细胞凋亡检测试剂盒AnnexinV-FITC购于凯基生物(KGA106)。
CFX96实时荧光定量PCR仪购于BioRad公司。蛋白免疫印迹转移电泳仪JY-ZY5购于北京君意华鑫科技有限公司。ImageQuant LAS 4000化学发光成像分析仪购于通用医疗集团生命科学部。
1.3 荧光定量PCR
利用Thermo反转录试剂盒逆转录合成cDNA进行反转录,最后保存在-20 ℃。利用合成好的cDNA进行荧光定量PCR。在荧光定量PCR中,内参基因常被用来作为数据标准化的对照,用来校正模板cDNA存在的数量差异。良好的内参基因应该在不同实验条件下或不同时间点上,在各个样品中的表达都无差异,本试验选择GAPDH作为内参基因,定量引物及内参基因序列见表1。引物由上海生物工程技术服务有限公司和擎科生物合成。
表1基因qPCR引物
Table1PrimersofgenesforqPCR
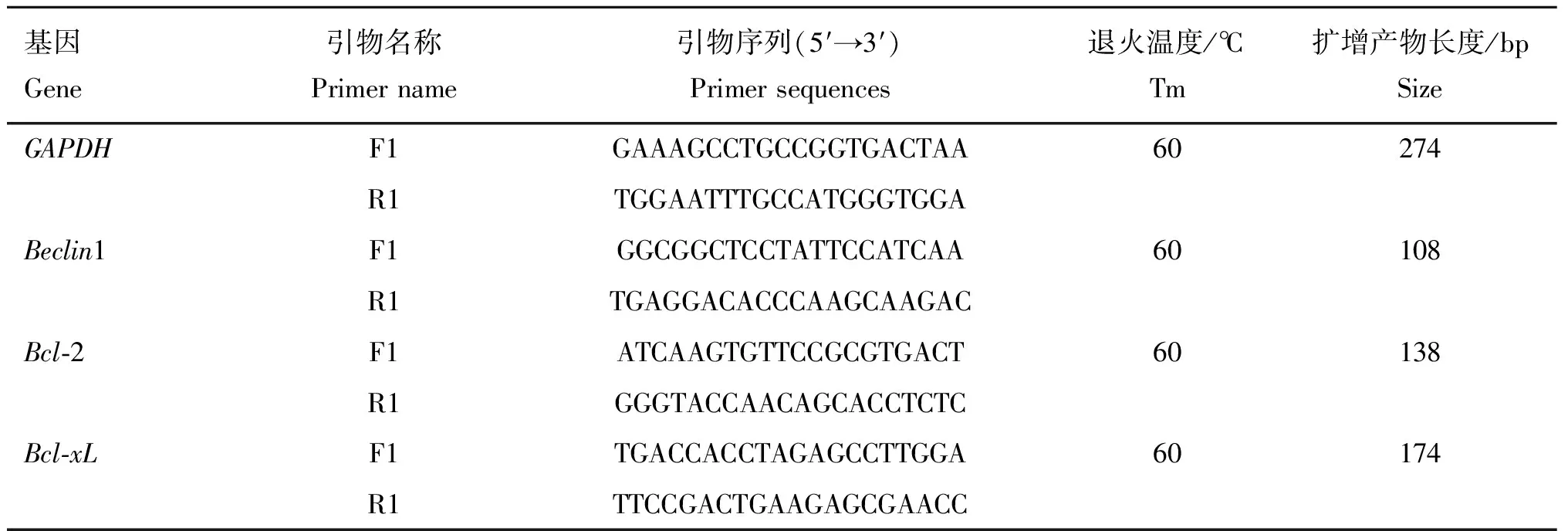
基因Gene引物名称Primername引物序列(5′→3′)Primersequences退火温度/℃Tm扩增产物长度/bpSizeGAPDHF1GAAAGCCTGCCGGTGACTAA60274R1TGGAATTTGCCATGGGTGGABeclin1F1GGCGGCTCCTATTCCATCAA60108R1TGAGGACACCCAAGCAAGACBcl⁃2F1ATCAAGTGTTCCGCGTGACT60138R1GGGTACCAACAGCACCTCTCBcl⁃xLF1TGACCACCTAGAGCCTTGGA60174R1TTCCGACTGAAGAGCGAACC
利用荧光定量PCR仪反应,反应结束后分析数据。每个PCR反应设置3个重复,候选基因表达量按2-ΔΔCt计算方法对以上相关基因的表达水平进行相对定量分析。基因表达量数据由SPSS 16.0软件进行方差和显著性检验并作图。
1.4 细胞免疫共沉淀
蛋白样品的准备。对于100 mm细胞培养皿中的贴壁细胞,弃细胞培养液,PBS洗涤一次,然后加入1 mL RIPA裂解细胞;去除非特异性结合。取0.2~1 mL蛋白样品,加入约1 μg和免疫沉淀使用的IgG种属相同的普通IgG和20 μL充分重悬的Protein A+G Agarose,4 ℃缓慢摇动0.5~2 h。2 500 r·min-1离心5 min,取上清液用于免疫沉淀试验;免疫沉淀。向上一步获得的上清中加入0.2~2 μg用于免疫沉淀的第一抗体,4 ℃缓慢摇动过夜;再加入20 μL充分重悬的Protein A+G Agarose,4 ℃缓慢摇动1~3 h;2 500 r·min-1离心5 min,小心吸除上清;用PBS洗涤沉淀5次,加入20~40 μL 1×SDS-PAGE蛋白质缓冲液重悬沉淀,瞬时高速离心,将样品离心于管底。沸水处理5 min,用于SDS-PAGE电泳。
1.5 免疫印迹
按20 μg的蛋白上样量进行SDS-PAGE凝胶电泳,100 V恒压转膜1 h,5%脱脂奶粉室温封闭2 h,分别加入“1.2”所列的单克隆抗体, β-actin单克隆抗体(1∶3 000),4 ℃孵育过夜,洗膜后加入抗兔或抗鼠的HPR标记二抗(1∶3 000),室温孵育2 h,洗膜后加入ECL显色液,利用化学发光成像分析仪成像,并用ImageJ图像分析软件分析灰度值。
1.6 细胞凋亡检测
收集细胞悬液,220 g离心后用含2%胎牛血清的1×PBS将细胞重悬,220 g离心10 min收集细胞,重复2次,每管中细胞量为5×105·mL-1;加500 μL Binding buffer 悬浮细胞;加入5 μL Annexin V-FITC和5 μL PI,室温避光孵育5~15 min;在1 h 内,进行流式细胞仪的检测激发波长Ex为488 nm;发射波长Em为530 nm的Annexin V-FITC绿色荧光通过FITC通道(FL1)检测;PI红色荧光通过PI通道(FL2或FL3)检测,建议使用FL3;荧光补偿调节:使用未经处理的正常细胞,作为对照进行荧光补偿调节去除光谱重叠和设计十字门的位置;每次使用流式细胞仪进行检测,必须使用未经凋亡试剂处理的正常细胞进行荧光补偿调节,加入Annexin V-FITC单独染色的正常细胞,加入PI染色的正常细胞与加入Annexin V-FITC和PI双染的正常细胞作为对照进行检测。
1.7 数据分析

2 结 果
2.1 PRV感染诱导LC3-Ⅱ表达上升、P62表达下降
细胞自噬过程中会伴随着胞浆型LC3被酶切成LC3-Ⅰ,其与磷脂酰乙醇胺(PE)结合转变为LC3-Ⅱ,因此LC3-Ⅱ表达水平的明显增加是细胞自噬发生的标志。试验结果表明,随着PRV感染进程的推移,PRV衣壳蛋白VP26的表达量显著升高,LC3-Ⅱ的表达水平明显增加(图1)。

***.P<0.001
图1 PRV感染中PK-15细胞的自噬标志蛋白LC3-Ⅱ和病毒衣壳蛋白VP26的表达变化Fig.1 LC3-Ⅱand VP26 expression in PK-15 cells during PRV infection
自噬的标记蛋白除了LC3,SQSTM1/P62蛋白也同样可以作为标记蛋白。SQSTM1/P62是一种涉及自噬的泛素化结合蛋白(P62)。偶联于LC3的P62能够在细胞自噬中晚期被自噬体降解[17]。在自噬过程中,P62表达水平与细胞自噬正相关;相反,自噬抑制剂可以稳定P62的水平。试验结果表明,随着PRV感染进程的推移,PRV衣壳蛋白VP26的表达量显著升高,P62的表达量明显的减少(图2)。

***.P<0.001
图2 PRV感染中PK-15细胞的自噬标志蛋白P62的表达变化Fig.2 P62 expression in PK-15 cells during PRV infection
2.2 PRV感染诱导的细胞自噬可能依赖于PI3K-Ⅰ/AKT通路
调控自噬的通路具体包括mTOR、AMPK、PI3K-Ⅰ/AKT和MAPK等通路。mTOR上游的PI3K-Ⅰ/AKT信号通路,可以激活mTOR。 AKT是丝氨酸/苏氨酸蛋白激酶。研究表明,细胞自噬受PI3K/AKT的控制,此途径的激活能促进mTOR[20]。本试验利用WB检测了感染PRV后AKT和p-AKT(Ser473)蛋白表达水平。结果显示,AKT蛋白表达水平无明显变化(图3A),而p-AKT的表达水平随时间的延长而极显著地下降(图3B)。由此推测当PRV感染PK-15细胞后,通过下调p-AKT蛋白水平的表达,从而减少对mTOR的促进作用,从而诱导自噬的发生。这些结果表明PRV感染诱导自噬可能依赖于PI3K-Ⅰ/AKT通路。

A. WB检测PRV刺激后PK-15细胞AKT表达不变;B. WB 检测PRV刺激后PK-15细胞p-AKT表达下降; ***.P<0.001A. WB analysis of AKT expression in PK-15 cells unchanged before and after treatment PRV; B. WB analysis of p-AKT expression in PK-15 cells decreased after treatment PRV; ***. P<0.001
图3 PRV感染PK-15细胞AKT和p-AKT蛋白表达水平Fig.3 AKT and p-AKT expression in PK-15 cells during PRV infection
2.3 PRV感染诱导细胞凋亡
Annexin V用来检测细胞的早期凋亡水平。PI是一种利用细胞通透性区分早期和晚期凋亡的荧光染料。PRV处理12和24 h的凋亡情况相对于对照组,凋亡水平极显著上升;处理24 h相对于12 h,早期凋亡相较于晚期凋亡明显增加(图4)。
2.4 PRV感染诱导细胞凋亡同时激活Caspase-9和Caspase-8蛋白
Pro-Caspase-9能被细胞质中APAF1和Caspase-9的结合激活,进而活化Caspase-3诱导细胞凋亡发生。死亡受体途经主要通过Cleaved Caspase-8调控,其不仅可以活化下游的效应Caspase-3,也可以通过剪切BID蛋白从而抑制BAK/BAX样蛋白。WB检测结果显示,感染PRV的试验组相较于对照组Cleaved Caspase-9的蛋白水平极显著上升,在感染6 h时达到顶峰(图5A);同样,Cleaved Caspase-8的蛋白水平也极显著上升,在感染24 h时达到顶峰(图5B)。
2.5 PRV感染抑制Beclin1和Bcl-2、Bcl-xL结合进而促进细胞自噬
Beclin1可以与VPS34、p150/VPS15、紫外线照射抗性相关基因(UVRAG)、ATG14样蛋白(ATG 14L)和Rubicon蛋白结合,形成一个大的蛋白复合体。首先,检测了Beclin1的mRNA和蛋白质水平,结果显示PRV感染能够刺激Beclin1的mRNA水平逐步上升,感染24 h前显著上升(图6A),然后再下降。同时,12、24 h Beclin1在蛋白表达水平显著增加(图6B和C)。
本研究检测了Bcl-2的mRNA和蛋白水平,结果显示PRV感染能够刺激Bcl-2的mRNA水平先上升后下降,感染6 h显著上升然后逐渐下降,在36 h极显著下降(图7A)。同时,24 h前Bcl-2在蛋白水平上的表达随着时间的改变极显著上升(图7B和C)。
本研究利用RT-qPCR检测了Bcl-xL的mRNA水平,结果显示PRV感染能够刺激Bcl-xL的mRNA水平发生改变,24 h前极显著上升,然后下降(图8A)。同时,本研究利用WB检测了Bcl-xL蛋白水平,24 h前Bcl-xL在蛋白水平上的表达呈现逐步上升的趋势(图8B和C)。
Bcl-2、Bcl-xL和Beclin1都含有BH3结构域,结合形成的抗自噬复合体Beclin1/Bcl-2和Beclin1/Bcl-xL,从而抑制Beclin1的促自噬作用[23]。因此,本研究通过免疫共沉淀试验检测感染PRV的PK-15 细胞中Beclin1与Bcl-2和Bcl-xL相互作用,结果显示对照组和PRV处理组中Beclin1都能同Bcl-2和Bcl-xL结合,但是PRV感染试验组相较对照组Beclin1与Bcl-2和Bcl-xL结合量明显减弱(图9)。说明PRV感染PK-15细胞后Beclin1能够与Bcl-2、Bcl-xL结合,但是结合量减少,从而可能促进细胞自噬。
3 讨 论
细胞自噬和凋亡是两个进化过程中高度保守的生理过程,二者对生长发育至关重要,两者失调则会破坏机体稳态。先前研究表明HSV1和PRV感染复数为3时感染BM-DCs早期(6 h)会导致细胞自噬[21]。English等[24]研究结果表明HSV1感染巨噬细胞细胞系诱导的细胞自噬不依赖PKR/eIF2α信号通路。因此,本研究旨在揭示PRV感染PK-15晚期是否同样能诱导细胞自噬。
本研究首先揭示了PRV感染可以诱导细胞自噬。并利用细胞荧光观察到细胞质中弥散性LC3以独特的斑点状重新分布的现象进一步说明PRV感染诱导细胞自噬。通过LC3-Ⅱ和P62蛋白表达量在PRV感染后的变化情况可初步推断PRV感染PK-15诱导细胞自噬相较于BM-DCs出现的时间明显晚一些。随后,通过检测p-AKT表达水平随时间变化表明PRV感染PK-15诱导的细胞自噬可能依赖于PI3K/AKT信号通路。这与Shelly等[20]报道的VSV感染通过降低p-AKT磷酸化诱导细胞自噬的结果相一致。

***.P<0.001
图4 Annexin V-FITC/PI双染流式细胞术检测的感染PRV的PK-15细胞凋亡水平上升Fig.4 Flow cytometry detection apoptosis of PK-15 cells enhanced by using Annexin V-FITC/PI staining

A. WB检测PRV刺激的PK-15细胞不同时间Cleaved Caspase-9蛋白表达上升;B. WB检测PRV刺激的PK-15细胞不同时间Cleaved Caspase-8蛋白表达上升;**.P<0.01;***.P<0.001A. WB analysis of Cleaved Caspase-9 expression in PK-15 cells increased after treatment PRV at all times investigated; B. WB analysis of Cleaved Capase-8 expression in PK-15 cells increased after treatment PRV at all times investigated; **.P<0.01;***.P<0.001
图5 PRV感染的PK-15细胞Cleaved Caspase-9和Caspase-8蛋白表达水平上升Fig.5 Cleaved Caspase-9 and Cleaved Caspase-8 expression increased in PK-15 cells during PRV infection

A. RT-qPCR检测PRV感染的PK-15细胞Beclin1的mRNA表达水平升高;B. WB检测PRV感染的PK-15细胞Beclin1蛋白表达上升;C. Beclin1蛋白表达灰度分析结果;*.P<0.05;**.P<0.01;***.P<0.001A. RT-qPCR analysis of Beclin1 mRNA level increased in PK-15 cells during PRV infection; B. WB analysis of Beclin1 expression increased in PK-15 cells during PRV infection; C. The grayscale analysis of Beclin1 protein; *.P<0.05;**.P<0.01;***.P<0.001
图6 PRV感染PK-15细胞Beclin1的mRNA和蛋白水平变化Fig.6 Transcription and translation level of Beclin1 in PK-15 cells during PRV infection

A. RT-qPCR检测PRV感染的PK-15细胞Bcl-2的mRNA表达水平升高;B. WB检测PRV感染的PK-15细胞Bcl-2蛋白表达上升;C. Bcl-2蛋白表达灰度分析结果;*.P<0.05;**.P<0.01;***.P<0.001A. RT-qPCR analysis of Bcl-2 mRNA level increased in PK-15 cells during PRV infection; B. WB analysis of Bcl-2 expression increased in PK-15 cells during PRV infection; C. The grayscale analysis of Bcl-2 protein; *.P<0.05;**.P<0.01;***.P<0.001
图7 PRV感染PK-15细胞Bcl-2的mRNA和蛋白水平变化Fig.7 Transcription and translation level of Bcl-2 in PK-15 cells during PRV infection

A. RT-qPCR检测PRV感染的PK-15细胞Bcl-xL的mRNA表达水平升高;B. WB检测PRV感染的PK-15细胞Bcl-xL蛋白表达上升;C. Bcl-xL蛋白表达灰度分析结果;***.P<0.001A. RT-qPCR analysis of Bcl-xL mRNA level increased in PK-15 cells during PRV infection; B. WB analysis of Bcl-xL expression increased in PK-15 cells during PRV infection; C. The grayscale analysis of Bcl-xL protein; ***. P<0.001
图8 PRV感染PK-15细胞Bcl-xL的mRNA和蛋白水平变化Fig.8 Transcription and translation level of Bcl-xL in PK-15 cells during PRV infection

A. Beclin1与Bcl-2蛋白免疫共沉淀;B. Beclin1与Bcl-xL蛋白免疫共沉淀A. Co-IP analysis the interaction of Beclin1 and Bcl-2; B. Co-IP analysis the interaction of Beclin1 and Bcl-xL
图9 PRV感染的PK-15细胞Beclin1与Bcl-2、Bcl-xL蛋白结合量减少Fig.9 Interaction of Beclin1/Bcl-2 and Beclin1/Bcl-xL decreased in PRV-infected PK-15
细胞自噬和凋亡虽然是两种功能具有一定差异的生命活动,但二者却存在着密切的关联。用流式细胞术检测了PRV感染PK-15细胞凋亡情况,说明感染PRV诱导PK-15细胞凋亡并且在感染12~24 h时间段内细胞发生早期凋亡和晚期凋亡的比率明显升高,从而推测细胞自噬可能早于细胞凋亡发生。这与Zhou等[15]报道的PRRSV感染诱导的细胞自噬早于细胞凋亡的结果相似。同时,本研究还初步探讨了PRV感染诱导的细胞凋亡依赖的细胞信号通路。常见的两种细胞凋亡信号通路是涉及病毒复制并导致Caspase-9活化的细胞内在途径和依赖于细胞表面可溶性死亡效应配体Caspase-8激活的细胞外途径[25]。研究结果表明PRV感染诱导的细胞凋亡同时依赖于细胞内和细胞外两个凋亡信号通路,在感染的早期主要依赖于细胞内途径,在感染晚期主要依赖于细胞外途径。推测PRV感染宿主细胞后集体为了抵抗病毒首先启动的Bcl-2家族蛋白依赖的细胞凋亡通路,通过释放细胞色素C活化Caspase-9;然后感染晚期,当Bcl-2家族信号减弱时,通过死亡受体通路激活Caspase-8,促进细胞凋亡释放成熟的病毒粒子。
4 结 论
PRV感染诱导的细胞自噬可能依赖于PI3K-Ⅰ/AKT信号通路,PRV感染可能同时激活了线粒体凋亡途经和死亡受体途经从而诱导细胞凋亡,而PRV感染诱导的细胞自噬和细胞凋亡可能通过抑制Beclin1和Bcl-2、Bcl-xL结合而相互关联。
参考文献(References):
[1] HUANG J, MA G J, FU L L, et al. Pseudorabies viral replication is inhibited by a novel target of miR-21[J].Virology, 2014, 456-457: 319-328.
[2] POMERANZ L E, REYNOLDS A E, HENGARTNER C J. Molecular biology of pseudorabies virus:Impact on neurovirology and veterinary medicine[J].MicrobiolMolBiolRev, 2005, 69(3):462-500.
[3] EDINGER A L,THOMPSON C B.Death by design:Apoptosis,necrosis and autophagy[J].CurrOpinCellBiol, 2004, 16(6):663-669.
[4] PATTINGRE S, TASSA A, QU X P, et al. Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy[J].Cell, 2005, 122(6):927-939.
[5] MAIURI M C, LE TOUMELIN G, CRIOLLO A, et al. Functional and physical interaction between Bcl-XLand a BH3-like domain in Beclin-1[J].EMBOJ, 2007, 26(10):2527-2539.
[7] HAM Y M, CHUN K H, CHOI J S, et al.SEK1-dependent JNK1 activation prolongs cell survival during G-Rh2-induced apoptosis[J].BiochemBiophysResCommun, 2003, 304(2):358-364.
[8] WIRAWAN E, VANDE WALLE L, KERSSE K, et al.Caspase-mediated cleavage of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria[J].CellDeathDis, 2010, 1:e18.
[9] TANG D L,KANG R,CHEH C W, et al. HMGB1 release and redox regulates autophagy and apoptosis in cancer cells[J].Oncogene, 2010, 29(38):5299-5310.
[10] YOUSEFI S, PEROZZO R, SCHMID I, et al.Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J].NatCellBiol, 2006, 8(10):1124-1132.
[11] BETIN V M S, LANE J D. Caspase cleavage of Atg4D stimulates GABARAP-L1 processing and triggers mitochondrial targeting and apoptosis[J].JCellSci, 2009, 122(14):2554-2566.
[12] LEE J S,LI Q L,LEE J Y,et al.FLIP-mediated autophagy regulation in cell death control[J].NatCellBiol,2009,11(11):1355-1362.
[13] LI S F, ZHOU A, WANG J X, et al.Interplay of autophagy and apoptosis during PRRSV infection of Marc145 cell[J].InfectGenetEvol, 2016, 39:51-54.
[14] SUN M X, HUANG L, WANG R, et al. Porcine reproductive and respiratory syndrome virus induces autophagy to promote virus replication[J].Autophagy, 2012, 8(10):1434-1447.
[15] ZHOU A, LI S F, KHAN F A, et al. Autophagy postpones apoptotic cell death in PRRSV infection through Bad-Beclin1 interaction[J].Virulence, 2016, 7(2):98-109.
[16] MOUNA L, HERNANDEZ E, BONTE D, et al. Analysis of the role of autophagy inhibition by two complementary human cytomegalovirus BECN1/Beclin 1-binding proteins[J].Autophagy, 2016,12(2):327-342.
[17] CHAUMORCEL M, SOUQURE S, PIERRON G, et al.Human cytomegalovirus controls a new autophagy-dependent cellular antiviral defense mechanism[J].Autophagy, 2008, 4(1):46-53.
[18] LI J K, LIANG J J, LIAO C L, et al. Autophagy is involved in the early step of Japanese encephalitis virus infection[J].MicrobesInfect, 2012, 14(2):159-168.
[19] O'DONNELL V, PACHECO J M, LAROCCO M, et al. Foot-and-mouth disease virus utilizes an autophagic pathway during viral replication[J].Virology, 2011, 410(1):142-150.
[20] SHELLY S, LUKINOVA N, BAMBINA S, et al. Autophagy is an essential component ofDrosophilaimmunity against vesicular stomatitis virus[J].Immunity, 2009, 30(4):588-598.
[21] RASMUSSEN S B, HORAN K A, HOLM C K, et al. Activation of autophagy by α-herpesviruses in myeloid cells is mediated by cytoplasmic viral DNA through a mechanism dependent on stimulator of IFN genes[J].JImmunol, 2011, 187(10):5268-5276.
[22] NAGELKERKE A, SWEEP F C G J, GEURTS-MOESPOT A, et al. Therapeutic targeting of autophagy in cancer. Part I: Molecular pathways controlling autophagy[J].SeminCancerBiol, 2015, 31:89-98.
[23] OBERSTEIN A, JEFFREY P D, SHI Y G. Crystal structure of the Bcl-XL-Beclin 1 peptide complex:Beclin 1 is a novel BH3-only protein[J].JBiolChem, 2007, 282(17):13123-13132.
[24] ENGLISH L, CHEMALI M, DURON J, et al. Autophagy enhances the presentation of endogenous viral antigens on MHC class I molecules during HSV-1 infection[J].NatImmunol, 2009, 10(5):480-487.
[25] JOUBERT P E, WERNEKE S W, DE LA CALLE C, et al. Chikungunya virus-induced autophagy delays caspase-dependent cell death[J].JExpMed, 2012, 209(5):1029-1047.

