缺血性脑卒中患者血浆microRNA-23a/30a水平变化及其临床意义
贺文涛 耿纪超
随着经济的发展、人民生活水平的提高以及人口老龄化的到来,缺血性脑卒中(脑梗死)的发病率呈逐年上升趋势。缺血性脑卒中具有较高复发率、致残率、病死率的特点,积极探讨其发病机制对防治脑卒中具有重要的临床意义。有研究显示,microRNA(miRNA)在脑血管疾病的发生与发展中发挥着重要的作用[1]。人体内的miRNA至少调控着30%的人类基因,miRNA不仅参与人体正常生理功能的调节,而且与多种病理过程密切相关[2-3]。本研究选取miRNA-23a/30a水平进行检测,初步探讨其在缺血性脑卒中的作用,现报道如下。
1 资料与方法
1.1 一般资料
选取本院神经内科自2014年7月-2015月7月收治的40例缺血性脑卒中患者作为研究对象,所有患者均在48 h内入院,其中男25例,女15例;年龄42~79岁,平均年龄(63.3±4.6)岁;发病至就诊时间(1.36±0.52)d;合并糖尿病6例,高血压病5例,高脂血症4例,冠状动脉粥样硬化性心脏病(冠心病)4例。根据入院时临床神经功能缺损评分标准[4](中国),将入选患者分为轻型组(<30分)和重型组(≥30分)。其中轻型组20例,男12例,女8例,年龄41~77岁,平均年龄(63.3±4.6)岁,发病至就诊时间(1.36±0.52)d,合并糖尿病5例,高血压病4例,高脂血症3例,冠心病6例;重型组20例,男13例,女7例,年龄42~78岁,平均年龄(64.6±5.1)岁,发病至就诊时间(1.42±0.42)d,合并糖尿病4例,高血压病5例,高脂血症2例,冠心病5例。2组患者的性别、年龄、发病至就诊时间、合并症等指标比较无明显差异(P>0.05)。并同期选取20例性别、年龄相匹配的体检健康者作为对照组。所有入选患者均符合全国第四届脑血管病学术会议修订的诊断标准(1995年);排除标准:①合并有脑出血者,既往有脑卒中病史者;②近期内有创伤手术史者;③心肺肝肾功能不全者;④伴有恶性肿瘤、血液系统疾病、免疫性疾病者,本研究遵守《赫尔辛基宣言》,并通过本院医学伦理委员会批准。本研究的目的、方法、可能后果向患者及家属交待清楚,并签署书面知情同意书。
1.2 2组miRNA的相对表达水平检测
血浆miRNA样本的收集:分别采集轻型组、重型组和对照组外周血5 mL,3000 r/min,4℃ 离心10 min,取上层血浆移至1.5 mL离心管(eppendorf tubes,EP)中,-80℃冰箱保存。血浆总RNA的提取:标本解冻后进行两相分离,通常RNA分布于上层无色水相中;取上层液进行RNA沉淀,管底出现白色沉淀,将获得的白色沉淀进行洗涤和溶解, DU800型分光光度计测定RNA的浓度及纯度;随即进行逆转录反应,将获得的逆转录产物保存于-20℃的冰箱中。实时定量荧光聚合酶链反应(quantitative real-time polymerase chain reaction,Real-time qPCR)技术检测microRNA-23a/30a的水平,Real-time qPCR引物合成由英潍捷基(上海)贸易有限公司提供,PCR引物序列:miRNA-30a和miRNA-23a分别为5’-ATGGTTCGTGGGTGTAAACATCCTCG-3’;5’-AUCACAUUGCCAGGGAUUUCC-3’,内参照基因为U6 RNA。严格按照 Access RT-PCR System 试剂盒说明书进行操作。由计算机上的SDS软件计算每个样品和内参的Ct值,△Ct=Ct目标基因-Ct内参基因,缺血性脑卒中患者与对照组miRNA的相对表达水平用公式计算=2-(Ct目标基因-Ct内参基因)。
1.3 统计学处理
2 结 果
2.1 轻型组、重型组和对照组血浆miRNA-23a/30a水平的比较
入院时轻型组与重型组血浆miRNA-23a/30a水平分别与对照组比较,重型组明显高于对照组(P<0.05),而轻型组与对照组比较无明显差异(P>0.05)(表1)。
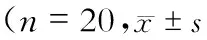
表1 轻型组、重型组和对照组血浆miRNA-23a/30a水平的比较)
注:与轻型组、对照组比较,*P<0.05
2.2 轻型组和重型组治疗前后血浆miRNA-23a/30a水平的比较
轻型组和重型组不同时间点的血浆miRNA-23a/30a水平进行比较,2组患者在入院1周时血浆水平达到高峰(P<0.05),其后逐步下降,重型组患者维持在较高水平(表2)。
2.3 治疗1周后血浆miRNA-23a/30a水平与病情严重程度的相关性分析
治疗1周后血浆miRNA-23a/30a水平与病情严重程度进行Spearman秩相关的非参数分析显示,血浆miRNA-23a/30a水平与病情严重程度呈正相关(r=0.917,P<0.05)(图1)。
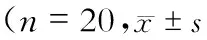
表2 轻型组和重型组治疗前后血浆miRNA-23a/30a水平的比较)
注:与同组入院时、入院2周比较,*P<0.05;与轻型组比较,△P<0.05

图1 血浆miRNA-23a/30a水平与病情严重程度的相关性分析
3 讨 论
脑卒中(脑血管意外)是在一系列诱发因素作用下引起的脑血液循环功能障碍,分出血性和缺血性脑卒中两大类,其中以缺血性脑卒中为主,脑卒中预后较差,致残率、复发率、致死率较高。缺血性脑卒中具有复杂的病理生理过程,受遗传、环境、基因等多种因素相互作用,是多种机制共同作用的结果,包括能量障碍、细胞酸中毒、氧自由基损伤、一氧化氮NO等多种因素作用,在高血压、高血糖、高血脂及动脉粥样硬化等基础上经过脑血管内皮细胞受损、血小板粘附聚集、血管内膜增殖等一系列的复杂演变过程最终导致血栓形成[5-6]。尽管针对脑卒中危险因素进行积极干预,但脑卒中的发病率并未呈下降趋势。随着分子生物学和生物信息学技术的发展,人们逐步认识到一些不可干预因素如表观遗传调控在脑血管疾病的发生与发展中扮演重要角色。在表观遗传学中DNA序列不发生变化,但基因表达却发生了可遗传的改变。有研究显示,miRNA是表观遗传调控机制中最重要的组成部分之一[7]。
miRNA是一类非编码单链小分子RNA,由21~23个核苷酸组成,1个miRNA可以调节几个不同的mRNA,不同的miRNA可以调节同1个mRNA,因此其在基因遗传调控中的机制极其复杂。迄今为止,miRNA已发现了100多个,目前大量的基础实验研究普遍认为这些小分子RNA可能是1个庞大的miRNA家族,并不是简单的破碎产物,其在不同疾病、不同水平上可能发挥着重要作用[8]。尽管如此,有很多方面仍不明了。目前,miRNA-23a/30a在缺血性脑卒中的研究未见相关报道,本研究根据相关文献报道[9]选取miRNA-23a/30a水平进行检测,初步探讨其在缺血性脑卒中的作用。已知miRNA-23a定位于19号染色体(19p13.13)上,主要在转录水平调控基因的表达[10-11],miRNA-30a是miR30家族中一员,有研究显示miRNA-30a通过靶向调节线粒体分裂来调节细胞凋亡,其在自噬调节中发挥重要作用[12-13],但其在心脑血管疾病方面的研究较少。
本研究结果显示,重型组入院时血浆中miRNA-23a/30a水平明显高于对照组,提示重型脑卒中患者血浆中miRNA-23a/30a水平呈高表达,两者在治疗后1周达到最高水平,且重症组血浆中miRNA-23a/30a水平明显高于轻型组,提示病情越重,二者的水平越高。本研究结果还显示,血浆microRNA-23a/30a水平与病情严重程度呈正相关(r=0.917,P<0.05),提示两者可能共同参与了缺血性脑卒中的发生发展。这与相关研究结果[14-15]一致。
综上所述,外周血miRNA-23a/30a表达水平与缺血性脑卒中关系密切,随着miRNA与缺血性脑卒中关系研究的不断深入,进行外周血miRNA-23a/30a水平测定有望成为缺血性脑卒中患者的病情严重程度和发病风险预测的1个重要客观生物标志物,为临床诊治缺血性脑卒中提供了新的思路。
[1] Jickling GC,Ander BP,Zhan XH,et al.microRNA expression in peripheral blood cells following acute ischemic stroke and their predicted gene targets[J].PLoS One,2014,9(6):0099283.
[2] Duan XM,Zhan Q,Song BX,et al.Detection of platelet microRNA expression in patients with diabetes mellitus with or without ischemic stroke[J].J Diabetes Complications,2014,28(5):705-710.
[3] Liu Y,Zhang J,Han R,et al.Downregulation of serum brain specific microRNA is associated with inflammation and infarct volume in acute ischemic stroke[J].J Clin Neurosci,2015,22(2):291-295.
[4] 赵晓晶,李群喜,安雅臣,等.多种量表在急性脑梗死中的应用和数学模型的建立[J].中华神经医学杂志,2014,13(7):722-726.
[5] Quan Z,Quan Y,Wei B,et al.Protein-protein interaction network and mechanism analysis in ischemic stroke[J].Mol Med Rep,2015,11(1):29-36.
[6] Dubow JS,Salamon E,Greenberg E,et al.Mechanism of acute ischemic stroke in patients with severe middle cerebral artery atherosclerotic disease[J].J Stroke Cerebrovasc Dis,2014,23(5):1191-1194.
[7] Osella M,Riba A,Testori A,et al.Interplay of microRNA and epigenetic regulation in the human regulatory network[J].Front Genet,2014,5(6):345.
[8] Gao L,Microrna JF.(mirna)profiling[J].Methods Mol Biol,2016,1381:151-161.
[9] Toro Cabrera G,Mueller C.Design of shRNA and miRNA for delivery to the CNS[J].Methods Mol Biol,2016,1382:67-80.
[10] Wang WL,Yang C,Han XL,et al.MicroRNA-23a expression in paraffin-embedded specimen correlates with overall survival of diffuse large B-cell lymphoma[J].Med Oncol,2014,31(4):919.
[11] Sun LY,Wang N,Ban T,et al.MicroRNA-23a mediates mitochondrial compromise in estrogen deficiency-induced concentric remodeling via targeting PGC-1α[J].J Mol Cell Cardiol,2014,75(10):1-11.
[12] O'brien JH,Hernandez-Lagunas L,Artinger KB,et al.MicroRNA-30a regulates zebrafish myogenesis through targeting the transcription factor Six1[J].J Cell Sci,2014,127(Pt 10):2291-2301.
[13] Wang HY,Li YY,Fu S,et al.MicroRNA-30a promotes invasiveness and metastasis in vitro and in vivo through epithelial-mesenchymal transition and results in poor survival of nasopharyngeal carcinoma patients[J].Exp Biol Med (Maywood),2014,239(7):891-898.
[14] Rink C,Khanna S.MicroRNA in ischemic stroke etiology and pathology[J].Physiol Genomics,2011,43(10):521-528.
[15] Liu ME,Liao YC,Lin RT,et al.A functional polymorphism of PON1 interferes with microRNA binding to increase the risk of ischemic stroke and carotid atherosclerosis[J].Atherosclerosis,2013,228(1):161-167.

