甘蔗宿根矮化病多克隆抗体和免疫磁珠的制备
郭莺 汪文华 刘黎卿 胡敏
(1. 福建省亚热带植物研究所 福建省生理生化重点实验室,厦门 361006;2. 华侨大学化工学院,厦门 361021)
甘蔗宿根矮化病(Ratoon stunting disease,RSD)是一种普遍存在于蔗区的世界性病害[1],在干旱的情况下感病品种的宿根蔗产量损失可达50%以上[2]。1944-1945年在澳大利亚昆士兰的甘蔗品种Q28上首次被发现[3]。一旦感病,植株表现矮化、分蘖少、蔗茎变细、节间变短等,但外表无明显的病斑,故常常与干旱、养分不足等造成的生长不良症状相混淆[4]。甘蔗宿根矮化病病原菌(Leifsonia xyli subsp.xyli,Lxx)为棒状杆菌属[5],寄生于蔗株的木质部导管中,可以侵染甘蔗属所有已知品种,但不侵染其他植物[6]。Lxx病原细菌特别细小,分离、培养和检测都极其困难,给研究带来了很大的难度。免疫磁珠分离技术(Immunomagnetic separation,IMS)是一种以特异的抗原抗体反应为基础的免疫学检测和分离技术。它是以抗体包被的磁珠为载体,通过抗体与反应介质中特异性抗原结合,形成抗原——抗体复合物,此复合物在外加磁场的作用下发生了定向移动,从而达到分离抗原的目的。本文以感病的拔地拉为材料,从中分离获得Lxx病原菌进行多克隆抗体制备,并采用免疫磁珠技术标记Lxx抗体对Lxx菌进行富集,这样为直接从甘蔗汁液中获得大量纯的Lxx菌用于病原菌与寄主互作研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 供试甘蔗 甘蔗热带种拔地拉由广东省农科院甘蔗研究室提供,种植于福建省亚热带植物研究所隔离温室内,待甘蔗成熟期取蔗茎基部为供试材料用于病原菌的分离。
1.1.2 试剂 MSC培养基购于西格玛试剂公司,BSA、弗氏佐剂购于上海生工生物工程有限公司,PCR反应试剂、聚合酶、凝胶纯化试剂盒购于天根生化科技有限公司,pMD-18T载体购于宝生物工程(大连)有限公司,FeS04·7H20、FeCl3·6H20、戊二醛、硅烷化试剂购于国药集团化学试剂有限公司。
1.2 方法
1.2.1 Lxx抗原制备 切取甘蔗茎基部,进行表面清洗灭菌,放入超净台中晾干。将蔗茎切成适合大小用镊子挤汁,4 000 r/min,离心10 min后收集蔗汁,用普通滤纸进行初步过滤后再用0.45 μm细菌过滤器进行过滤。将过滤后的蔗汁100 μL涂布于含有10 μg/mL萘啶酸(Nalidixic acid)的新鲜MSC培养基[7],于28℃进行暗培养,40 d后观察并挑取菌落,进行电镜观察和PCR验证。PCR引物用Pan等[8]报道的Lxx 16S-23S r DNA内部转录间隔区(ITS)特异引物 Lxx1 :5′-CCGAAGTGAGCAGATTGACC-3′、Lxx2 :5′-ACCCTGTGTTGTTTTCAACG-3′, 产 物439 bp。PCR 反应体系 :rTaq 0.25 μL,dNTP 1 μL,10×PCR buffer(Mg2+)2 μL,正向引物 Lxx1 1 μL,反 向 引 物 Lxx2 1 μL,ddH2O 13.75 μL。PCR 扩 增程序为 95℃ 5 min;95℃ 30 s,55℃ 30s,72℃ 30 s,40个循环;72℃延伸5 min。PCR回收产物送Invitrogen公司测序,获得的序列在NCBI网站比对以确定分离的抗原是否为Lxx。
1.2.2 Lxx抗体制备 选取已鉴定的菌株,加入0.4%的甲醛灭活,加入弗氏佐剂,直接注射兔子,两周注射一次,共免疫4次,二个月后抽取血清采用Protein A-Sepharose 4B 作亲和层析介质纯化得到抗体蛋白,利用间接Elisa方法进行效价测定,计算P/N=样品OD值/对照OD值。若P/N≥2.1,即为阳性。
1.2.3 免疫磁珠的制备 根据刘伟伟报道的方法[9],利用化学共沉淀法合成硅烷化磁性Fe3O4纳米粒子,,并取10 mL于干燥的表面皿中烘干至恒重,计算固形物的含量,其平均粒径、粒径分布和表面形貌采用透射电镜(TEM)进行表征;以戊二醛为交联剂将硅烷化的磁性Fe3O4纳米粒子与Lxx多克隆抗体偶联制备免疫磁珠,取10 mg 硅烷化的Fe3O4纳米粒子溶于10 mL 0.01 mol/L PH 7.4 PBS,加入 2.5 mL 25%戊二醛,于室温下搅拌反应 6 h。PBS 洗涤3次后用磁石收集,定容至 10 mL,加入 5 μmol抗体于37℃下搅拌 3 h,PBS洗涤3次后用磁石收集于4℃保存。
1.2.4 免疫磁珠对Lxx亲合性检测 挑取Lxx单菌落接到液体培养基中培养,48 h后4000 rmp离心弃上清,用1 mL PBS重悬浮,加入40 μL抗Lxx免疫磁珠混均,37℃孵育1h,低速离心后弃上清,用PBS缓冲液清洗2次,将分离出来的捕获有Lxx的免疫磁珠进行透射电镜观察,并利用Lxx16S引物和特异性引物进行鉴定。
2 结果
2.1 Lxx培养与鉴定
28℃培养40 d后,培养皿上出现肉眼可见的无色、点状大小的菌落,中间突起,边缘整齐,直径约为0.2 mm(图1)。挑取菌落在电镜下观察,此菌为杆状细菌,表面光滑,无鞭毛,大小为(0.25-0.5)μm×(1-10)μm,菌体为细长形,呈直线或微弯的状态,有部分一端膨大,有的菌体中间有隔膜存在(图2)。随机挑取培养皿上6个菌落进行 PCR检测,待测菌落均能扩增出与正对照一致的目的条带(图3),对目的条带进行胶回收转入大肠杆菌中表达,经测序获得目的片段大小为438 bp,与NCBI数据库澳大利亚分离的RSD致病菌基因组相应区段序列同源性为100%,进化树分析显示其与Leifsonia xyli subsp. Xyli str. CTCB07(AE016822)关系最近,表明所分离到的即为甘蔗RSD病原菌Lxx。
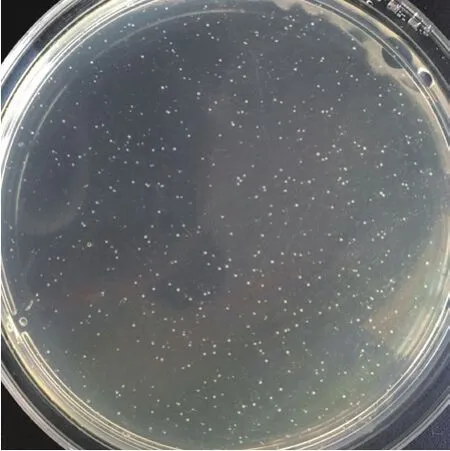
图1 病原菌Lxx纯培养
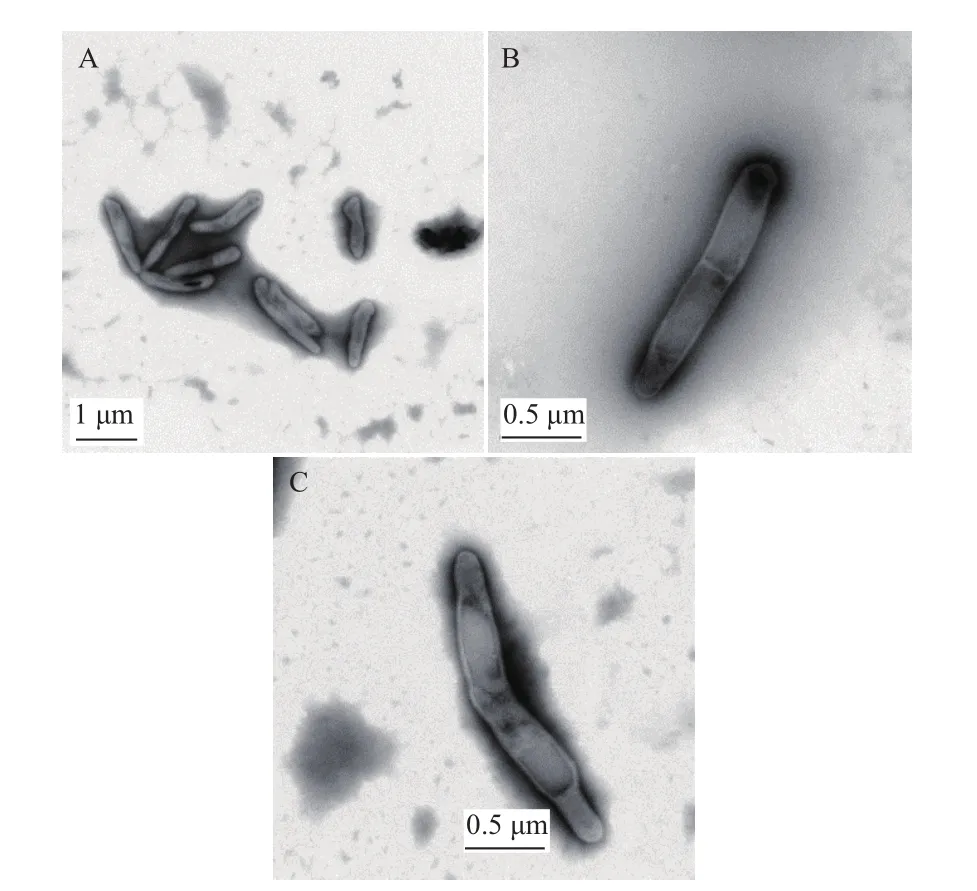
图2 透射电镜下Lxx病原菌的形态观察
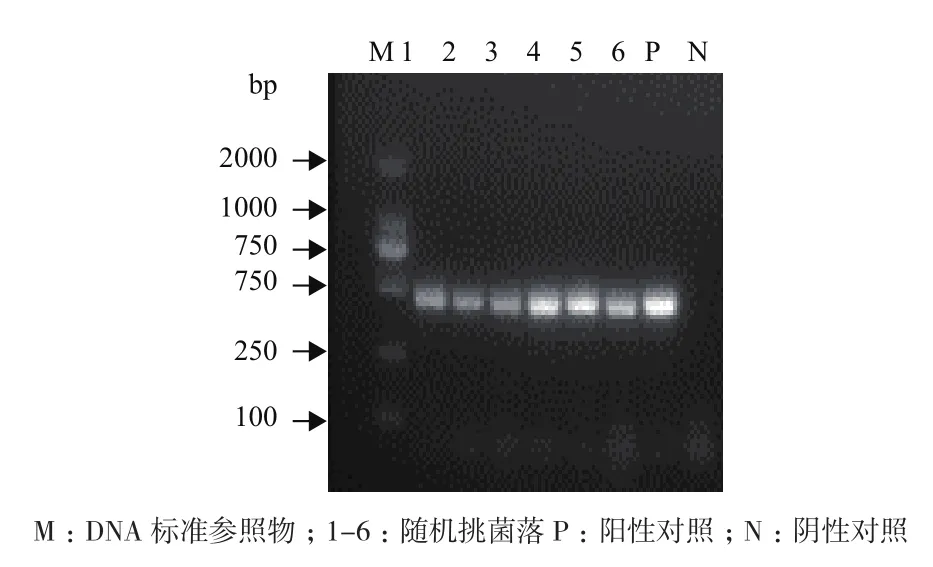
图3 菌落PCR鉴定
2.2 Lxx多克隆抗体的效价分析
利用分离的RSD病原菌Lxx免疫兔子获得了较好的多克隆抗体(表1)。抗体稀释到204 800倍时还有明显的阳性反应,而阴性值无明显阶梯,结果表明免疫获得的Lxx抗血清效价达大于204 800。
2.3 免疫磁珠合成与检测
取10 mL合成的磁性Fe304悬浮液于干燥的表面皿中烘干至恒重,烘干后的质量为0.095 g,磁珠的浓度为9.5 mg/mL。通过TEM观察Fe304磁性粒子,结果表明纳米级Fe304磁性微粒的平均粒径在125-268 nm之间(图4-A),球体表面均匀,有较好的形貌,分散性良好。免疫磁珠电镜观察结果与磁性Fe304粒子一致,无杂质粘连,也无贴壁现象(图4-B)。硅烷化后的磁性Fe304粒子与Lxx抗体偶联,从透射电镜图片中看其形貌未有变化。
2.4 免疫磁珠对Lxx的亲合性分析
从图5透射电镜照片中可以看出,免疫磁珠吸附在Lxx菌体表面,菌越密集,相应的吸附在菌体表面的免疫磁珠也越多;低速离心后对沉淀进行的Lxx 特异性PCR检测,结果(图6)表明利用免疫磁珠技术获得的Lxx分离物可用于进一步的PCR研究。
3 讨论
RSD已在各甘蔗种植国普遍发生且危害严重,是导致甘蔗减产、宿根年限缩短及严重威胁蔗糖产业稳定可持续发展的一种重要病害,起初看似是一个在单一区域、单一品种上的困扰变成了一个世界范围甘蔗产业的一个严重问题,且已经影响了甘蔗产业至少70年。RSD的致病菌的体外培养非常困难,尽管在1944年就发现,但是一直到1980年Davis[3]才成功分离培养。我国有关RSD病原菌分离培养的报道较少,2008年陈健文等[10]利用改良的SC培养基,从甘蔗蔗汁中分离培养到一种杆状细菌,根据菌落的形态特征,并结合血清学和PCR检测方法,确认所分离到的菌是甘蔗宿根矮化病的致病菌Lxx;2015年张小秋等[11]利用改良的MSC培养基成功分离Lxx,同年王丽[7]也成功分离了RSD病原菌;但目前仍然还有很多实验室没有办法重复分离 Lxx,主要原因是该菌生长特别缓慢,往往需要4周左右的时间才能在培养皿上观察到菌落,由于培养时间长,一旦有杂菌产生,分离就失败,所以控制污染是Lxx菌分离培养的关键环节。在本实验过程中,所有操作均在无菌超净台中进行,分离过程中使用的工具和试剂均高压灭菌处理,同时MSC培养基中还添加杀菌剂萘啶酸,抑制了部分杂菌的生成,一定程度上提高了Lxx分离培养的成功率,但相对于其它细菌的培养来说,这种分离培养的可重复性较差。免疫磁珠是近年来发展起来的一项新的免疫学技术,它将固化试剂特有的优点与免疫学反应的高度特异性结合于一体,以免疫学为基础,渗透到病理、生理、药理、微生物、生化以及分子遗传学等各个领域,其在免疫检测、细胞分离、生物大分子纯化等方面得到了越来越广泛的应用,在细菌分离上也有很大的应用前景[12-14]。在细菌分离上,与传统的方法相比,具有分离速度快、效率高、可重复性好、操作简单、不需要昂贵的仪器设备等优点。张蓉蓉等[15]利用免疫磁珠技术分离猪胸膜肺炎放线杆菌,发现可以显著提高此病原菌的分离效率;丁浩[16]在利用免疫磁珠富集法对牛源大肠杆菌O157:H7分离鉴定的研究中发现免疫磁珠吸附技术和普通方法相比虽然在统计学上差异不显著,但确实能够增加大肠杆菌 O157:H7的分离数量;Islam等[17]利用免疫磁珠分离技术与PCR法相结合检测志贺菌,比传统的培养法快7 h。本研究中,利用项目研发的Lxx多克隆抗体制备的免疫磁珠对Lxx亲合性强,透射电镜观察免疫磁珠吸附Lxx菌体的表面,并在重力作用下免疫磁珠-Lxx混合物从培养基中分离出来可进一步用于PCR检测,这为为直接从甘蔗汁液中获得大量纯的Lxx用于转录组或与寄主的互作研究提供了可能;利用免疫磁珠技术从甘蔗汁液中分离获得Lxx用于病原菌的培养是否可以减少菌培养过程中的污染,提高培养成功率还有待进一步的试验。另外,项目实施过程中发现该菌存在退化现象,本实验通过优化培养基PH值和培养温度都不能改善其退化现象,推测目前的分离培养基还不是最适的配方,今后应对Lxx的培养基配方进行优化。
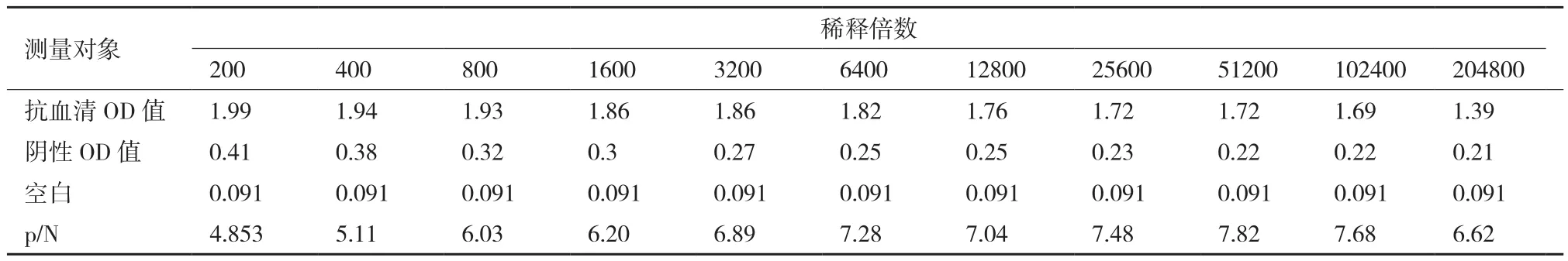
表1 Lxx多克隆抗体的效价测定结果
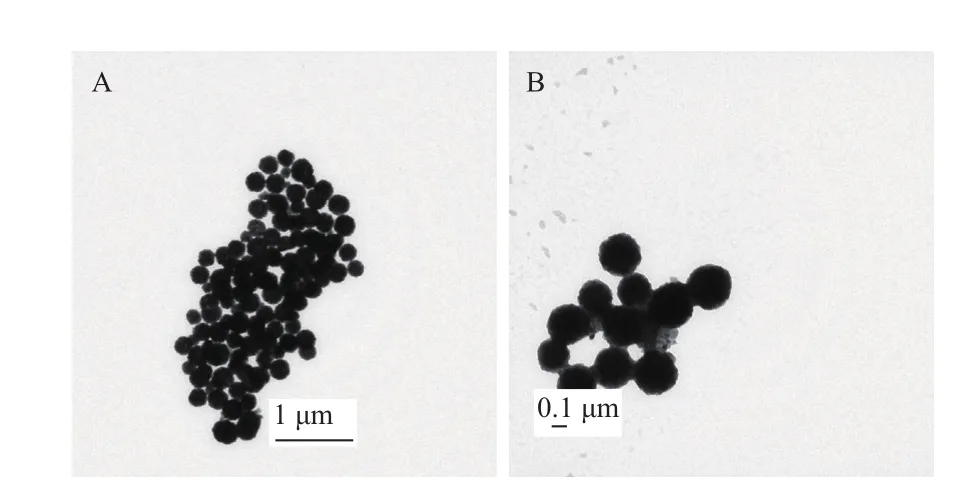
图4 纳米级Fe304磁性微粒和免疫磁珠的透射电镜图片
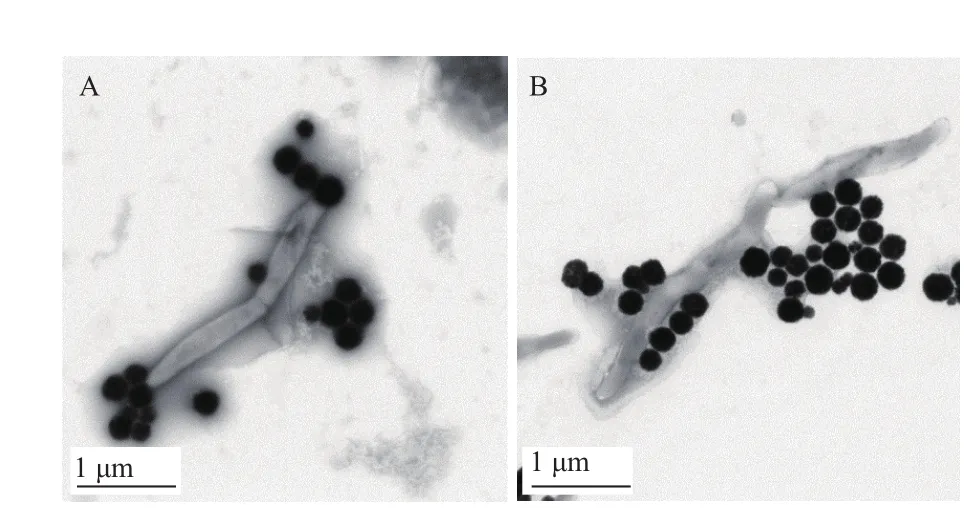
图5 透射电镜下免疫磁珠对Lxx的亲合性分析
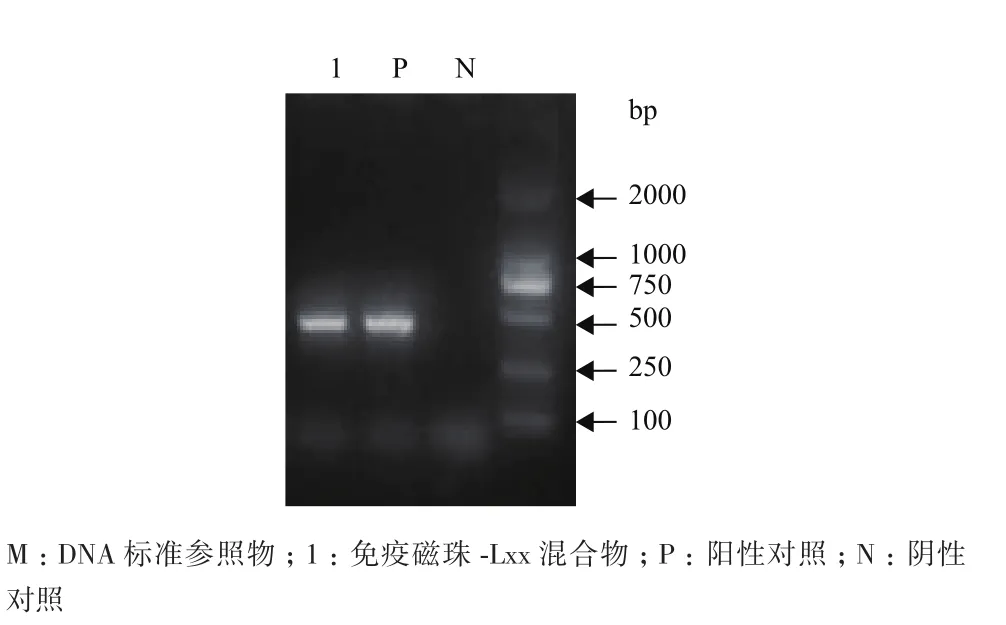
图6 免疫磁珠与Lxx菌液免疫反应的分离物PCR检测结果
4 结论
通过从感病蔗汁中分离培养的RSD致病菌,免疫获得了效价较高的Lxx多克隆抗体,制备的免疫磁珠对Lxx亲和性强,能够快速实现Lxx的分离,实验证明可进一步用于PCR检测,为Lxx与甘蔗互作时期下甘蔗感病性检测和病原菌的富集提供了便捷高效的技术手段。
[1]G. 休兹, E. V. 阿伯特, C. A. 韦斯默, 等. 世界甘蔗病害(第二卷)[M]. 北京:农业出版社, 1982.
[2]Bailey R, Bechet G. Further evidence of the effects of ratoon stunting disease on production under irrigated and rained condition[J].Pro S African Sugar Tech, 1997, 71(6):97-101.
[3]Davis MJ, Gillaspie AG, Harris RW, et al. Ratoon stunting disease of sugarcane:Isolation of the causal bacterium[J]. Science, 1980,210(4476):1365-1367.
[4]James G. A review of ratoon stunting disease[J]. Sugar Cane, ,1997, 1174(4):532-541.
[5]Davis MJ, Gillaspie AGJ, Vidaver AK, et al. Clavibacter:a new genus containing some phytopathogenic coryneform bacteria,including Clavibacter xyli subsp. xyli sp. nov. subsp. nov. and Clavibacter xyli subsp. cynodontis subsp. nov. pathogens that cause ratoon stunting disease of sugarcane and bermudagrass stunting disease[J]. International Journal of Systematic Bacteriology,1984, 34(2):107-117.
[6]Rao GP, Singh M, Singh HN . Alternative hosts of sugarcane diseases[J]. Sugar Cane, 1990, 2(2):77-81.
[7]王丽, 张剑亮, 王继华, 等. 甘蔗品种RSD感病性检测及RSD病原菌分离培养[J]. 广东农业科学, 2015, 42(9):62-66.
[8]Pan YB, Grisham MP, Burner DM. A polymerase chainreaction protocol for the detection of Clavibacter xyli subsp. xyli, the causal bacterium of sugarcane ratoon stunting disease[J]. Plant Disease,1998, 82(3):285-290.
[9]刘伟伟, 孙秀兰, 张银志, 等. 超顺磁性免疫磁珠体系用于植物油中黄曲霉毒素B1的检测研究[J]. 分析测试学报, 2011, 30(12):1345-1350.
[10]陈健文, 刘睿, 沈万宽, 等. 广东甘蔗宿根矮化病菌的分离培养及鉴定[J]. 广东农业科学, 2008, (8):68-70.
[11]张小秋, 梁永检, 唐云仙, 等. 甘蔗宿根矮化病菌形态特征及其对甘蔗光合作用的影响[J]. 华中农业大学学报, 2015, 34(5):42-47.
[12]杜英, 阮丽荣, 杨波, 等. 免疫磁珠法分离和纯化人胚胎神经干细胞[J]. 郑州大学学报:医学版, 2003, 38(1):13-15.
[13]高涛, 张克俭, 张丽萍, 等. 免疫磁珠富集--实时荧光检测生畜肉中大肠埃希菌:的实验研究[J]. 医学动物防制, 2016,32(11):1184-1186.
[14]杨金玲, 黄大亮, 李莉, 等. 玉米细菌性枯萎病菌纳米磁标记免疫层析检测试剂与试纸条[J]. 化学试剂, 2015, 37(6):519-523.
[15]张蓉蓉, 梁望旺, 方兵兵, 等. 免疫磁珠技术分离猪胸膜肺炎放线杆菌[J]. 畜牧兽医学报, 2008, 39(3):343. 348.
[16]丁浩, 苏战强, 夏利宁, 等. 免疫磁珠富集法对牛源大肠杆菌O157:H7 分离鉴定的影响[J]. 中国畜牧兽医 , 2017, 44(4):1189-1194.
[17]Islam D, Tzipori S, Islam M. Rapid detection of Shigella dysenteriae and Shigella tiexneff in faeces by an immunomagnetic assay with monoclonal antibodies[J]. Eur J Clin Microbiol Infect Dis, 1993,12(1):25-32.

