多氯联苯降解菌的筛选、鉴定及其降解特性研究
孙桂婷 陈红云 赵玲超 胡晓珂 陈营
(1. 烟台大学生命科学学院,烟台 264000;2. 中国科学院烟台海岸带研究所,烟台 264000;3. 中国农业大学烟台校区,烟台 264000)
多氯联苯(Polychlorinated biphenyls,PCBs)是国际上广受关注的12种持久性有机污染物之一,因具有耐酸碱性、耐热性、电绝缘性等特点,曾作为阻燃剂、热载体、绝缘油等被广泛应用于生产生活中[1]。据估计,全球多氯联苯总产量约 1.3×106t[2],而我国多氯联苯总产量约 1.0×104t[3]。PCBs的难降解性、生物富集性、高毒性等环境特性使其易在环境和生物体内富集,对环境和人类的健康产生危害[4-5],对PCBs的降解是当前亟待解决的环境问题。人类在河海交汇处活动频繁,近年来,许多学者对我国河流入海口和近海水域PCBs污染状况的研究中均表明,调查中所涉及的近海海域水体都受到不同程度的PCBs污染[6-9],王泰等[10]指出渤海湾已经受到PCBs的污染。
在我们所了解的范围内,已报道的PCBs降解菌株大多都是从陆地土壤环境筛选得到的,未发现从河海交汇处筛选得到的降解菌株。主要的好氧降解菌如伯克霍尔德氏菌(Burkholderia xenovorans)LB400、真养产碱杆菌(Alcaligenes eutrophus)H850、红球菌(Rhodococcus sp.)RHA1、产碱杆菌(Alcaligenes sp.)JB1等可以有氧降解五氯及五氯以上PCBs,底物谱范围宽广,但绝大多数的菌株仅局限于降解低氯取代PCBs,且底物谱范围较窄[11]。在联苯降解途径中,主要的降解产物是氯代苯甲酸,大部分降解菌不能继续利用氯代苯甲酸,只能依靠存在于被污染土壤中的其他好氧菌通过不同的途径降解[1]。但少数菌株如木糖氧化无色杆菌(Achromobacter xylosoxidans)IR08、 红 球 菌(Rhodococcus sp.)RHA1等可以继续利用氯代苯甲酸为碳源生存,并且目前也发现某些降解菌如假单胞菌(Pseudomonas putida)PRS2000等可以利用一氯联苯为唯一碳源和能源,并能将一氯联将其完全矿化[12-14]。因此,本实验从河海交汇处筛选多氯联苯降解菌,研究其降解特性和底物谱宽度,以期为生物修复PCBs污染土壤提供一定的理论依据。
1 材料与方法
1.1 材料
样品采集 采样地点为山东烟台逛荡河入海口处(N:37.47°,E:121.47°),采集河海交汇处表层 0-15 cm的土样。
1.2 方法
1.2.1 培养基的配制 富集培养基为LB液体培养基[15]或加入实验要求所需相应碳源的无机盐培养基[16]。
LB液体培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,加去离子水定容至1 000 mL,pH7.0。
LB固体培养基:LB液体培养基中加2%琼脂。
MM30 液 体 培 养 基:(1)(NH4)2SO41 g、KH2PO43 g、Na2HPO46 g、微量金属盐溶液0.5 mL、联苯200 mg/L,加去离子水定容至1 000 mL,pH 7.1。(2)Mixture 44 :Na2B4O7·10H2O 17.7 mg、CuSO4·5H2O 39.2 mg、CaCl2·6H2O 20.1 mg、ZnSO4·7H2O 1 095 mg、EDTA 250 mg, 加 去 离子水定容至 100 mL。加入 100-150 μL 浓 H2SO4,防止产生沉淀。(3)微量金属盐溶液:EDTA 0.5 g、CaCO31 g、FeSO4·7H2O 0.5 g、MgSO4·7H2O 10 g、MnSO4·H2O 10 g、Mixture 44 10 mL,加去离子水定容至100 mL。
MM30固体培养基:MM30液体培养基加2%琼脂。
以上培养基(不含联苯)均于121℃、0.1 MPa下灭菌20 min后使用。
1.2.2 降解菌的筛选 称取5 g土壤样品加入含200mg/L联苯的MM30液体培养基中,于30℃、180 r/min的摇床中培养7 d。取100 μL菌液连续梯度稀释并均匀涂布于含有200 mg/L联苯的MM30固体培养基。选取不同形态的菌株在含有PCB3的MM30液体培养基中继续纯化培养获得单一菌株,将该菌株经LB液体培养基培养后取0.75 mL加入等量30%的甘油中,-80℃冻存。
1.2.3 多氯联苯降解菌的鉴定
1.2.3.1 细胞形态观察 取对数生长期的菌液用Solarbio革兰氏染色试剂盒进行革兰氏染色,并在Leica DM5000B显微镜下观察细胞染色状态。菌液经戊二醛固定乙醇脱水和冷冻干燥后,进行电镜扫描。
1.2.3.2 菌种鉴定 MoBio试剂盒提取细菌基因组DNA,并用16S rRNA的通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行 PCR 扩增。扩增产物经琼脂糖凝胶电泳检测后委托上海英潍捷基商贸有限公司测序,测序结果与GenBank中已收录的16S rRNA序列进行同源性比对,进行细菌的种属鉴定。利用MEGA5.1软件的Neighbor-Joining算法构建进化树。
1.2.4 影响降解菌生长的不同因素分析
1.2.4.1 pH对降解菌生长的影响 取-80℃冻存的P-6-5菌株接入含15 mg/L联苯的MM30液体培养基中培养36 h。无菌条件下制备休眠细胞,收集处于对数生长期的大量细胞,7 000 r/min离心10min,弃上清,菌泥用MM30清洗两次,重悬菌液至OD600nm约为1.0。按10%接种量转接到pH分别为4、5、6、7、8、9,且含有30 mg/L联苯的MM30液体培养基中继续培养,间隔适当时间用PerkinElmer Lambda 365分光光度计测定其在600 nm处吸光度值。
1.2.4.2 盐度对降解菌生长的影响 休眠细胞制备方法同1.2.4.1,按10%接种量转接到盐度分别为0、5、20、35、50和65 g/L且含有30 mg/L联苯的MM30培养基中继续培养。测定方法同上。
1.2.4.3 不同诱导剂对降解菌生长的影响 取-80℃冻存的P-6-5菌株分别接入含有25 g/L的LB液体培养基中培养过夜,含15 mg/L联苯或5 mg/L PCB3的MM30液体培养基中培养36 h。休眠细胞制备方法同1.2.4.1,按10%接种量将经过诱导的菌液转接到含5 mg/L PCB3的MM30液体培养基中继续培养。测定方法同上。
1.2.5 菌株降解PCB3的动力学实验
1.2.5.1 菌株对相同初始浓度PCB3的降解 向MM30培养基中加入适量PCB3溶液,使其浓度为10 mg/L,以PCB208为内标。将OD600nm=1.0的重悬休眠细胞按10%接种量接入含有上述PCB3和PCB208混合物的MM30培养基中。于30℃,180 r/min摇床中培养8、16、24、36、48、72 h后,用已除水的正己烷萃取3次,将萃取液用氮气吹至500 μL后,利用气相色谱仪(GC-uECD)检测PCB3的残留量,计算得出降解菌对PCB3的降解率。
1.2.5.2 菌株对不同初始浓度PCB3的降解 取适量PCB3溶液加入MM30培养基中,使降解体系中PCB3的终浓度为10、25、50、75和100 mg/L,以PCB208为内标。接种方法、萃取方法同1.2.5.1,取样时间为48 h。同时用分光光度计测定该菌株生长量(OD600nm表示)。
1.2.6 对氯苯甲酸(4-CBA)的检测
1.2.6.1 4-CBA标准品的检测 取适量4-CBA标准品固体溶于丙酮中,使其终浓度为10 mg/L,N2吹干后加入 50 μL 衍生化试剂 BSTFA-TMCS 99∶1,73℃孵育30 min,转移到内衬管中GC-uECD上样检测4-CBA的含量及出峰时间。
1.2.6.2 降解产物中4-CBA的检测 用已除水的乙酸乙酯萃取反应体系,萃取方法、衍生化方法同上,转移到内衬管后GC-uECD上样检测。
1.2.7 气相色谱分析条件 多氯联苯的分析采用HP7890A气相色谱仪,检测器为uECD。色谱 柱 为 SPB-5(30 m×0.2 mm×0.2 μm)(Sigma-Aldrich Biotechnology LP)。载气为高纯氮气。进样口温度为250℃,进样体积为1 μL,无分流进样。柱箱升温程序如下:初始温度为100℃,保持2 min,以15℃/min升至200℃后,以10℃/min升至300℃[17]。具体实验操作参照Barriault等的实验规范[18]。
1.2.8 菌株对mix13的降解 将mix13溶于丙酮,每种多氯联苯的终浓度见表1。取OD600nm=1.0的休眠细胞按5%接种量接入含有mix13的MM30培养基中。30℃,180 r/min的摇床中培养48 h后测定降解率。萃取方法和气相色谱仪(GC-uECD)检测方法同1.2.5.1和1.2.7。

表1 mix13各组分及终浓度
2 结果
2.1 多氯联苯降解菌的筛选与鉴定
从含联苯的土样中筛选得到一株多氯联苯降解菌P-6-5,在含联苯的MM30 固体平板上,降解菌的菌落较小呈圆形,微黄色,半透明,边缘整齐,表面光滑。电镜扫描菌株形态如下图1-A,革兰氏染色结果显示如图1-B。16S rRNA测序结果经过比对后发现与多种假单胞菌有着高度相似性,菌株P-6-5的系统发育树如下图2,可以判断菌株P-6-5属于假单胞菌属(Pseudomonas sp.)。

图1 降解菌P-6-5的电镜扫描图(×100k)(A)和革兰氏染色图(B)
2.2 pH、盐度对降解菌生长的影响
pH和盐度对降解菌生长的影响作用明显,如图3,降解菌在pH6-8范围内都可以生存,在过酸或过碱环境中生长受到抑制。同样,在一定范围内,盐度的增加促进微生物的生长,在pH7,盐度35时是降解菌的最佳生长条件。
2.3 诱导剂对降解菌生长的影响
菌株经诱导和培养后转接到以PCB3为唯一碳源的MM30培养基中的生长情况如图4所示,诱导剂不同,微生物生长情况不同。经过LB培养后转接到以PCB3为唯一碳源的MM30培养基中的生物量逐渐降低,与之相比,经过BPH和PCB3诱导的降解菌在转接到PCB3后都可以继续维持菌株的生长,表现出了明显的生长优势。在生长后期,由于碳源的消耗不足以维持大量细胞的生长,降解菌的生长进入衰亡期,微生物的生物量逐渐下降。
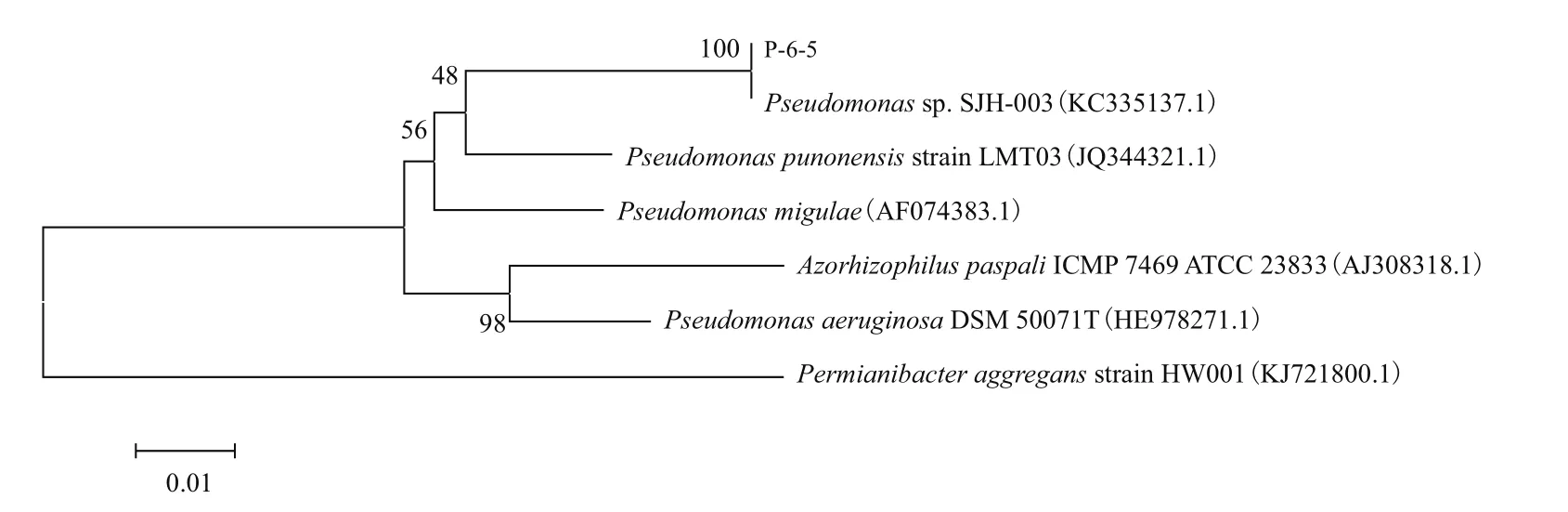
图2 邻接法构建菌株P-6-5的系统发育树
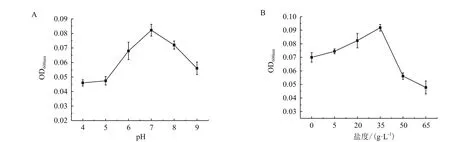
图3 菌株P-6-5在不同pH和不同盐度中的生长情况
2.4 菌株降解PCB3的动力学实验
2.4.1 降解菌对PCB3的降解 降解菌对PCB3的降解量及残留率随时间变化曲线如图5所示,PCB3的降解量随时间的增加而增加,残留率随时间的增加而减小,且降解量曲线在降解初期增加较快,48 h后增加幅度趋缓,72 h基本到达降解菌的最大降解率(95.3%)。
2.4.2 PCB3的不同初始浓度对降解的影响 从图6中可以看出,P-6-5对不同浓度PCB3的降解能力不同,随着浓度的增加,PCB3的残留率升高,与之对应的降解菌的吸光度值逐渐下降。在底物浓度为10 mg/L时,底物的残留率仅为9.4%,此时具有最大吸光度值和最大降解速率1.9 mg/(L·h)。如图7,底物浓度的增加可以促进降解菌对底物的降解能力,而继续增加底物浓度,PCB3的降解量逐渐下降,降解菌的生长能力降低。
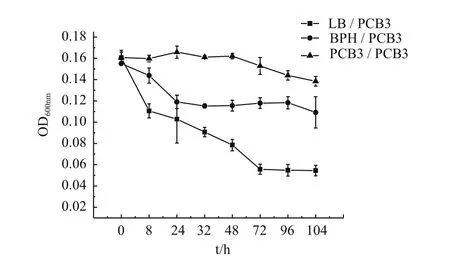
图4 不同诱导剂对降解菌生长情况的影响

图5 菌株P-6-5的残留率曲线和降解量曲线

图6 PCB3初始浓度对降解的影响
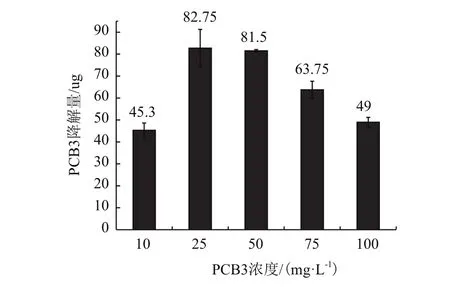
图7 菌株P-6-5对不同初始浓度PCB3的降解量
2.5 降解产物的检测与分析
如图8、9,PCB3及4-CBA标准品的出峰时间分别为10.90 min和8.85 min,实验组的出峰时间如图10,很明显的出现许多杂峰,并且含有PCB3和4-CBA的出峰时间。
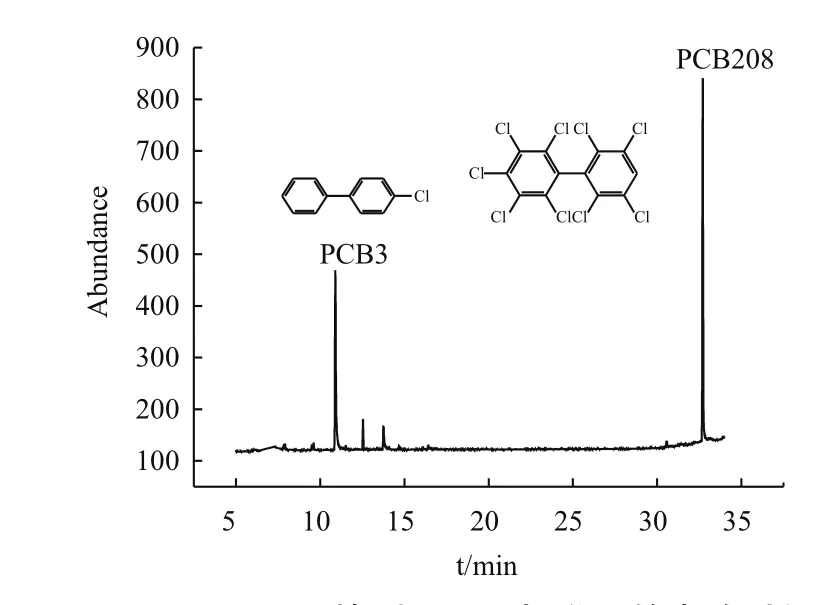
图8 GC-uECD检测PCB3标准品的出峰时间
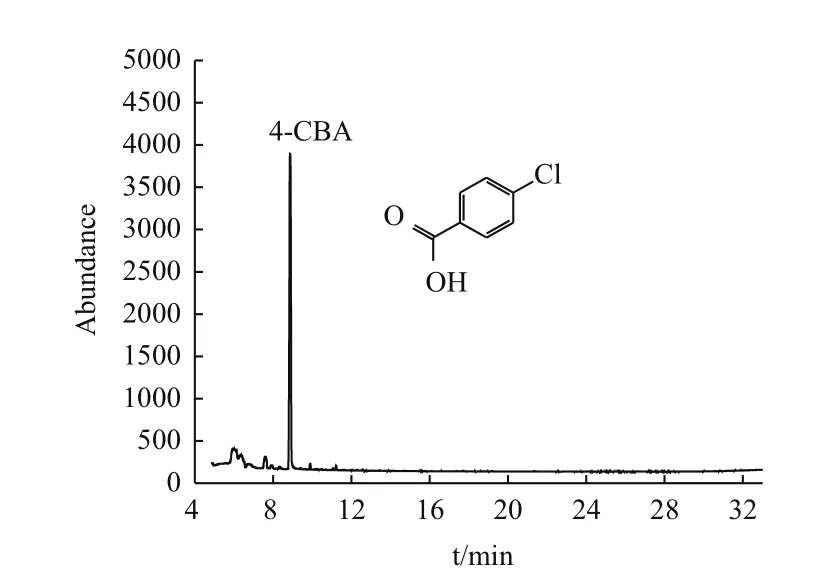
图9 衍生化4-CBA标准品经GC-uECD检测的出峰时间
2.6 降解菌对mix13的降解
如表2所示,P-6-5对二氯、三氯、四氯联苯都存在降解,总体遵循氯取代数量增多,降解率降低的规律。菌株P-6-5的底物适应范围可以涵盖至四氯联苯,底物谱范围较宽。
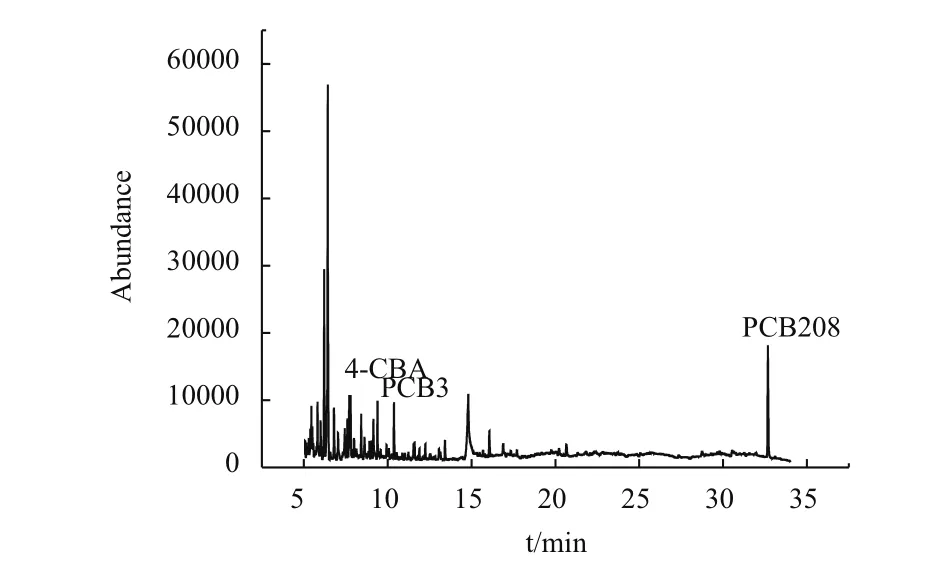
图10 PCB3代谢产物经TMS衍生化后的GC-uECD检测总离子色谱图

表2 菌株P-6-5对mix13的降解率
3 讨论
每种微生物的生长都有其最适pH和盐度,pH和盐度的改变会影响酶的活性,进而影响微生物对营养物质的利用,过酸或过碱会造成蛋白变性,细胞膜损坏,进而导致细胞死亡,影响微生物的生长速率[19-20]。结合菌株从河海交汇处筛选得到,海水的平均盐度为35,pH值范围7.86-8.30[21],而在pH7-8,盐度35时,降解菌P-6-5生长状况良好,可以判断P-6-5具备海水菌的特点,这也为海洋PCBs污染修复提供良好开端。
联苯和多氯联苯被认为是有助于PCBs生物降解的诱导剂,以BPH和PCB3为碳源的诱导对多氯联苯降解菌的生长具有明显的促进作用。低浓度时底物的生物毒性效应不明显,底物降解率低,而随着底物浓度的增加可以提高底物被微生物利用的几率,降解相关的酶与底物结合能力增强,酶促反应效率提高,底物降解量提高。而浓度的提高对降解菌生物代谢能力的促进作用有限,浓度过高反而会因高浓度底物的毒害作用抑制降解菌的生长以及酶与底物结合能力[22],影响降解菌对底物的转化。但菌株P-6-5在高浓度的底物环境中(75 mg/L、100 mg/L),仍具有17%、9.8%的降解率和63.75 μg、49 μg的降解量,说明P-6-5能够适应高浓度PCB3的毒性环境,具有降解高浓度PCBs的潜能。
产物的鉴定是推测代谢途径的重要证据,联苯降解途径是微生物参与PCBs降解的主要途径,其主要代谢产物为氯代苯甲酸和4-羟基戊酸[23-24],大多PCBs降解菌不能继续矿化氯代苯甲酸,需要其他可降解氯代苯甲酸的好氧菌协同作用才能实现完全矿化[25]。对菌株P-6-5的降解产物分析发现,实验组不仅出现4-CBA的出峰时间,还有许多杂峰,说明PCB3的降解产物中有4-CBA,更可能是降解菌可以利用4-CBA为碳源生存,产物中出现4-CBA的代谢产物,这为降解菌能够完全矿化PCB3提供有力证据,也推测了菌株P-6-5的降解途径可能不同于联苯降解途径。
Hickey、Nováková和 Tandlich 等[26-28]研 究 者认为假单胞菌是最有效的多氯联苯降解菌,多项研究表明,有氧条件下,低氯取代同系物较高氯取代同系物更易发生降解[29-31]。根据氯取代位置的不同,具有对称结构的多氯联苯降解反应活性低于非对称结构多氯联苯,不同位置氯取代PCBs降解反应活性大小顺序为:邻位>间位>对位[32]。在本实验中,菌株P-6-5的降解并不完全符合上述降解规律,对于最难降解的对位多氯联苯降解率更高,降解更倾向于对位脱氯,可能存在不同的降解途径。降解菌对毒性较大的对称型共平面多氯联苯,如 2,2’,4,4’-四氯联苯,2,2’,5,5′-四氯联苯,2,2’,6,6’-四氯联苯都存在降解,说明 P-6-5能适应毒性较高的多氯联苯环境,对邻、间、对位多氯联苯均有降解,具有一定降解潜能和研究前景。与其他大部分有氧降解菌类似,对于五氯以上高氯联苯,P-6-5需要厌氧脱氯和好氧降解共同作用。
4 结论
从河海交汇处土样中筛选得到一株多氯联苯降解菌P-6-5,16S rRNA鉴定为假单胞菌属(Pseudomonas sp.),其最适生长条件为pH7,盐度35。降解菌对10-100 mg/L底物具有转化能力,10 mg/L时具有最大降解速率(1.9 mg/(L·h))和最大降解率(95.3%)。对于毒性较大的 2,2’,4,4’-四氯联苯,2,2’,5,5’-四氯联苯,2,2’,6,6’-四氯联苯等对称型共平面PCBs表现出明显的降解效果。结合产物分析,推测降解菌P-6-5可能存在不同的降解途径,对环境中PCBs的生物修复具有重要意义。
[1]Pieper DH. Aerobic degradation of polychlorinated biphenyls[J].Applied Microbiology and Biotechnology, 2005, 67(2):170-191.
[2]Breivik K, Sweetmanb A, Pacyna JM, et al. Towards a global historical emission inventory for selected PCB congeners-a mass balance approach:1. Global production and consumption[J].Science of The Total Environment, 2002, 290(1):181-198.
[3]Shimura M, Mukerjee-Dhar G, Kimbara K, et al. Isolation and characterization of a thermophilic Bacillus sp. JF8 capable of degrading polychlorinated biphenyls and naphthalene[J]. FEMS Microbiology Letters, 1999, 178(1):87-93.
[4]Arulazhagan P, Vasudevan N. Biodegradation of polycyclic aromatic hydrocarbons by a halotolerant bacterial strain Ochrobactrum sp.VA1[J]. Marine Pollution Bulletin, 2011, 62(2):388-394.
[5]Feng T, Cui C, Dong F, et al. Phenanthrene biodegradation by halophilic Martelella sp. AD-3[J]. Journal of Applied Microbiology, 2012, 113(4):779-789.
[6]闫景明, 吴水平, 王新红, 等. 福建近岸表层海水中阴离子表面活性剂和PCB的污染[J]. 海洋环境科学, 2009, 28(6):626-629.
[7]王晓峰, 楼晓明, 韩关根, 等. 浙江省电子垃圾拆解地区环境中多氯联苯污染特征研究[J]. 卫生研究, 2011, 40(5):583-586.
[8]李昆, 赵高峰, 周怀东, 等. 长江中游干流及22条支流表层水中多氯联苯的分布特征及其潜在风险[J]. 环境科学, 2012,33(5):1676-1681.
[9]周霞, 余刚, 张祖麟, 等. 北京通惠河水和表层沉积物中氯苯类有机物污染现状[J]. 环境科学, 2005, 26(2):117-120.
[10]王泰, 张祖麟, 黄俊, 等. 海河与渤海湾水体中溶解态多氯联苯和有机氯农药污染状况调查[J]. 环境科学, 2007, 28(4):730-735.
[11]Pieper DH, Seeger M. Bacterial Metabolism of Polychlorinated Biphenyls[J]. Journal of Molecular Microbiology and Biotechnology, 2008(2-3), 15:121-138.
[12]Borja J, Taleon DM, Auresenia J, et al. Polychlorinated Biphenyls and Their Biodegradation[J], Process Biochemistry, 2005, 40(6):1999-2013.
[13]Chavez FP, Gordillo F, Jerez CA. Adaptive Responses and Cellular Behavior of Biphenyl-Degrading Bacteria Toward Polychlorinated Biphenyls[J], Biotechnology Advances, 2006, 24(3):309-320.
[14]Zanaroli G, Perez-Jimenez JR, Young LY, et al. Microbial reductive dechlorination of weathered and exogenous Co-planar polychlorinated biphenyls(PCBs)in an anaerobic sediment of venice lagoon[J], Biodegradation, 2006, 17(2):121-129.
[15]Sambrook J, Fritsch EF, Maniatis T. Molecular cloning:A laboratory manual. [M]. 2nd ed. New York:Cold Spring Laboratory Press, 1989.
[16]Sylveatre M, Fauteux J. A new facultative anaerobe capable of growth on chlorobiphenyls[J]. The Journal of General and Applied Microbiology, 1982, 28(1):61-72.
[17]Toussaint JP, Pham TTM, Barriault D, et al. Plant exudates promote PCB degradation by a rhodococcal rhizobacteria[J]. Applied Microbiology and Biotechnology, 2012, 95(6):1589-1603.
[18]Barriault D, Lépine F, Mohammadi M, et al. Revisiting the regiospecificity of Burkholderia xenovorans LB400 biphenyl dioxygenase toward 2, 2′-dichlorobiphenyl and 2, 3, 2′,3′-tetrachlorobiphenyl[J]. Journal of Biological Chemistry,2004, 279(46):47489-47496.
[19]梁峙. 四氯化碳的高效降解菌种筛选及其降解规律研究[D].徐州:中国矿业大学, 2009.
[20]熊士昌, 尹华, 何宝燕, 等. 白腐菌对十溴联苯醚的酶促降解研究[J]. 环境化学 , 2012, 31(5):615-619.
[21]石强, 杨东方. 渤海夏季海水pH值年际时空变化[J]. 中国环境科学, 2011, 31(suppl.):58-68.
[22]Cao YM, Xu L, Jia LY. Analysis of PCBs degradation abilities of biphenyl dioxygenase derived from Enterobacter sp. LY402 by molecular simulation[J]. New Biotechnology, 2011, 29(1):90-98.
[23]Vasilyeva GK, Strijakova ER. Bioremediation of soils and sediments contaminated by polychlorinated biphenyls[J]. Microbiology,2007, 76(6):639-653.
[24]Kikuchi Y, Yasukochi Y, Nagata Y, et al. Nucleotide sequence and functional analysis of the meta-cleavage pathway involved in biphenyl and polychlorinated biphenyl degradation in Pseudomonas sp. strain KKS102[J]. Journal of Bacteriology. 1994, 176(14):4269-4276.
[25]贾凌云. 多氯联苯降解菌的筛选及其降解性能研究[D]. 大连:大连理工大学, 2008.
[26]Hickey WJ, Brenner V, Focht DD. Mineralization of 2-chloro-and 2,5-dichlorobiphenyl by Pseudomonas sp. strain UCR2[J]. FEMS Microbioogy Letters, 1992, 98(1):175-180.
[27]Nováková H, Vosahlíková M, Pazlarová J, et al. PCBs metabolism by Pseudomonas sp. P2[J]. International Biodeterioration &Biodegradation, 2002, 50(1):47-54.
[28]Tandlich R, Vrana B, Payne S, et al. Biodegradation mech-anism of biphenyl by a strain of Pseudomonas stutzeri[J]. Journal of Environmental Science and Health, 2011, 46(4):1-8.
[29]Field JA, Sierra-Alvarez R. Microbial transformation and degradation of polychlorinated biphenyls[J]. Environment Pollution, 2008, 155(1):1-12.
[30]Luo W, Dángelo EM, Coyne MS. Plant secondary metabolites,biphenyl, and hydroxypropyl-b-cyclodextrin effects on aerobic polychlorinated biphenyl removal and microbial community structure in soil[J]. Soil Biology and Biochemistry, 2007, 39(3):735-743.
[31]Potrawfke T, Timmis KN, Wittich RM. Degradation of 1, 2, 3,4-tetra-chlo-robenzene by Pseudomonas chlororaphis RW71[J].Applied and Environmental Microbiology. 1998, 64(10):3798-3806.
[32]蔡啸宇. 多氯联苯的光/光敏化降解机理研究[D]. 北京:华北电力大学, 2016.

