石斛属植物茎部总RNA提取方法的研究
单婷婷 陈晓梅 郭顺星 王倩清 王爱荣
(1. 中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2. 鲁东大学农学院,烟台264025)
全世界约有兰科石斛属(Dendrobium)植物1 500多种[1],我国有74种2变种,其中51种可作药用[2]。我国2015版药典规定,中药铁皮石斛的来源植物为铁皮石斛(D. officinale Kimura et Migor),中药石斛的来源植物包括金钗石斛(D. nobile Lindl)等多种同属近似种[3],药材的药用部位均为植物的新鲜或干燥茎[4]。石斛属植物茎多糖含量普遍较高,其中铁皮石斛茎多糖被认为是药材的主要有效成分。
高质量RNA是开展cDNA文库构建、荧光定量PCR检测、Northern杂交等分子生物学研究的必要前提[5]。对于富含多糖的植物组织,传统的RNA提取方法是经过SDS-盐酸胍处理去除多糖,或是在高浓度Na+或K+存在条件下,利用苯酚、氯仿抽提去除多糖,最后都通过LiCl沉淀RNA[6]。传统方法存在多糖去除不完全[7],LiCl沉淀导致RNA丢失,提取效率低,耗时长等缺点[8]。目前多用试剂盒方法提取RNA。试剂盒法主要是利用异硫氰酸胍去除多糖。异硫氰酸胍是强烈的蛋白质变性剂,不仅能有效解离核蛋白和核酸的复合体,还能抑制RNA酶的活性[9],且不易发生RNA丢失。与传统方法相比,试剂盒法还具有操作简单,重复性好等优点[10]。
植物的不同组织和器官,由于化学成分组成的差异,导致提取RNA的方法有很大差别[11]。根据文献报道,铁皮石斛茎中次生代谢关键酶基因表达量最高[12-14],但是铁皮石斛RNA提取方法研究中使用的材料多为叶片,鲜有关于茎RNA提取方法的报道[15-18]。目前铁皮石斛依赖人工栽培生产药材,采收生长2-3年的茎入药,这个阶段多糖含量最高,通常可达20%-30%[19];叶和根的多糖含量分别为10%-14%和8%-10%[20]。鉴于此,本研究以多糖含量高的2年生铁皮石斛茎为实验材料,研究建立总RNA提取的试剂盒方法,以期为石斛属植物茎的分子生物学研究奠定基础,并为其他富含多糖的植物器官的RNA提取提供借鉴。
1 材料与方法
1.1 材料
用于方法学研究的铁皮石斛样品,采自江苏省泰州市江苏益草堂石斛股份有限公司(以下称为益草堂公司),为该公司生产的组培苗移栽种植大棚后生长两年的茎杆。干燥茎多糖含量29.5%。每种RNA提取方法采集3份样品,作为生物学重复。
铁皮石斛样品均来自益草堂公司生产的组培苗,生长条件和生长时间分别是:中国科学医学院药用植物研究所温室种植1年(W),益草堂公司种植大棚生长3个月(S)、1年(Y)和2年(L)。金钗石斛(J)、鼓槌石斛(D. chrysotoxum Lindl,G)、球花石斛(D. thyrsiflorum Rchb. f.,Q)和重唇石斛(D.hercoglossum Rchb. f.,C)均在药用植物研究所温室生长两年以上。W与Y用于比较不同生长条件的铁皮石斛,S、Y和L用于比较不同生长时间的铁皮石斛,L、J、G、Q和C用于比较不同种石斛属植物。以上每个样品采集3份,作为生物学重复。
以上植物均经过中国医学科学院药用植物研究所郭顺星研究员鉴定。将新鲜石斛茎切段,迅速放入液氮中速冻,后置于-80℃保存,备用。
1.2 方法
1.2.1 RNA提取方法 研究共采用了7种RNA提取方法:TRIZOL法 +去多 糖辅助剂(M1)[17]、QIAGEN试剂盒法(M2)[21]、百泰克通用试剂盒法(M3)[17]、百泰克多糖多酚试剂盒法(M4)[22]、艾德莱多糖多酚试剂盒法(M5)[23]和华越洋多糖多酚试剂盒法(M6)[24]和改良华越洋多糖多酚试剂盒法(M7)。前6种方法均按照试剂盒附带的操作步骤提取RNA。M7在试剂盒操作步骤的基础上进行了2方面的改良:加大样品量;延长孵育时间。
改良华越洋多糖多酚试剂盒法(M7)提取RNA过程如下:(1)称取300 mg铁皮石斛茎段,液氮充分研磨后加入3 000 μL细胞裂解液混匀,50℃孵育10 min;(2)所得混合物的液体部分转移至离心管,加入900 μL去蛋白液和600 μL氯仿,震荡混匀,静置2 min,离心10 min;(3)上清液加入等体积漂洗液,颠倒混匀,混合物通过离心吸附柱,离心1 min,弃废液;(4)用洗柱液清洗吸附柱2次,每次清洗后离心1 min,弃废液;(5)取45 μL DNase buffer和 5 μL RNAse free DNase I混合均匀,37℃预热1 min,加入吸附柱,静置5 min;(6)用去酶液清洗吸附柱2次,每次清洗后离心1 min,弃废液;(7)吸附柱加30-80 μL RNA洗脱液,静置3-5 min,离心1 min,收集RNA溶液。以上操作均在室温下进行,离心速度均为12 000 r/min。
1.2.2 RNA质量检测 RNA浓度及纯度用NanoDropTM2000分光光度计(Thermo Fisher,USA)检测[25],1.0 μL总RNA上样,平行检测5次,记录总RNA浓度、OD260/OD280,计算平均值。RNA纯度要求:1.8≤OD260/OD280≤2.2。RNA完整性用凝胶电泳检测[26],0.5×TBE Buffer电泳缓冲液,3 μL RNA 混入 0.6 μL 6×Loading Buffer(TaKaRa)点样,1.0%琼脂糖(Biowest® Regular Agarose G-10)凝胶,200 V电泳15 min。
1.2.3 M7的方法验证 用M7方法对各样品茎RNA进行提取,并检测RNA质量。
1.2.4 统计方法 对M2-M7的RNA浓度和纯度测定值用SPSS软件进行单因素方差分析,比较不同方法提取的茎总RNA的质量差异。由于方差不齐,用Dunnett’s T3进行多重比较。
2 结果
2.1 七种方法提取RNA过程中的现象
七种提取RNA的方法,除了M1需要用异丙醇沉淀并自然干燥RNA,其他6种都是用吸附柱收集RNA的试剂盒法。选取上柱前实验过程中现象变化最明显的3个阶段进行观察,它们分别是:加入裂解液后、水浴离心后和加入氯仿后。
M2、M3和M4在加入裂解液后溶液比较黏稠(图1-A)。水浴离心后7种方法都会出现沉淀(图1-B),其中M2出现了白色絮状沉淀;M3和M4水浴离心后上清液仍较黏稠,不易吸取;氯仿的作用是将RNA与DNA和蛋白质分离,进入水相。加入氯仿后溶液分为3层:上层为含有RNA的水相;中层为DNA、蛋白质和其他杂质;下层为有机相(图1-C)。这个阶段M4上层为黏稠的白色液体,M3实验过程中没有加入氯仿,分层出现在加入70%乙醇后,上清为黏稠的透明液体。由于水浴离心后已经将M2和M5上清液转移到过滤清除柱中,因此在这个阶段M2和M5无明显分层现象。
2.2 七种方法提取的总RNA的质量检测
2.2.1 RNA完整性 图2为1.0%琼脂糖凝胶电泳图,M1、M2和M3方法没有rRNA条带,M4和M5方法rRNA条带不清晰,M6和M7方法有较整齐、清晰的28S和18S rRNA条带。
2.2.2 RNA浓度和纯度 测定结果见表1。M1总RNA浓度异常高,紫外检测有两个吸收峰,表明样品中掺杂有DNA,测定值不可靠,因此不参与统计。M2-M7数据的单因素方差分析结果表明,不同提取方法的总RNA浓度有显著性差异(P<0.05),纯度没有显著性差异(P>0.05)。经Dunnett’s T3多重比较,M7与M2和M3的总RNA浓度有显著性差异(P<0.05)。M7总RNA浓度最高,为139.13±22.02 ng/μL,浓度变异系数(C.V)最低,为15.83%,总RNA纯度最高,OD260/OD280为2.12±0.01,表明该方法稳定,重复性好,提取获得的总RNA质量符合分子生物技术要求。M7总RNA浓度较M6提高了98.6%,纯度提高了79.7%,改良效果明显。

图1 七种方法提取RNA过程中的现象
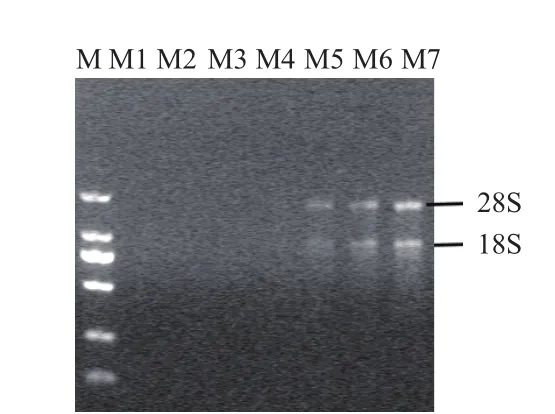
图2 七种方法提取铁皮石斛茎总RNA的电泳图
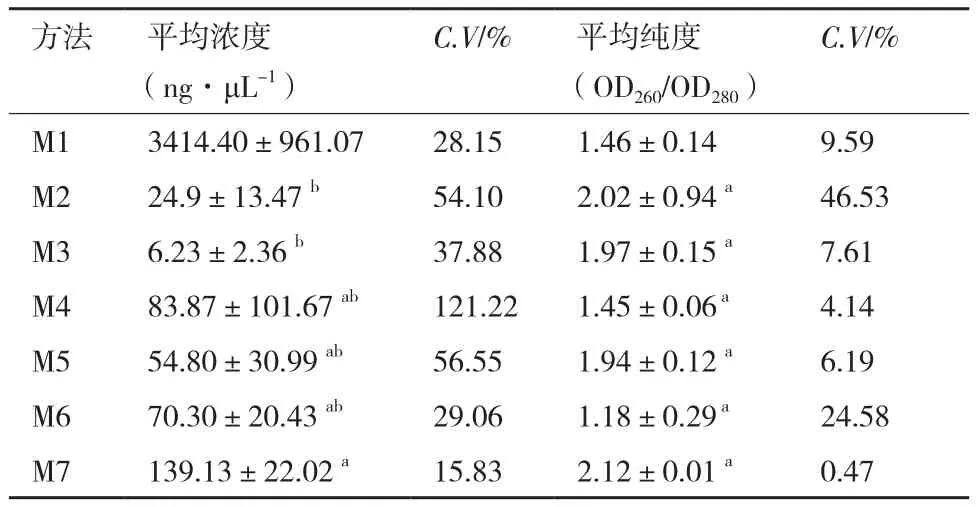
表1 七种方法提取铁皮石斛茎总RNA的浓度和纯度(n=3)
2.3 M7方法验证
2.3.1 RNA完整性 经1.0%琼脂糖凝胶电泳检测,M7提取的不同生长条件(W和Y)和不同生长时间(S、Y和L)铁皮石斛,以及不同种石斛属植物(L、J、G、Q和C),均有整齐、清晰的28S和18S rRNA条带(图3)。
2.3.2 RNA浓度和纯度 M7提取的W、S、Y和L的铁皮石斛茎总RNA浓度在50 ng/μL-140 ng/μL之间,OD260/OD280在1.8-2.2之间。M7提取的J、G、Q 和 C茎总 RNA 浓度在 60 ng/μL-110 ng/μL之间,OD260/OD280在2.0-2.1之间(表2)。以上结果均能满足下游的分子生物学实验要求。

图3 M7方法验证的茎总RNA电泳图
3 讨论
RNA提取的原理是首先将细胞破碎裂解,利用一些试剂去除多糖、酚类、蛋白和DNA的污染,再通过一系列的抽提、洗涤和沉淀,最终获得纯净的RNA[27]。富含多糖的植物组织,由于细胞破碎后多糖常与RNA形成难溶性物质,导致RNA分离困难,并造成初提时上清液黏稠,不能很好的与有机相分离,在去除多糖的同时造成RNA大量丢失,降低RNA得率[28]。因此,更高效的细胞裂解是从这类组织中获得高质量及高产量RNA的前提。

表2 M7方法验证的茎总RNA(n=3)
裂解细胞的方法分为物理方法(液氮研磨破碎法)、生物方法(酶方法:蛋白酶K、溶菌酶)和化学方法(CTAB、SDS、NaI、KI、蛋白质变性剂)。本研究所采取的7种方法,M1、M2、M4和M5主要是利用异硫氰酸胍变性剂来破碎细胞壁和去除RNA酶[29],M3和M6所使用的裂解液试剂公司保密。M1、M2和M3为通用试剂盒。李清等[21]报道用M2提取金钗石斛茎RNA可获得满意的结果。用M3提取铁皮石斛[17]、福建山樱花[30]、草珊瑚[31]等植物材料的RNA均出现DNA污染、RNA完整性差的现象。本研究结果与这些文献的报道一致。M4、M5和M6为多糖多酚试剂盒。据报道,M6多用于提取富含多糖多酚类植物的RNA。如甘薯[24]、番茄[32]、芒果等[33],提取结果能满足进一步实验的要求。M7在M6的基础上采取延长孵育时间和加大样品量的措施。延长孵育时间可以增加裂解液与细胞的接触,使其充分裂解,彻底释放RNA[23]。由于石斛属植物富含多糖,在加入裂解液之后会产生大量沉淀,上清液体积小,不易吸取。加大样品量可以获得足够的上清液,减少蛋白质等的污染。采取以上改良措施后,M7达到了去除杂质污染和提高RNA浓度的目的,获得了比M6更好的实验结果。
4 结论
改良华越洋多糖多酚试剂盒法(M7)既能有效去除多糖,也能满足后续分子生物研究对RNA质量的要求,可用于提取石斛属植物茎RNA,也可为富含酚类和多糖等物质的其他植物材料的RNA提取提供参考。
[1]陈心启, 吉占和. 中国兰花全书[M]. 第2版. 北京:中国林业出版社, 2003.
[2]包雪声, 顺庆生, 张申洪, 等. 中国药用石斛图志[M]. 上海:上海科学技术文献出版社, 2005.
[3]国家药典委员会. 中华人民共和国药典. 一部[S]. 北京:中国医药科技出版社, 2015:282-283.
[4]江苏新中医学院. 中药大药典[M]. 上海:上海科学技术出版社,1985:586.
[5]Tong ZG, Qu SC, Zhang JY, et al. Amodified protocol for RNA extraction from different peach tissues suitable for gene isolation and real-time PCR analysis[J]. Mol Biotechnol, 2012, 3:229-236.
[6]Fan G, Hammars G. A quick and inexpensive method for removing polysaccarids from plant genomic DNA[J]. Bio Techniques, 1992,13(1):52-56.
[7]郭翠英, 王跃进, 等. 富含多糖葡萄风信子花瓣总RNA提取方法研究[J]. 西北农业学报, 2007, 16(3):188-191.
[8]阮孟斌, 等. 一种适用于多糖多酚植物的高质量RNA快速提取方法[J]. 热带作物学报, 2011, 32(9):1704-1707.
[9]陈星, 潘迎捷, 孙晓红, 等. 细菌总RNA提取方法的研究进展[J]. 湖南农业科学, 2010, 1(5):9-11.
[10]马敬, 赵洪东, 康宁, 等. 番茄叶片RNA提取方法比较研究[J].现代农业科技, 2015, 1(3):69-70.
[11]Ainsworth C. Isolation of RNA from floral tissue of Rumex acetosa(sorrel)[J]. Plant Mol Biol Reptr, 1994, 12(3):198-203.
[12]孟衡玲, 张薇, 卢丙越, 等. 铁皮石斛查尔酮合酶基因克隆与表达分析[J]. 南方农业学报, 2016, 47(12):2015-2019.
[13]张琳, 蔡茜, 张大为, 等. 铁皮石斛丙酮酸激酶基因的克隆与表达分析[J]. 中草药, 2014, 45(7):990-995.
[14]王翔, 吴林松, 吴秋菊, 等. 铁皮石斛HDS基因的克隆与初步表达分析[J]. 中草药, 2016, 47(5):803-809.
[15]容天聚, 文国松, 钱雄, 等. 两种铁皮石斛总RNA提取方法的比较研究[J]. 云南农业大学学报, 2012, 27(5):703-707.
[16]张志勇, 阳静, 齐泽民. 铁皮石斛总RNA提取方法的比较研究[J]. 江苏农业科学, 2017, 45(4):33-35.
[17]孟衡玲, 杨生超, 文国松, 等. 三种提取铁皮石斛叶片总RNA方法的比较[J]. 分子植物育种, 2011, 9(5):1603-1607.
[18]李标, 王伯初, 唐坤, 等. 铁皮石斛RNA提取及RT-PCR检测[J]. 中草药 , 2006, 37(4):585-588.
[19]Chen XM, Wang FF, Wang YQ, et al. Discrimination of the rare medicinal plant Dendrobium officinale based on naringenin,bibenzyl, and polysaccharides[J]. Science China Life Sciences,2012, 55(12):1092-1099.
[20]吴佳雯, 项丽, 等. 浙江乐清人工种植铁皮石斛不同部位的多糖含量分析[J]. 辽宁中医药大学学报, 2011(12):68-69.
[21]李清, 等. 金钗石斛中3-羟基-3-甲基戊二酰辅酶A合酶基因的克隆及特征分析[J]. 中草药, 2017(12):2502-2508.
[22]余乃通, 周启林, 罗志文, 等. 仙人掌总RNA提取方法的改进与分析[J]. 广东农业科学, 2017, 44(3):75-79.
[23]侯晓婉, 等. 多年生白木香茎干不同部位总RNA提取方法的改良[J]. 热带生物学报, 2016, 7(3):376-380.
[24]李霞, 王欣, 后猛, 等. 紫肉甘薯块根总RNA提取方法的评价[J]. 分子植物育种, 2015, 13(13):165-170.
[25]郝雪英, 丰震, 吕传青. ‘鲁红一号’元宝枫叶片总RNA提取方法的比较研究[J]. 山东农业科学, 2015, 47(3):5-8.
[26]张小林, 韩丽君, 李 龙, 等. RNA甲醛琼脂糖凝胶电泳的优化及探讨[J]. 现代生物医学进展, 2011, 11(2):351-353.
[27]邹晓蕾, 刘礼崔, 罗立新. 细菌总RNA提取方法的比较[J].现代食品科技, 2013, 29(8):1948-1954.
[28]Lewinsohn E, Steele CL, Croteau R. Simple isolation of functional RNA from woody stems of gymnosperms[J]. Plant Mol Biol Reptr, 1994, 12(1):20-25.
[29]朱玉野, 朱继孝, 罗光明, 等. 栀子高质量总RNA的提取[J].中国农学通报, 2012, 28(27):194-198.
[30]荣俊冬, 张迎辉, 薛艺敏, 等. 福建山樱花总RNA提取方法比较分析[J]. 福建林业科技, 2015, 42(1):73-76.
[31]沈少炎, 谢德金, 吴玉香, 等. 草珊瑚叶片总RNA提取方法及效果的比较研究[J]. 浙江林业科技, 2016, 36(5):40-44.
[32]杨荣超, 章月琴, 丰锋, 等. 番茄种子RNA提取及快速检测qRT-PCR模板纯度的方法优化[J]. 种子, 2016, 35(5):27-30.
[33]殷德松, 宋静武, 齐贝贝, 等. β-巯基乙醇对不同时期芒果剪口芽总RNA质量的影响[J]. 中国农学通报, 2017, 33(10):83-86.

