新疆维吾尔族心房颤动患者载脂蛋白E基因rs429358位点多态性及华法林剂量的差异性研究
赵燕 木胡牙提·乌拉斯汉 杨玉春 何鹏义 刘志强 张雷
心房颤动(简称房颤)患者的抗凝治疗非常重要,目前华法林使用最为广泛,有研究报道载脂蛋白E(ApoE)基因多态性与西方人群华法林用量个体差异有一定影响[1-2],国内也有相似研究证实ApoE基因多态性与华法林剂量存在联系[3],但国内尚无维吾尔族ApoE基因多态性与华法林剂量相关性的研究。通过大量查阅英文文献,ApoE基因影响维生素K的摄取,在美国生物技术信息中心的单核苷酸多肽性(SNP)数据库(http://www.ncbi.nlm.nih.gov/SNP)登录ApoE基因人类SNP 找ApoE全基因序列及rs号及其突变位点,可以使用国际人类基因组单体型图计划网站(http://hapmap.ncbi.nlm.nih.gov/index.html.en)来确定ApoE基因的标签SNP,查国内外与ApoE基因SNP位点多态性有关的文献确定rs位点为rs429358。本研究探讨新疆维吾尔族ApoE rs429358位点基因型的分布情况及房颤患者口服华法林的有效剂量。
1 资料与方法
1.1研究对象 纳入标准:①选取2014年 7 月至2016 年 7月在新疆医科大学第一附属医院就诊的长居新疆地区的维吾尔族房颤患者100例。② 经体表心电图或动态心电图检测后确诊为房颤患者。③口服华法林并且使用华法林抗凝治疗已经超过3个月,并已达到稳定维持剂量,即国际化标准比率(INR)已达标者(根据欧美指南建议选取INR在 2.0~3.0 之间的房颤患者)。排除标准:①血液疾病或出血倾向;②血小板计数<120×109/ L; ③心力衰竭(纽约心功能分级3或4级);④肝功能障碍(定义为慢性肝病的存在或显著肝损伤的生化证据);⑤肾功能障碍(定义为慢性透析或血清肌酐>200 mmol/L或肾移植受者); ⑥甲状腺疾病; ⑦恶性肿瘤; ⑧消化性溃疡; ⑨感染; ⑩自身免疫疾病;怀孕;除外家族性房颤发病;排除瓣膜性心脏病、先天性心脏病、肺部疾病、甲状腺功能亢进等疾病患者;选择同期就诊本院体检中心体检的维吾尔族非房颤人群(除外合并高血压病、冠心病、心脏外科手术、瓣膜病、心力衰竭、心肌病、先天性心脏病、肺动脉栓塞、甲状腺功能亢进症等,与饮酒、精神紧张、水电解质紊乱、严重感染等疾病的)100例作为对照组;本研究通过本院临床研究中心伦理委员会审核并批准,所有研究者均签署知情同意书。
1.2临床数据 通过调取本院病历系统进行病例回顾,收集受试者的临床资料,包括年龄、性别、身高、体重、INR值稳定在2~3之间、华法林剂量、伴随疾病、口服的相互影响的药物、吸烟状况、体重指数等指标。
1.3样本采集与DNA提取 清晨抽取受检者外周静脉血2 ml 装入有EDTA抗凝剂的试管。通过标准酚-氯仿法提取基因组DNA,核酸蛋白分析仪(Eppendorf Biophotometer)检测DNA浓度和纯度,OD260/OD280>1.7,说明DNA纯度合格。合格的DNA加入TE液后于-20℃ 保存备用。
1.4引物设计 由Genebank 中查找目的基因序列后对其进行核对,由宝生物工程(大连)有限公司合成,用DNAMAN软件分析,并经检测无发夹结构,无二聚体形成,生工生物工程(上海)有限公司合成。ApoE基因 rs429358位点引物序列如下:(5′-3′)上游引物: 5′_CACTGTGCGACACCCTCC_3′;下游引物:5′_TTCTGCAGGTCATCGGCATC_3′;退火温度为60℃,产物长度为300 bp左右。
1.5聚合酶链式反应(PCR)扩增 设计的引物扩增包含 ApoE rs429358位点的片段。经过对条件摸索后,最终摸索条件时的温度、梯度和PCR条件为:25μl PCR C1000TM Thermal Cycler(PTC-200型PCR扩增仪)上进行反应体系含:PCR Mastermix(2x)25μl,上、下游引物各 0.5 pmol, dd2O9.5μl,基因组DNA 2μl。循环参数:95℃ 预变性 5 min,95℃ 变性 30 s、60℃退火 45 s,72℃ 延伸45 s,共35个循环;最后72℃ 总延伸5 min。PCR反应结束后,取 6μl扩增产物在 1.5%~2.0%琼脂糖凝胶上电泳,观察 PCR产物的特异性和片断大小。
1.6酶切及分型鉴定 ApoE基因rs429358位点的酶切体系:酶切总体积:20 μl;①限制性核酸内切酶的选择以及用量:HhaI 0.8 μl;②PCR扩增产物:10 μl;③10×bufferR:2 μl;④ddH2O:7.2 μl;⑤酶切温度:37℃; 时间:16 h过夜;2%琼脂糖凝胶电泳分析酶切产物:取15 μl 酶切产物加入 2%琼脂糖凝胶负极端的加样孔,在180 V电压下电泳45 min,在紫外线灯下观察带型。将PCR产物与DNA片段长度标准物用Marker比对鉴定基因型。
1.7统计学处理 采用SPSS23.0统计软件包进行统计分析。通过Hardy-Weinberg平衡分析,确定研究样本的群体代表性。ApoE基因等位基因频率和基因型频率采用基因计数法,计数资料以%表示,基因型及等位基因频率比较采用χ2检验,检验水准a=0.05。计量资料的比较采用两样本均数比较的t检验。
2 结果
2.1两组一般资料的比较 房颤组年龄大于对照组;身高、血压、甘油三酯、低密度脂蛋白等均无差异(表1)。
2.2Hardy-Weinberg平衡吻合度检验 所选人群ApoE基因 rs429358位点的基因型和等位基因频率分布均符合Hardy-Weinberg 平衡,说明该样本具有人群代表性 (表2)。
2.3ApoE基因 rs 429358位点基因多态性 ApoE由位于一个基因位点上的三个等位基因所控制,即E2、E3和E4, 产生三种纯合子(E2/2,E3/3,E4/4)和三种杂合子(E2/3,E2/4,E3/4)共六种, 依次为38,16,19,72,18,48和33 bp,其中38,16和18 bp片断是所有ApoE基因型共有的,E2在112位和158位均为-GTGC-,不能被HhaI酶切,所得的片断依次为38,16,91,18和81 bp,E3在112为-GTGC-,不能被HhaI酶切,所得的片断依次为38,16,91,18,48和33bp,本实验得出的产物长度为300 bp左右,包含目的片段;共检出6种基因型(图1及图2)。
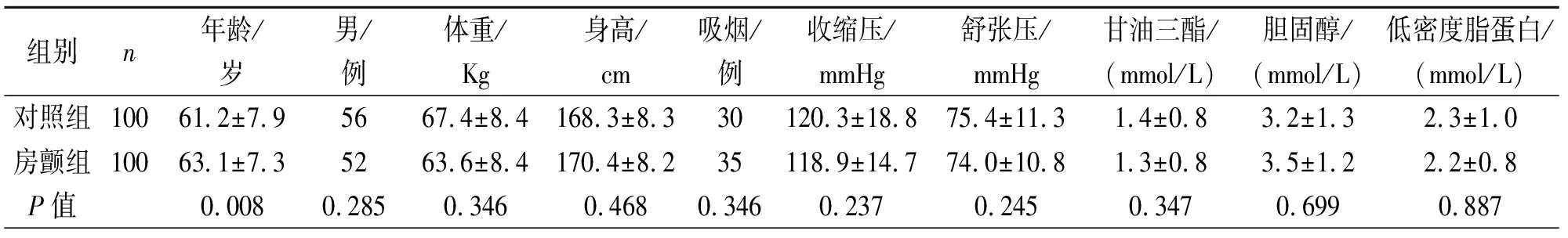
表1 两组一般资料的比较
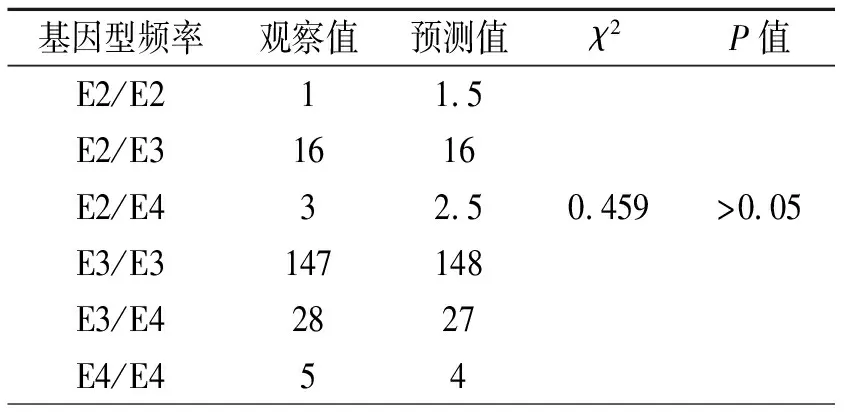
表2 Hardy-Weinberg平衡吻合度检验
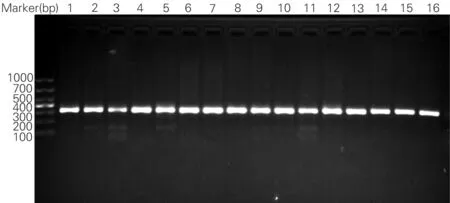
图1 ApoE基因 rs 429358位点 PCR产物电泳图

2,4,6,10,11,12,15,17 E3/E3基因型; 1为E2/E2基因型; 3为E3/E4基因型; 13,16为E3/E4基因型; 7为非酶切基因; 8为E2/E2基因型; E2/E3基因型为5,9; 14为E2/E4基因型
2.4ApoE基因 rs429358位点的基因型和等位基因频率分布 共检出3种等位基因和6种基因型;E2/E2、E2/E3、E2/E4、E3/E3、E3/E4和E4/E4六种基因型频率分别为:0.5%、8%、1.5%、73.5%、14%、2.5%;E2、E3、E4的等位基因型比例为8.5%、75%、16.5%,房颤组与对照组比无差异(P>0.05),见表3。

表3 新疆ApoE基因rs429358位点基因型及等位基因分布
2.5基因型与华法林剂量之间的比较 房颤组华法林稳定剂量范围是 1.25~4.5 mg/d, 平均剂量为(2.438±0.563)mg/d。由于E2/E2、E2/E4和E4/E4三种基因型病例数太少,无法进行对比,故只研究E2/E3、E3/E4与E3/E3三者之间有无差异。E2/E3基因型华法林剂量高于E3/E3,E3/E4基因型华法林的剂量低于E3/E3,两两比较,无差异见表4。

表4 各基因型的华法林稳定剂量/(mg/d)
3 讨论
近年来心血管药物基因学与临床应用越来越受关注,某些国家已经开展了华法林剂量算法相结合的基因多态性遗传与临床因素估算华法林初始剂量[4-5]。比较标准剂量华法林初始剂量基因导向性风险-效益,证明基因导向的模式可能会降低出血事件[6]。美国食品药品监督管理局2007年修订后的药物说明和2010年将遗传信息VKORC1、CYP2C9来临床指导华法林抗凝治疗[7-8]。
载脂蛋白E是一种富含精氨酸的碱性蛋白,人ApoE是由299个氨基酸残基组成,分子量为34145D,其合成是由位于一个基因位点上的三个等位基因所控制,即E2、E3和E4,产生三种纯合子(E2/2,E3/3,E4/4)和三种杂合子(E2/3,E2/4,E3/4)共六种常见表型[9-11],不同的载脂蛋白E亚型具有不同的亲和力和低密度脂蛋白受体,维生素K的乳糜微粒残余肝脏清除不同ApoE亚型之间,E2 本研究中,基本资料显示年龄是房颤的危险因素,也就是说随着年龄增加,房颤的患病率随之增高[15],与既往国内研究基本一致。这可能与老年人暴露在其他危险因素的机会增加有关,此外年龄增长的同时常常伴有多重、复杂的心脏结构及电活动的改变,包括窦房结结节状纤维的逐级丧失和纤维化、脂肪组织的逐渐增多,以及由于左室顺应性逐渐下降所引起的左房扩大,都会诱发房颤的发生。故在新疆存在研究价值,新疆维吾尔族房颤患者ApoE基因rs 429358位点基因多态性及与华法林稳定剂量差异性研究;①新疆地区维吾尔族人群ApoE基因 rs429358位点的六种基因型频率分别为:0.5%、8%、1.5%、73.5%、14%、2.5%;维吾尔族ApoE基因 rs429358位点的等位基因型比例为8.5%、75%、16.5%;与国内黄胜文等研究相类似[16];与国内的云南白族[17]人群相对比,本研究中的E4等位基因比例稍高,与桂西壮族[18]人群的ApoE基因多态性相对比,本研究的E2基因型偏高,维吾尔族房颤患者E2/E3、E3/E4与E3/E3三者基因型相比,使用有效华法林剂量具有统计学差异(P<0.05);故ApoE基因型不同可能口服的有效华法林剂量存在差异。 ApoE基因rs 429358位点可作为房颤患者针对华法林稳定剂量预测个体差异性的指标之一。由于不同个体间华法林稳定剂量可相差20倍以上,在常规剂量下, 容易发生血栓形成或出血事件等副作用。 故患者在口服华法林抗凝治疗前,应考虑基因多态性,严格执行个体化用药不仅可使患者迅速得到有效的治疗效果,还能减少出血或者血栓的事件发生,提高华法林临床应用的安全性和有效性。 1 Shahin MH, Khalifa SI, Gong Y,et al. Genetic and nongenetic factors associated with warfarin dose requirements in Egyptian patients[J]. Pharmacogenet Genomics, 2011,21:130 2 Yu WY, Sun X, Wadelius M, et al.Influence of ApoE gene polymorphism on interindividual and interethnic warfarin dosage requirement: a systematic review and meta-analysis[J]. Cardiovascular Therapeutics,2016,34:297 3 Liu R, Zhang K, Gong ZZ, et al.Association of apolipoprotein E (ApoE) polymorphisms with warfarin maintenance dose in a northern Han Chinese population[J]. Lipids Health,2016,15:34 4 Harada T, Ariyoshi N, Shimura H,et al.Application of Akaike information criterion to evaluate warfarin dosing algorithm[J]. Thromb Res,2010,126:183 5 Schelleman H, Chen Z, Kealey C,et al.Warfarin response and vitamin K epoxide reductase complex 1 in African Americans and Caucasians[J]. Clin Pharmacol Ther,2007,81:742 6 Wadelius M, Chen LY, Lindh JD,et al. The largest prospective warfarin-treated cohort supports genetic forecasting[J]. Blood,2009,113:784 7 Finkelman BS, Gage BF, Johnson JA,et al. Genetic warfarin dosing: tables versus algorithms[J]. J Am Coll Cardiol,2011,57:612 8 Lee MT, Chen YT, Wen MS, et al. Estimation of the warfarin dose with clinical and pharmacogenetic data[J]. N Engl J Med,2009,360:753 9 Zhu S, Wang Z, Wu X,et al. Apolipoprotein E polymorphism is associated with lower extremity deep venous thrombosis: color-flow Doppler ultrasound evaluation[J]. Lipids Health Dis, 2014 , 13 (1) ,21 10 Yu B, Chen W, Wang R, et al. Association of apolipoprotein E polymorphism with maximal oxygen uptake after exercise training: a study of Chinese young adult[J]. Lipids Health Dis, 2014. 13(1), 40 11 Sun YP, Zhang B, Miao L,et al. Association of polipoprotein E (ApoE) polymorphisms with risk of primary hyperuricemia in Uygur men, Xinjiang, China[J]. Lipids Health Dis, 2015 , 14 (1) :1 12 Kohnke H, Scordo MG, Pengo V, et al.Apolipoprotein E(ApoE)and warfarin dosing in an Italian population[J]. Eur J Clin Pharmacol, 2005, 61: 781 13 Kimmel SE, Christie J, Kealey C,et al.Apolipoprotein E genotype and warfarin dosing among Caucasians and African Americans[J]. Pharmacogenomics J, 2008, 8: 53 14 De Oliveria Almeida VC, Ribeiro DD, Gomes KB,et al.Polymorphisms of CYP2C9,VKORC1, MDR1, ApoE and UGT1A1 genes and the therapeutic warfarin dose in Brazilian patients with thrombosis: a prospective cohort study[J]. Mol Diagn Ther,2014,18:675 15 周自强,胡大一,陈捷,等.中国心房颤动现状的流行病学研究 [J].中华内科杂志,2004,43(7):491 16 黄盛文,陈保林,向道康,等. 载脂蛋白E基因多态性与华法林维持剂量的相关性(英文)[J]. 中南大学学报(医学版), 2011,36:212 17 许虹,聂荔,郭春,等.云南白族、汉族人群载脂蛋白E基因多态与缺血性脑血管病的相关性[J]. 中华神经科杂志,2009, 42(12),819 18 蒙兰青,黄俊芳,简崇东,等.桂西壮族人群ACE、APOE和MTFHR基因多态性与缺血性脑卒中的相关性[J].实用医学杂志,2016,32(13): 2 083

