土壤跳虫对转EPSPS基因抗除草剂玉米CC-2种植的响应
范春苗 ,王柏凤 ,周 蕾 ,尹俊琦 ,宋新元 *
(1.吉林农业大学生命科学学院,长春 130118;2.吉林省农业科学院农业生物技术研究所,长春 130033;3.吉林省农业生物技术重点实验室,长春 130033;4.哈尔滨师范大学生命科学与技术学院,哈尔滨 150025)
转基因玉米自1996年被美国引入生产以来,已经种植了20多年,由于其抗虫和抗除草剂等优良性状给社会带来了巨大经济和环境效益,使之种植面积急剧扩大,截止到2014年种植总面积超过了5000万hm2[1-3],随之而来的环境安全问题也引起了人们的关注,主要集中在对生物多样性方面是否存在潜在的风险[4-5]。因此,转基因抗虫玉米对田间土壤动物多样性影响的研究不断增多,如刘新颖等[6]研究发现转Cry1Ie基因抗虫玉米IE09S034对田间大型土壤动物群落无不利影响,尹俊琦等[7]发现转Cry1Ac基因抗虫玉米Bt-799对田间节肢动物群落多样性没有明显的影响。国外学者在转Cry3Bb1基因抗虫玉米MON863的种植对土壤线虫影响的研究中发现,玉米生长期的气候变化和杀虫剂的使用使土壤线虫的丰富度显著降低,而转基因玉米对土壤线虫丰富度并未产生显著影响[8]。在转Cry1Ab基因抗虫玉米MON810的种植对秀丽隐杆线虫影响的研究中发现,Cry1Ab蛋白的浓度要达到41 mg·L-1时才会对秀丽隐杆线虫的生长发育产生显著影响,但是转基因玉米的土样中Cry1Ab蛋白的浓度远低于41 mg·L-1[9]。转基因抗除草剂玉米的种植对土壤动物群落又会产生什么影响?与环境因子相比转基因抗除草剂玉米对土壤动物群落有多大的影响?虽然姜莹等[10]研究发现转EPSPS基因抗除草剂玉米CC-2对田间多个类群组成的土壤动物群落无不利影响,但却未对某个具体土壤动物类群做详细的分析。
跳虫作为土壤生态系统中主要功能类群之一,参与了土壤中动植物残体分解、营养物质循环、土壤发育和熟化等过程,同时在保持农业生态系统健康和稳定方面也发挥着重要作用[11-12]。由于土壤跳虫对环境变化敏感,因此多被作为转基因植物生态安全性评价中的重要生物指标[13-14]。土壤环境因素的变化可以直接或间接影响土壤跳虫群落结构,邱军等[15]研究发现土壤中跳虫的数量变化与土壤含水量有关,其最适湿度约为16%的含水量;袁志忠等[16]发现在土壤中添加凋落物的方式会增加土壤跳虫群落多样性;Choi等[17]发现环境中的水含量是影响跳虫生存繁殖的重要生理因子。土壤跳虫的分类主要是基于对土壤跳虫形态学特征的分析,土壤跳虫群落形态特征的改变反映土壤跳虫群落组成的变化,以此为依据可以判断一定时间内土壤跳虫群落组成的变化[18-19]。因此本研究选择以土壤跳虫作为研究对象。
本研究试验地点选址我国主要的春玉米产区——吉林省,试验材料为转基因抗除草剂玉米CC-2,在2014年5月至10月采用土漏斗法分别对转基因玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫进行收集,分析两种玉米材料和环境因子对土壤跳虫群落的影响,进一步明确土壤跳虫群落变化的原因,探讨在这一年的时间里转基因抗除草剂玉米CC-2的种植是否对土壤跳虫群落产生显著影响,为转基因玉米产业化种植提供一份科学数据。
1 材料与方法
1.1 供试材料
试验材料为转基因抗除草剂玉米CC-2及其非转基因对照玉米郑58,均由研发单位中国农业大学提供。
1.2 试验地点及小区设计
试验地点位于吉林省公主岭市转基因植物环境安全研究试验圃场(总面积 10 hm2,43°30′N,124°49′E),吉林省农业科学院院区国家转基因玉米、大豆中试与产业化基地。土壤类型为东北典型黑土,土壤含有机质(27.08±0.07)g·kg-1、碱解氮(77.54±0.07)mg·kg-1、速效钾(154.10±0.76)mg·kg-1和速效磷(10.68±0.07)mg·kg-1,pH 值(5.36±0.02)。
转基因抗除草剂玉米CC-2及其非转基因对照玉米郑58各3个小区,共6个小区,每小区150 m2(10 m×15 m),随机区组分布,小区间留出2 m隔离带,2014年5月采取人工播种方式,2~3粒·穴-1,普通农事耕作,均不喷洒除草剂。
1.3 采样方法
采用土漏斗法,2014年共调查6次,时间分别选择在5月8日(播种前期)、6月10日(拔节期)、7月17日(抽丝期)、8月6日(成熟前期)、9月10日(成熟后期)和10月9日(收割前期)。各种玉米材料每个小区分别随机选取5个样点,每个样点用直径为8 cm、高为15 cm的取土器取土一钻(10 cm深,共约200 mL土),并取回就近玉米植株的根部,分别装入19 cm×13 cm封闭式聚丙乙烯塑料袋,带回实验室备用。土样中的4/5用于分离土壤跳虫,1/5用于测定土壤含水量和pH,玉米根部用于测定根部生物量。分离出的土壤跳虫用95%的乙醇分装,-4℃保存,以供进一步鉴定。
1.4 土壤跳虫鉴定与形态特征值确定
根据《中国土壤动物检索图鉴》[20]《古北区跳虫概述-等节跳科》[21]和《美国北部跳虫》[22]等标准,在低倍解剖镜下对土壤跳虫进行初步分拣,在高倍显微镜下进行分类鉴定与统计,本研究对跳虫鉴定到种。
将收集到的土壤跳虫进行分类,从各种群中随机选取20头对其形态特征进行测量,主要包括:眼睛数量、体长、体色(体表颗粒覆盖度)、弹器发达程度和触角长,并计算均值,具体赋值见表1。再根据不同种类土壤跳虫在取样点中的比例计算出每个取样点土壤跳虫群落的这5个形态特征值。
1.5 分析方法
根据土壤跳虫各种群的捕获量占总捕获量的百分比来划分土壤跳虫的数量等级:10%以上为优势种群;1%~10%为常见种群;小于1%为稀有种群[23-24]。本研究利用Simpson优势度指数(D)、Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)、物种丰富度(S)和个体数(N)分析土壤跳虫群落多样性,采用如下公式计算:

式中:ni为i种群的个体数;Pi为i种群占总个体数的比率;i=1,2…,n。
采用Excel 2007对数据进行初步整理,利用DPS软件计算相关群落多样性指数,并采用SPSS 23.0对调查数据进行方差分析,运用CANOCO 4.5对调查数据进行冗余分析(RDA),分析不同环境因子对跳虫群落的影响[25-27]。

表1 跳虫形态特征均值计算方法Table1 Calculation method of mean value of Collembolan morphological characteristics
2 结果与分析
2.1 转基因玉米CC-2的种植对土壤跳虫群落结构的影响
2.1.1 土壤跳虫群落的基本组成
2014年5月至10月,6次采样共收集样本168份,鉴定出的土壤跳虫个体总数为3926只,其中转基因玉米CC-2田间土壤跳虫总数为2046只,非转基因对照玉米郑58田间土壤跳虫总数为1880只。分析结果表明,转基因玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫群落组成相似,均隶属于4科9属14种。优势种群均为棘跳科Thalas saphorura macrospinata、等节跳科Desoria sp1和Isotomiella minor,其在转基因玉米中所占的比例分别为45.21%、15.10%、29.28%,在非转基因玉米中所占的比例分别为 46.86%、20.27%、23.88%(表2)。
2.1.2 对土壤跳虫群落形态特征值的影响
试验从土壤跳虫眼睛数量、体长、体色、弹器发达程度、触角长度5个形态特征来分析土壤跳虫群落组成的变化。根据表1对数据进行赋值处理,对2014年各采样时期土壤跳虫群落各形态特征值进行单因素方差分析,结果表明(表3),各采样时期转基因玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫群落除在拔节期土壤跳虫群落体长有显著差异外,其余所有形态特征值均无显著差异。以时间作为重复,对2014年6个采样时期土壤跳虫群落各形态特征值做重复测量方差分析,同样结果表明转基因玉米CC-2与其非转基因对照玉米郑58田间土壤跳虫群落各特征值在整个调查期间均无显著差异。
2.2 转基因玉米CC-2的种植对土壤跳虫群落多样性的影响
对转基因玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫群落多样性指数进行分析,结果表明(表4):两种玉米材料田间土壤跳虫群落多样性指数总体变化趋势相似,其中个体数波动比较大,在6月10日之后下降,随后又逐渐上升,至8月份达到峰值;物种丰富度、Simpson优势度指数、Shannonwiener多样性指数和Pielou均匀性指数均随时间变化趋于平稳状态;对各采样时期进行单因素方差分析的结果表明,8月6日(成熟前期)两种玉米田间土壤跳虫的Simpson优势度指数和Shannon-wiener多样性指数均有显著差异(P<0.05);以时间作为重复,对2014年6个采样时期土壤跳虫的5个群落多样性指数分别做重复测量方差分析,结果表明转基因玉米CC-2与其非转基因对照玉米郑58田间土壤跳虫各群落多样性指数在整个调查期间均无显著差异(P>0.05)。
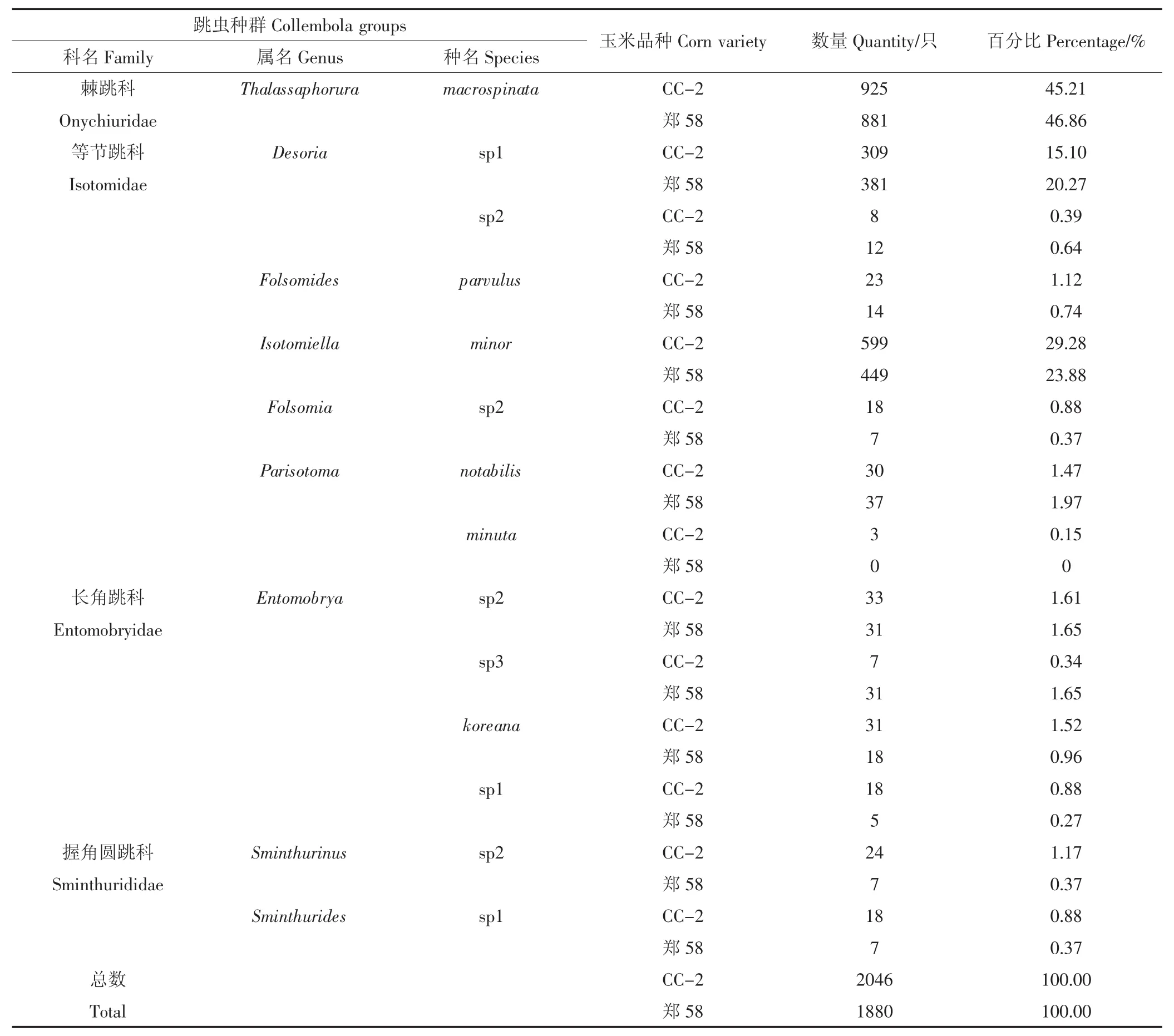
表2 转基因玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫群落组成Table2 Community composition of soil Collembola in corn fields of transgenic CC-2 and its control Zheng 58
2.3 环境因子对土壤跳虫群落结构的影响
采用RDA排序分析土壤跳虫群落与环境因子之间的关系。选取的环境因子为玉米根部生物量、样地含水量、pH(土水比为 1∶1)和玉米材料(表 5)。图1 反映了土壤跳虫群落与环境因子的关系以及不同环境因子对土壤跳虫群落分布的影响。排序轴1主要反映了pH和玉米材料对土壤跳虫群落分布的影响;排序轴2主要反映了根部生物量和样地含水量对土壤跳虫群落分布的影响。第1排序轴和第2排序轴的特征值分别为0.189和0.029,第1排序轴解释了18.6%的群落物种变化和79.9%的物种与环境的关系,第2排序轴进一步解释了21.4%的群落物种变化和92.3%的物种与环境的关系。通过蒙特卡罗检验得出的结果表明,所有已测定的环境因子解释了23%的土壤跳虫群落结构的变异,其中玉米根部生物量和样地含水量对土壤跳虫群落结构产生了显著影响,而不同玉米品种(转基因抗除草剂玉米CC-2和非转基因对照玉米郑58)仅解释了3%的跳虫群落结构的变异,未产生显著影响(表6)。
如图1所示,实心箭头代表环境因子,空心箭头代表了各类土壤跳虫。实心箭头越长表示某一环境因子对土壤跳虫的影响越大,空心箭头越长表示土壤跳虫受影响的程度越大。实心箭头与空心箭头之间夹角的余弦值代表了环境因子与土壤跳虫之间的相关性。玉米根部生物量和样地含水量对土壤跳虫产生显著影响,大部分土壤跳虫与玉米根部生物量呈正相关,握角圆跳科Sminthurides sp1、等节跳科Desoria sp1和握角圆跳科Sminthurinus sp2与玉米根部生物量正相关性较大。除握角圆跳科Sminthurides sp1外,其余土壤跳虫与样地含水量成负相关,等节跳科Folsomia sp2、等节跳科Proisotoma minuta和等节跳科Folsomides parvulus与样地含水量负相关性较大。

表3 转基因玉米CC-2的种植对土壤跳虫群落形态特征值的影响Table3 The effects of cultivation of transgenic corn CC-2 on the value of soil Collembolan community morphological characteristics
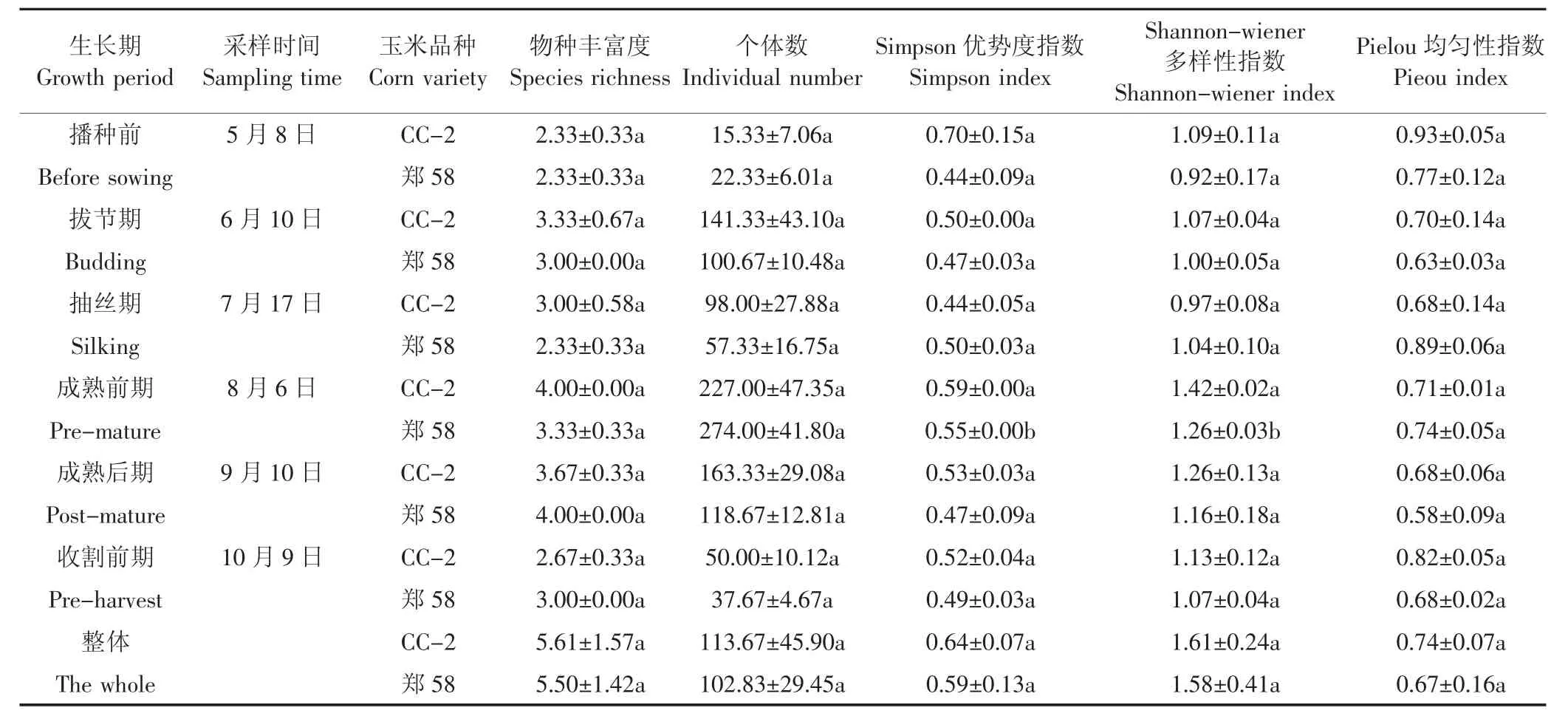
表4 转基因玉米CC-2的种植对田间土壤跳虫群落多样性指数的影响Table4 The effects of cultivation of transgenic corn CC-2 on community diversity index of soil Collembola in fields
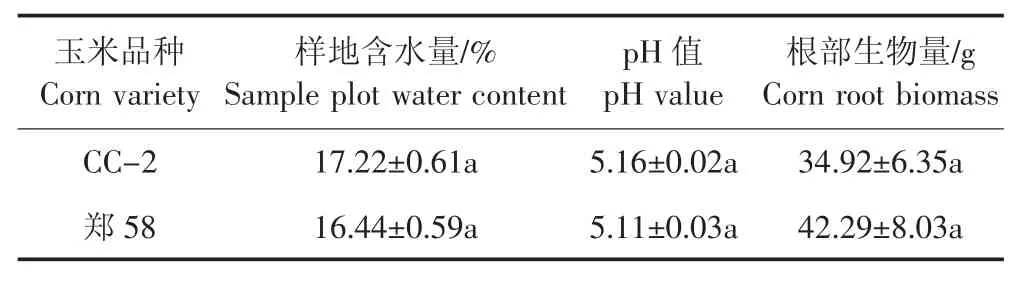
表5 环境因子Table5 Environmental factors

图1 冗余分析(RDA)环境因子对土壤跳虫群落的影响Figure1 The effect of environmental factors on Collembola community by Redundancy analysis(RDA)

表6 冗余分析(RDA)中蒙特卡罗检验不同环境因子对土壤跳虫群落的影响Table6 The Monte Carlo tests the effect of different environmental factors on soil Collembolan community in Redundancy analysis(RDA)
3 讨论
与之前[28-33]转基因作物对土壤动物群落影响的研究相比,本研究不仅对土壤跳虫群落多样性进行了分析,还通过分析土壤跳虫群落形态特征值的方式来判断不同时期土壤跳虫群落组成是否发生变化,并利用RDA方法分析土壤跳虫与环境因子之间的相关性。本研究的结果表明转基因玉米CC-2与其非转基因对照玉米郑58土壤跳虫群落组成无显著差异,且优势种群基本相同,这与前人[28-33]调查转基因作物与对照非转基因作物大田试验所得结果类似。由于各种类土壤跳虫对应的眼睛数量、体长、体色、弹器发达程度和触角长度均有所不同[20],综合这5个形态特征值对某一段时间内转基因玉米CC-2与其非转基因对照玉米郑58田间土壤跳虫群落组成的变化进行判断,在拔节期转基因玉米CC-2田间土壤跳虫群落体长显著高于非转基因对照玉米郑58,说明转基因玉米CC-2田间体长较大的土壤跳虫种群(如长角跳科和等节跳科)所占比例较大,但是在整个调查期间土壤跳虫群落体长的波动未产生显著差异,所以转基因玉米CC-2与其非转基因对照玉米郑58田间土壤跳虫群落组成无显著差异。在成熟前期,转基因玉米CC-2田间土壤跳虫Simpson优势度指数和Shannon-wiener多样性指数均大于其非转基因对照玉米郑58,且达显著水平,这种差异的产生可能与优势种群等节跳科Isotomiella minor和棘跳科Thalassaphorura macrospinata在RDA分析中受环境因子影响较大有关,其具体机理有待进一步研究。从整体的数据分析中得出,转基因玉米CC-2的种植对土壤跳虫群落多样性无不利影响。
在本研究的试验环境条件下,pH对土壤跳虫群落分布的影响不显著,但样地含水量和玉米根部生物量对其影响显著,这与韩慧莹等[34]研究发现土壤动物对pH的响应程度较低,殷秀琴等[35]研究发现有机质和土壤湿度的变化是影响土壤动物多样性地理分布的主要因子的结果相一致。本研究还发现大多数土壤跳虫随样地含水量增大而减少,随玉米根部生物量增大而增多,这与徐演鹏等[36]研究发现土壤湿度和土壤pH对短角跳科和球角跳科种群具有抑制性作用,韩慧莹等[34]研究发现土壤动物对有机质具有显著正向响应的结果相一致。
4 结论
(1)通过显著性分析结果得出,转基因抗除草剂玉米CC-2及其非转基因对照玉米郑58田间土壤跳虫群落结构和多样性整体上均无显著差异。
(2)通过RDA分析结果得出,玉米根部生物量和样地含水量是影响土壤跳虫群落结构的主要因子。
综上所述,初步结论为转基因抗除草剂玉米CC-2对土壤跳虫群落无不利影响。
[1]James C.Global status of commercialized biotech/GM Crops:2014[M].Ithaca,NY:International Service for the Acquisition of Agri-Biotech Applications,2011.
[2]Ishida Y,Saito H,Ohta S.High efficiency transformation of maize(Zea mays L.)mediated by agrobacterium tumefaciens[J].Nature Biotechnology,1996,14(6):745-750.
[3]数据基因农业网.ISAAA信息[J].生物技术通报,2015(2):102.
Data Gene of NY.ISAAA[J].Biological Technical Bulletin,2015(2):102.
[4]宋新元,张欣芳,于 壮,等.转基因植物环境安全评价策略[J].生物安全学报,2011,20(1):37-42.
SONG Xin-yuan,ZHANG Xin-fang,YU Zhuang,et al.Strategy of environmental bio-safety assessment for transgenic plants[J].Journal of Biosafety,2011,20(1):37-42.
[5]左 娇,郭运玲,孔 华,等.转基因玉米安全性评价研究进展[J].玉米科学,2014,22(1):73-78.
ZUO Jiao,GUO Yun-ling,KONG Hua,et al.Progress on safety evaluation of transgenic corn[J].Maize Sciences,2014,22(1):73-78.
[6]刘新颖,王柏凤,周 琳,等.转cry1Ie基因抗虫玉米IE09S034种植对田间大型土壤动物多样性的影响[J].作物杂志,2016(1):62-68.
LIU Xin-ying,WANG Bai-feng,ZHOU Lin,et al.Impacts of transgenic insect-resistant maize with cry1Iegene on large soil animal diversity in field[J].Crops,2016(1):62-68.
[7]尹俊琦,武奉慈,周 琳,等.转Cry1Ac基因抗虫玉米Bt-799对田间节肢动物群落多样性的影响[J].生物安全学报,2017,26(2):159-167.
YIN Jun-qi,WU Feng-ci,ZHOU Lin,et al.Impacts of a transgenic insect-resistant maize(Bt-799) containing a Cry1Ac gene on arthropod biodiversity[J].Journal of Biosafety,2017,26(2):159-167.
[8]Neher D A,Muthumbi A W N,Dively G P.Impact of coleopteran-active Bt corn on non-target nematode communities in soil and decomposing corn roots[J].Soil Biology and Biochemistry,2014,76(Suppl C):127-135.
[9]Höss S,Arndt M,Baumgarte S,et al.Effects of transgenic corn and Cry1Ab protein on the nematode,Caenorhabditis elegans[J].Ecotoxicology and Environmental Safety,2008,70(2):334-340.
[10]姜 莹,王柏凤,周 琳,等.转EPSPS基因抗除草剂玉米“CC-2”对土壤动物群落的短期影响[J].植物保护,2017,43(1):34-39.
JIANG Ying,WANG Bai-feng,ZHOU Lin,et al.Impacts of transgenic herbicide-resistant maize with EPSPS gene on soil fauna community[J].Plant Protection,2017,43(1):34-39.
[11]Brusard L.Soil fauna,guilds,functional groups and eco-system processes[J].Applied Soil Ecology,1998,9(1/2/3):123-135.
[12]Haimi J.Decomposer animals and bioremediation of soils[J].Environment Pollution,2000,107(2):233-238.
[13]Ryan A.Conceptualizing risk assessment methodology for genetically modified organisms[J].Environmental Biosafety Research,2005,4(2):67-70.
[14]张志罡,孙继英,胡 波,等.土壤动物研究综述[J].生命科学研究,2006,10(4):72-75.
ZHANG Zhi-gang,SUN Ji-ying,HU Bo,et al.The research review of soil animal[J].Life Science Research,2006,10(4):72-75.
[15]邱 军,傅荣恕.土壤温湿度对甲螨和跳虫数量的影响[J].山东师范大学学报(自然科学版),2004,19(4):72-74.
QIU Jun,FU Rong-shu.The effects of temperature and soil water content for the number of oribatida and collembola[J].Journal of Shandong Normal University(Natural Science),2004,19(4):72-74.
[16]袁志忠,Singh A N,胡颖圆.添加凋落物对土壤跳虫群落的影响[J].土壤通报,2014,45(4):841-846.
YUAN Zhi-zhong,Singh A N,HU Ying-yuan.Effect of litter addition on springtail community[J].Chinese Journal of Soil Science,2014,45(4):841-846.
[17]Choi W,Moorhead D L,Deborah A N,et al.A modeling study of soil temperature and moisture effects on population dynamics of Paronychiurus kimi(Collembola:Onychiuridae)[J].Biology and Fertility of Soils,2006,43(1):96-75.
[18]Lina A,Widenfalk,Anna M,et al.Small-scale collembola community composition in a pine forest soil-overdispersion in functional traits indicates the importance of species interactions[J].Soil Biology&Biochemistry,2016,103:52-62.
[19]Benoît V,Sandrine,Cédric D,et al.The‘terril’effect:Coal mine spoil tips select for collembolan functional traits in post-mining landscapes of Northern France[J].Applied Soil Ecology,2017,121:90-101.
[20]尹文英.中国土壤动物检索图鉴[M].北京:科学出版社,1998:282-292.
YIN Wen-ying.Chinese soil animal retrieving map[M].Beijing:Science Press,1998:282-292.
[21]Potapov M. Synopses on palaearctic collembola:Isotomidae[M]. Gorlitz:Abhandlungen und Berichte des Naturkundemuseums, 2001.
[22]Christiansen K,Bellinger P.The collembola of North America north of the Rio Grand[M].Iowa:Grinnell College,1980.
[23]王子健,刘 佳,王 尚.净月潭国家森林公园凋落物层土壤动物群落多样性[J].生态与农村环境学报,2012,28(4):368-372.
WANG Zi-jian,LIU Jia,WANG Shang.The community identity of soil animal of litter layer in Jingyuetan national forests[J].Journal of Ecology and Rural Environment,2012,28(4):368-372.
[24]廖崇惠,李健雄,黄海涛.南亚热带森林土壤动物群落多样性研究[J].生态学报,1997,17(5):549-555.
LIAO Chong-hui,LI Jian-xiong,HUANG Hai-tao.The research on community identity of soil animal in Southern subtropical forest[J].Acta Ecologica Sinica,1997,17(5):549-555.
[25]张金屯.数量生态学[M].北京:科学出版社,2011:131-192.
ZHANG Jin-tun.Quantitative ecology[M].Beijing:Science Press,2011:131-192.
[26]郭 焱,李保国.玉米冠层的数学描述与三维重建研究[J].应用生态学报,1999,10(1):39-41.
GUO Yan,LI Bao-guo.The research on mathematical description of maize canopy and three-dimensional reconstruction[J].Chinese Journal of Applied Ecology,1999,10(1):39-41.
[27]唐启义,冯明光.实用统计分析及其计算机处理平台[M].北京:中国农业出版社,1997:108-125.
TANG Qi-yi,FENG Ming-guang.DPScdata processing system for practical statistic s[M].Beijing:China Agricultural Press,1997:108-125.
[28]蔡万伦,石尚柏,杨长举,等.不同种植方式下转Bt基因水稻对稻田节肢动物群落的影响[J].昆虫学报,2005,48(4):537-543.
CAI Wan-lun,SHI Shang-bai,YANG Chang-ju,et al.Difference of arthropod communities in Btrice paddies under different cropping patterns[J].Acta Entomol Sinica,2005,48(4):537-543.
[29]李孝刚,刘 标,曹 伟,等.不同种植年限转基因抗虫棉对土壤中小型节肢动物的影响[J].土壤学报,2011,48(3):587-593.
LI Xiao-guang,LIU Biao,CAO Wei,et al.The effect of transgenic insect resistant cotton on soil small arthropods in different planting years[J].Acta Pedologica Sinica,2011,48(3):587-593.
[30]刘志诚,叶恭银,胡 苯,等.转cryAb/cry1Ac基因籼稻对稻田节肢动物群落影响[J].昆虫学报,2003,46(4):454-465.
LIU Zhi-cheng, YE Gong-yin, HU Ben, et al. Impact of transgenicindicarice with a fused gene of cry1Ab/cry1Ac on the rice paddy arthropodcommunity[J]. Acta Entomol Sinica, 2003, 46(4):454-465.
[31]Wang B F, Chang L, Wu D H. Effect of transgeniccorn cultivation andsampling location on the feeding habits of collembola[J]. Journal ofAgricultural Science and Technology A, 2014(4):235-242.
[32]Bitzer R J,Ric e M E,Pilc her C D.Biodiversity and community structure of epedaphic and euedaphic springtails(Collembola)in transgenic rootworm Btcorn[J].Environmental Entomology,2005,34(5):1346-1376.
[33]Cortet J, Griffiths B S, BohanecM. Evaluation of effects of transgenicBt, maize on microarthropods in a European multi-site experiment[J].Pedobiologia, 2007, 51(3):207-218.
[34]韩慧莹,殷秀琴,寇新昌.长白山地低山区土壤动物群落特征及其对环境因子变化的响应[J].生态学报,2017,37(7):1-9.
HAN Hui-ying, YIN Xiu-qin, KOU Xin-chang. Community characteristicsof soil fauna in the low-mountain of the Changbai Mountains andits respond to the chang of environmental factors[J]. Acta EcologicaSinica, 2017, 37(7):1-9.
[35]殷秀琴,薛文丽,马 辰.长白山玄武岩台地土壤动物多样性及其生态地理分布[J].地理科学,2016,36(7):1106-1114.
YIN Xiu-qin, XUE Wen-li, MA Chen. Diversity and ecological geographic distributionof soil fauna in basalt platform of the ChangbaiMountains[J]. Scientia Geographica Sinica, 2016, 36(7):1106-1114.
[36]徐演鹏,谭 飞,胡彦鹏,等.秸秆还田对黑土区农田中小型土壤节肢动物群落的影响[J].动物学杂志,2015,50(2):262-271.
XU Yan-peng,TAN Fei,HU Yan-peng,et al.Effect of straw returning on cropland soil meso-and micro-arthropods community in the black soil area[J].Chinese Journal of Zoology,2015,50(2):262-271.

