羊栖菜生物炭对镉污染土壤性质及镉形态的影响
汪玉瑛 ,计海洋 ,吕豪豪 ,刘玉学 ,杨瑞芹 ,杨生茂 ,3*
(1.浙江省农业科学院环境资源与土壤肥料研究所,杭州 310021;2.浙江省生物炭工程技术研究中心,杭州 310021;3.浙江师范大学化学与生命科学学院,浙江 金华 321004;4.浙江省农业生物资源生化制造协同创新中心,杭州 310023;5.浙江省农产品化学与生物加工技术重点实验室,杭州 310023)
土壤是人类赖以生存的主要自然资源。然而,目前土壤重金属污染日益严重。土壤重金属污染的范围广、持续时间长,而且隐蔽性强、无法被生物降解[1]。镉(Cd)是毒性最强的重金属元素之一,土壤Cd污染也已经成为突出的环境问题。被Cd污染的土壤会影响作物正常生理代谢,进而通过食物链的富集影响人类的健康。近年来,我国重金属Cd污染事故频发,例如,2006年的湖南省浏阳市Cd污染事故,2012年广西河池龙江河Cd污染事件等[2]。因此,为了环境可持续发展,合理有效地控制和治理土壤中Cd污染已经成为环境治理工作的重中之重。目前,治理污染土壤的方法主要是原位修复法。原位修复法虽然只能改变重金属在土壤中的存在形态,但是其具有快速、经济有效、便于实施等优点,适合修复大面积重金属污染的土壤,能够很好地满足当前我国土壤重金属污染以及保障农产品安全的要求。而选择一种合理的钝化剂,通过吸附、螯合、沉淀、氧化还原等作用改变土壤中重金属的形态,降低重金属的生物有效性是污染土壤原位修复法中的一种重要的思路和方法。目前常用的土壤钝化剂有石灰、泥炭、沸石、粘土矿物、绿肥和动物粪便等。
生物炭(Biochar,BC)是一类新型环境功能材料,是指由生物质如农业废弃物等在完全或部分缺氧的情况下高温热解产生的一类高含碳量的芳香化物质[3]。生物炭具有性质稳定、比表面积大、孔隙丰富、表面能高、吸附性强等特点[4],是理想的固碳减排新材料。而且,生物炭表面带有很多的含氧官能团如羧基、酚羟基、羰基等[5],构成了其良好的吸附特性。因此,生物炭在吸附固定土壤重金属、降低土壤重金属的生物有效性等方面有着很好的应用潜力。近年来,利用生物炭提高土壤肥力、降低土壤污染等研究已受到广泛关注。另外,很多废弃物均能作为制备生物炭的原材料,如秸秆、果壳、动物粪便、污泥等,制备原料来源广泛。然而,受到原材料、制备工艺、热解条件等限制,不同生物炭在结构及性质(比表面积、pH、灰分等)方面有着较大的差异,因此具有不同的环境效应及应用[6]。然而,目前制备生物炭的原材料以农林废弃物为主,对以海洋生物质作为原材料制备生物炭的研究较少。而且,虽然生物炭对土壤Cd污染的修复作用和机理方面的研究受到极大的关注,但是大部分针对土壤Cd污染的研究主要是通过在土壤中添加外源Cd的方式而开展,对实际Cd污染土壤的直接钝化研究较少,生物炭施入土壤后对土壤环境性质和Cd形态变化的影响还不清楚,亟待加强相关的理论和应用技术研究。
本研究分别以海洋生物质(羊栖菜)、农林废弃物(水稻秸秆、山核桃壳)为原料,用限氧热解法在500℃下制备了三种生物炭,并比较了三种生物炭对水溶液中Cd的吸附效果,从而优选出对Cd吸附最佳的生物炭。采用元素分析仪、红外光谱仪、扫描电镜、热重分析仪和比表面积分析仪等表征最佳生物炭的组成与结构。针对夏色岭钨矿区Cd污染土壤,设计不同用量的生物炭处理,研究生物炭添加量对实际污染土壤中Cd的钝化修复效果。对培养后土壤的基本理化性质和土壤Cd的形态进行分析,探讨生物炭钝化修复重金属污染土壤的可行性,试图为高效利用废弃资源、重金属污染土壤修复新方法的建立提供科学依据,同时为海洋生物质处置开辟新途径。
1 材料与方法
1.1 实验材料
供试土壤采自夏色岭钨矿,位于浙江省临安市河桥镇学川村,采样深度为0~20 cm。土壤采集带回,去除杂物如植物根系、石块等,风干,磨碎后过10目筛混匀备用。供试土壤的基本理化性质为:pH值5.77,有机质 32.40 mg·kg-1,有效磷 23.19 mg·kg-1,全氮1.54 g·kg-1,速效钾 147.8 mg·kg-1。
供试生物炭原料羊栖菜取自浙江省温州市洞头,山核桃壳和水稻秸秆由浙江省农业科学院提供。原材料用自来水洗净、自然风干后置于自封袋中待用。
1.2 生物炭的制备
生物质炭化采用限氧控温炭化法,原料羊栖菜/山核桃壳/水稻秸秆疏松地装入开启式可编程管式炉(杭州蓝天仪器有限公司)中在500℃隔绝氧气炭化,升温速率为25℃·min-1,达到500℃后持续炭化3 h,待管式炉自然冷却至室温后取出生物炭称重,计算产率。将炭化产物放入80℃烘箱烘24 h,研磨并分别过10目和100目筛,置于自封袋放入干燥器中保存备用,所获得的生物炭分别标记为:Y500(羊栖菜炭),H500(山核桃炭),S500(水稻秸秆炭)。
1.3 Cd储备液的配制
准确称取 CdCl2·2.5H2O(分析纯)2.031 4 g于烧杯中,加入适量去离子水搅拌至完全溶解,转移入1000 mL的容量瓶中定容,即为1000 mg·L-1的Cd2+储备液,室温保存。待用时根据实验需要进行稀释。
1.4 生物炭理化性质表征
准确称取0.500 0 g水稻秸秆炭、山核桃壳炭和羊栖菜炭分别溶于10 mL去离子水中,振荡10 min后过滤,使用pH计(Mettler Toledo FE28)测定滤液的pH,即为三种生物炭的pH。生物炭灰分的测定是将三种生物炭置于恒质量的坩埚中称质量后分别放入马弗炉在800℃下敞口煅烧2 h至恒质量,冷却后称质量计算灰分。用CHNS元素分析仪(vario ISOTOPE CUBE)测定三种生物炭样品的C、H、N和S含量,并经灰分校正后得出O元素的含量。比表面积用BET法通过比表面积测定仪(ASAP2020)测定。生物炭的表面形貌和官能团结构通过扫描电镜(JSM-6700F)、傅里叶变换红外光谱仪(Nicolet iS10)及热重分析仪(TGA Q50)进行分析。
1.5 吸附实验
将 Cd2+储备液分别稀释至 25、50、100、300、500 mg·L-1,分别调节不同浓度的Cd2+溶液pH值至7。准确称取0.05 g的Y500、H500及S500分别置于100 mL锥形瓶中,并分别加入调节好pH的Cd2+溶液50 mL,在25℃、150 r·min-1下的摇床中振荡24 h后过滤,测定滤液中Cd2+的浓度,并计算得生物炭对Cd2+的去除率。
实验设置3个平行,结果取平均值。滤液中的Cd2+浓度采用等离子体原子发射光谱(ICP-AES,Prodigy)测定,并计算吸附量和去除率。计算方法如下:

式中:qe为吸附量,mg·g-1;C0为 Cd 溶液的初始质量浓度,mg·L-1;Ce为滤液中 Cd 溶液的质量浓度,mg·L-1;V为Cd溶液体积,mL;m为称取的生物炭质量,mg;U为Cd去除率,%。
1.6 盆栽试验
将10目筛的风干供试土壤装盆,每盆500 g,然后将优选出的具有最大Cd吸附量的生物炭按质量百分比1%、2%、5%的添加量加入盆中,充分混合,调节含水量为田间最大持水量的60%。同时,以未添加生物炭的原污染土壤作为空白对照(CK)。试验共设置4个处理,每个处理设置3个重复。每隔1 d用去离子水给土壤补充水分,保持在田间持水量的60%左右。室温下培养60 d后取样分析培养后土壤理化性质及其中重金属Cd的化学形态。
1.7 土壤理化性质测定
土壤pH值采用去离子水提取,pH计(Mettler Toledo FE28)测定(土水比 1∶2.5)。土壤有效磷采用碳酸氢钠浸提-钼锑抗比色法测定。速效钾采用乙酸铵浸提-火焰光度计法测定。土壤有机质采用重铬酸钾氧化-外加热法测定。土壤全氮采用凯氏蒸馏法测定。
土壤Cd形态分级研究采用Tessier逐级提取方法,将Cd的化学形态分为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态、残渣态[7]。各分级的Cd含量均由等离子体原子发射光谱仪(ICP-AES,Prodigy)测定。
1.8 数据处理
实验数据使用Excel 2013进行平均值的运算,使用DPS 7.5进行单因素方差分析,用LSD法比较处理间的差异显著性(P<0.05),使用Origin 8.0软件作图。
2 结果与讨论
2.1 不同种类生物炭性质表征
不同生物质原材料制备的生物炭的组成和性质具有较明显的差异,羊栖菜炭、山核桃壳炭、水稻秸秆炭的质量组成、产率、灰分列于表1。从表1可以看出,炭产率和灰分含量均为羊栖菜炭>水稻秸秆炭>山核桃炭。说明羊栖菜炭中可能含有较大的矿物质。另外,用元素分析仪测定了三种生物炭的元素组成,以各元素的原子比如O/C、H/C原子比等解释生物炭的性质。其中,O/C、(N+O)/C原子比可表征生物炭的极性大小,其值越大则极性越大。而H/C原子比则可表征生物炭的芳香性大小,其值越小则芳香性越高[8]。由表1可知,H/C和O/C均为羊栖菜炭>水稻秸秆炭>山核桃炭,表明羊栖菜炭的极性>水稻秸秆炭>山核桃炭,而芳香性为山核桃炭>水稻秸秆炭>羊栖菜炭。这些性质将会影响这三种生物炭对重金属Cd的吸附性能。

表1 生物炭的基本理化性质Table1 Basic physicochemical properties of biochar
2.2 不同种类生物炭对重金属Cd的吸附性能研究
不同种类生物炭在不同的初始浓度下对Cd2+的去除率的影响及变化规律如图1所示。从图1中可以看出,当Cd初始浓度为10~200 mg·L-1时,三种生物炭对Cd2+的吸附量均随着Cd初始浓度的升高而增加。当Cd初始浓度大于200 mg·L-1时,山核桃壳炭对Cd2+吸附量趋于稳定。而水稻秸秆炭和羊栖菜炭对Cd2+的吸附量在Cd初始浓度大于300 mg·L-1时趋于稳定。这是由于生物炭表面的吸附位点是有限的,当吸附位点未被占满时,吸附量就会持续增大,而当生物炭表面吸附位点达到饱和时,对Cd2+吸附量趋于稳定。而且,羊栖菜炭对Cd的吸附性能明显优于水稻秸秆炭和山核桃炭(图1)。另外,选用的羊栖菜易种植,产量高,因此可以作为炭化原材料,进一步拓展生物炭制备材料范围及领域,并探明其应用于土壤重金属修复的潜力与前景。因此,本实验选择羊栖菜炭进行详细的表征并用于随后的盆栽实验。

图1 Cd初始浓度对不同生物炭材料吸附Cd2+的影响Figure1 Effect of initial concentration of Cd on the removal of Cd2+by different biochars

图2 羊栖菜生物炭样品扫描照片(a×2000倍,b×15 000倍)Figure2 Scanning electron microscopy(SEM)images of biochar(a×2000 times,b×15 000 times)
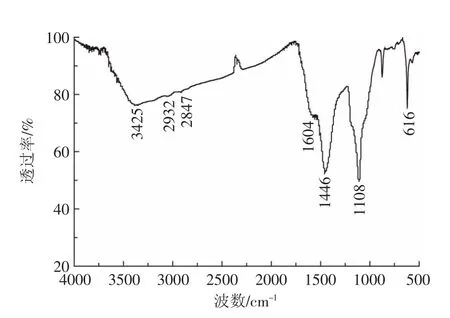
图3羊栖菜炭样品的红外光谱图Figure3 Fourier transform infrared(FT-IR)spectrum of biochar
2.3 羊栖菜炭理化性质表征
图2 为500℃条件下获得的羊栖菜炭的扫描电镜图。从图2可以看出,羊栖菜炭表面粗糙,而且表面及断面有一定的无序的孔隙,这进一步加剧了羊栖菜炭表面的粗糙程度。这是由于羊栖菜原料受热后,大量能量从内部释放出来,将原料内部孔道冲开,使得羊栖菜炭的孔道分布呈现无序状态,进而增加了羊栖菜炭表面粗糙程度,导致羊栖菜炭具有较好的重金属吸附性能。
进一步对羊栖菜炭表面官能团结构进行表征,图3为羊栖菜炭样品的红外光谱图。图中3425 cm-1处出现的宽峰可指标化为羟基-OH的特征吸收峰,这些羟基可能来源于有机物中的碳水化合物[9]。2932cm-1和2847 cm-1处的吸收峰分别为-CH2的C-H反对称伸缩振动及-CH3和-CH2的C-H对称伸缩振动[10],这些基团主要来自于有机物中的碳水化合物、脂肪族化合物和脂环族化合物等。1604 cm-1处的吸收峰是芳香环中C=C,C=O的伸缩振动以及-COO-的反对称伸缩振动。1446 cm-1处的吸收峰为碳水化合物和脂肪族化合物中-CH2基团的剪式变形振动及脂肪族和木质素中-CH3的C-H的不对称变形振动。1108 cm-1是碳水化合物中C-O的伸缩振动[11]。因此,从羊栖菜炭的红外谱图可知获得的羊栖菜炭是富含有机官能团的,而这些官能团将在吸附重金属Cd2+的过程中发挥着至关重要的作用。
图4为羊栖菜炭样品的热重分析图。由该图可见,热重(TG)曲线共出现三个失重,从室温到200℃的质量损失约为4 wt%,这可以认为是样品表面少量的吸附水的蒸发。TG曲线上第二个明显的失重台阶(约15 wt%)可被认为是纤维素等有机质的去除。从600~1000℃之间的热失重对应于木质素的热分解过程。因此,热重分析表明,羊栖菜炭样品中含有一定量的有机质,这与红外光谱图中羊栖菜炭中含有有机官能团的结果是相一致的。
羊栖菜炭样品氮气吸附脱附等温线和孔径分布曲线分别如图5所示。由图5A可知,羊栖菜炭的吸附/脱附滞后循环主要出现在0.5~1.0 P/Po,且等温线显示出IV型,具有H3滞后回线,说明羊栖菜炭样品具有介孔结构[12]。此外,从等温线的吸附分支可获得样品的孔径分布曲线(图5B)。由图5B可知,羊栖菜炭样品的孔径分布在20 nm出现峰值,进一步说明羊栖菜炭具有一定的孔隙,这与扫描电镜结果是相一致的。500℃下获得的羊栖菜炭样品的比表面积为2.73 m2·g-1,平均孔径为 13.23 nm。

图4 羊栖菜炭热重分析图Figure4 The rmogravimetry(TG)curve of biochar

图5 羊栖菜炭氮气吸附解析等温线谱图(a)和孔径分布图(b)Figure5 Nitrogen adsorption-desorption isotherms(a)and pore size distributions(b)of biochar

图6 羊栖菜炭添加量对污染土壤pH的影响Figure6 Effect of biochar dosage on the pH of polluted soil
2.4 添加羊栖菜炭后污染土壤性状与土壤Cd化学形态分析
2.4.1 添加羊栖菜炭对污染土壤pH值的影响
经测定,采样原污染土壤的pH显弱酸性(pH 5.28),将羊栖菜炭添加入土壤中,由图6所示,不同羊栖菜炭添加量均能显著提高土壤的pH值,且随着羊栖菜炭添加量的增加呈升高趋势,羊栖菜炭施加的量越多土壤的pH更接近中性。添加1%、2%、5%的羊栖菜炭的污染土壤的pH值在较对照分别升高了0.30、0.78和1.61。这是由于生物炭灰分中有不同浓度碱性物质,如 K、Ca、Na、Mg的氧化物、氢氧化物、碳酸盐等[13],施入土壤可以提高土壤盐基饱和度,降低可交换铝水平,从而提高土壤pH值。因此,添加羊栖菜炭可显著增加土壤pH值,对于防治土壤酸化方面具有一定效果。而且,土壤的pH值对土壤中重金属的吸附-解吸、沉淀-溶解平衡、迁移和有效性等有着重要的影响。本实验中,羊栖菜炭的施加导致污染土壤pH值升高,使Cd通过络合、沉淀等作用被固定下来[14],因此,羊栖菜炭有望作为土壤钝化剂固定污染土壤中的重金属Cd。
2.4.2 添加羊栖菜炭对污染土壤有效磷的影响
图7为添加不同添加量羊栖菜炭对污染土壤有效磷的影响。从图7可以看出,不同添加量的羊栖菜炭对污染土壤中有效磷含量的影响较大,与对照相比,土壤有效磷均有显著增加,分别增加了100.1%、327.4%和652.7%。因此,羊栖菜炭的添加可以显著提高土壤有效磷的含量。这一方面与羊栖菜炭本身较高的有效磷含量有关,另一方面羊栖菜炭能够固定重金属,从而将重金属固定的磷元素释放,导致有效磷含量升高。而且,羊栖菜炭对磷有一定的吸附。有报道指出,生物炭表面不仅带有负电荷,也有一定的正电荷,因而可以吸附有机质不能吸附的磷[15]。例如,Laird等[16]研究发现,在土壤中添加2%的生物炭能够有效降低土壤可溶性磷流失,减幅达69%。本实验中,羊栖菜炭一方面能够通过减少磷素养分的溶解避免其流失,另一方面羊栖菜炭可通过对磷的吸附,成为磷素养分的缓释载体,使磷素在土壤中持续而缓慢地释放,因此能够保持土壤肥力。另外,羊栖菜炭的多孔结构可以为土壤中的微生物尤其是细菌提供一个良好的环境,通过微生物矿化和溶解有机磷和无机磷,从而使这些磷可被作物利用和吸收[17]。因此,添加羊栖菜炭可以显著增加土壤有效磷含量。
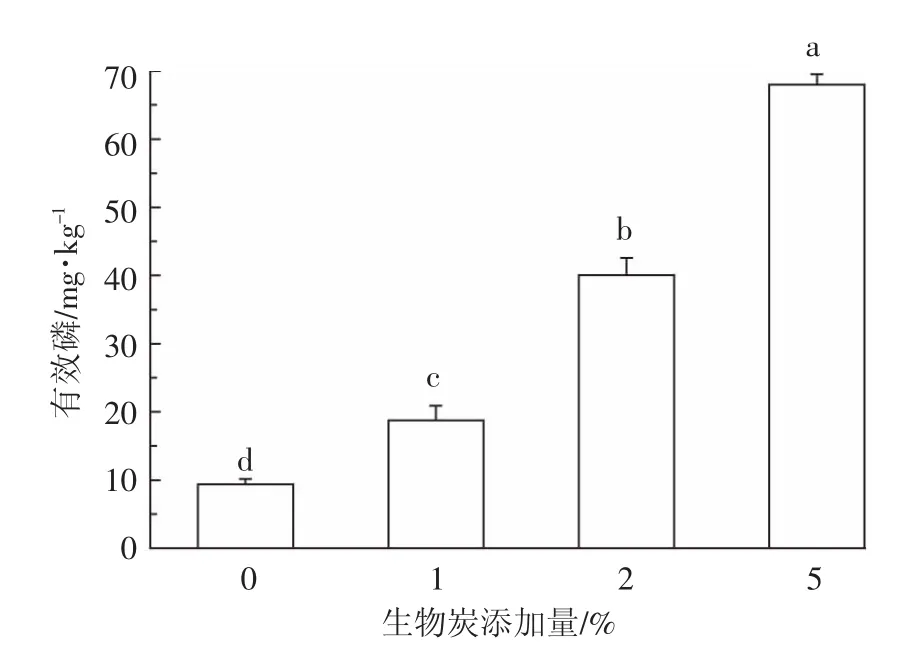
图7 羊栖菜炭添加量对污染土壤有效磷的影响Figure7 Effect of biochar dosage on the available phosphorus content of polluted soil

图8 羊栖菜炭添加量对污染土壤速效钾的影响Figure8 Effect of biochar dosage on the rapidly available potassium content of polluted soil
2.4.3 添加羊栖菜炭对污染土壤速效钾的影响
从图8可以看出,施用羊栖菜炭对土壤速效钾含量有明显影响。对照处理土壤中的速效钾为108.7 mg·kg-1,而添加1%、2%、5%的羊栖菜炭后土壤中速效钾含量分别为 401.6、403.5 mg·kg-1和 400.2 mg·kg-1。与对照相比,添加不同量羊栖菜炭处理均显著提高了土壤速效钾含量,较对照增幅达269.5%~271.2%。添加羊栖菜炭与对照处理相比有显著性差异,而不同羊栖菜炭添加量处理之间差异不显著。表明羊栖菜炭对污染土壤速效钾含量具有良好的提升作用,这是由于羊栖菜炭表面带有较多的官能团及较大的比表面积,具有较强的吸附性能,可将钾吸附在表面,不易流失。而羊栖菜炭用量对污染土壤速效钾含量提升作用不明显,是因为羊栖菜炭对阳离子钾离子的吸附强,较少的羊栖菜炭量即能很好地固定土壤中的钾。因此可以综合其他因素,判断羊栖菜炭添加量。
2.4.4 添加羊栖菜炭对污染土壤全氮的影响
添加羊栖菜炭对污染土壤全氮的影响如图9所示。从图9可以看出,与对照处理相比,不同羊栖菜炭添加量处理的土壤全氮含量增幅分别达8.76%、21.90%、28.47%。统计结果表明:添加1%的羊栖菜炭处理与对照相比无显著性差异,说明施用少量羊栖菜炭对污染土壤全氮的含量无明显影响。当羊栖菜炭添加量达到2%以上时,污染土壤全氮含量随羊栖菜炭添加量的增加而升高,且与对照相比差异显著。这是由于羊栖菜炭的施用可降低氮素淋失,而且土壤中的微生物能够改善土壤通气状况、抑制氮素微生物的反硝化作用从而减少了NOx的形成和排放[18],使得土壤中全氮储量增加。而添加少量的羊栖菜炭未能显著提高土壤全氮含量。因此,在实际农业生产过程中,添加羊栖菜炭量应至少达到2%以上才能实现提高土壤全氮的目的。
2.4.5 添加羊栖菜炭对污染土壤有机质的影响
添加羊栖菜炭对污染土壤有机质的影响如图10所示。与不添加羊栖菜炭的对照(CK)相比,添加不同含量的羊栖菜炭均能显著提高污染土壤的有机质含量。而不同羊栖菜炭添加量对土壤有机质的影响存在较大的差异,随着羊栖菜炭添加量的增加土壤有机质含量升高。添加1%、2%、5%的羊栖菜炭处理的土壤比对照组分别提高51.55%、55.01%和78.07%,差异达显著性水平。添加1%和2%的羊栖菜炭的土壤有机质处理之间无显著性差异,当羊栖菜炭添加量达5%时,土壤有机质含量较添加1%和2%的羊栖菜炭处理有显著提高。已有研究表明,生物炭的施加对土壤有机质含量有显著提高作用,且提高的幅度与生物炭的使用量及性质如稳定性有着密切的关系[19]。本实验中,羊栖菜炭能显著提高污染土壤有机质水平,一方面是由于羊栖菜炭本身的有机质含量较高,另一方面可能是由于羊栖菜炭能通过促进形成土壤有机-矿质复合体形成,提高团聚体稳定性进而减少有机质淋失[20-21]。

图9 羊栖菜炭添加量对污染土壤全氮的影响Figure9 Effect of biochar dosage on the total nitrogen content of polluted soil
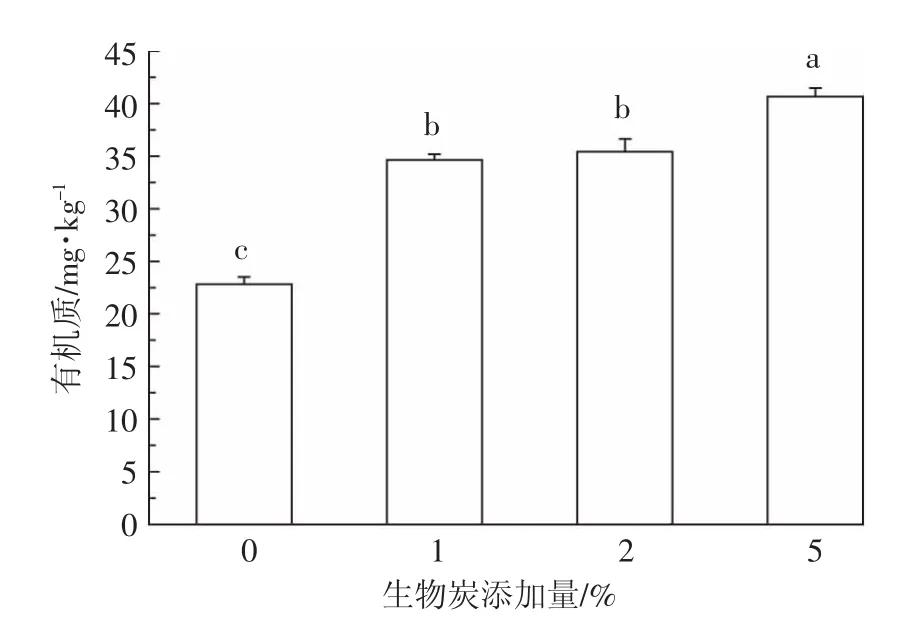
图10 羊栖菜炭添加量对污染土壤有机质的影响Figure10 Effect of biochar dosage on the organic content of polluted soil

图11 羊栖菜炭对污染土壤重金属Cd形态的影响Figure11 Effect of biochar dosage on the Cd speciation of polluted soil
2.5 添加羊栖菜炭后污染土壤Cd化学形态分析
大量试验证明,土壤中重金属的总量及化学形态与其环境行为、生物有效性及毒性是密切相关的[22]。土壤中的Cd主要以交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态及残渣态5种形态存在。而且,不同形态Cd的生物有效性大不相同,其中交换态Cd迁移性强,易被作物直接利用;而碳酸盐结合态Cd、铁锰氧化物结合态Cd为潜在可利用态,有机结合态Cd和残渣态Cd为不可利用态,不能被作物利用,因此迁移性小。当总Cd含量相同时,交换态Cd含量越低其生物有效性也更低;相反,当总Cd含量相同时,碳酸盐结合态、铁锰氧化物结合态、有机结合态及残渣态4种形态Cd含量越高,其生物有效性也越低。由图11可知,与未添加生物炭的对照处理相比,施加羊栖菜炭导致土壤交换态Cd含量明显下降,碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态Cd含量均增加。污染土壤经过30 d的培养后,与对照处理相比,施加1%、2%、5%羊栖菜炭处理可交换态Cd含量由5.20 mg·kg-1分别减少至2.92、1.94、3.05 mg·kg-1。因此,各个处理均显著降低了土壤交换态Cd含量。碳酸盐结合态Cd含量由0.30 mg·kg-1分别增加至 0.83、1.05、0.91 mg·kg-1;铁锰氧化物结合态Cd含量由2.59 mg·kg-1分别增加至3.86、4.71、3.82 mg·kg-1;有机结合态 Cd 含量由 0.76 mg·kg-1分别增加至 0.95、1.33、0.94 mg·kg-1;残渣态 Cd含量由 1.20 mg·kg-1分别增加至 1.96、2.47、1.94 mg·kg-1。不同羊栖菜炭添加量处理对土壤Cd含量影响差异不同,与对照相比,交换态Cd含量显著下降,而碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态Cd含量显著上升。这是由于羊栖菜炭具有较高的比表面积和孔隙度,当其施入污染土壤之后可以通过表面吸附作用固定重金属Cd。另外,土壤溶解-沉淀、吸附-解吸等反应受到pH的影响较大[23],进而影响重金属生物有效性。本实验中,羊栖菜炭本身具有较高的pH值,其施加到污染土壤后,导致污染土壤pH升高(图6)、土壤表面胶体所带负电荷增加,促进了Cd2+与土壤中的碳酸根反应生成碳酸盐沉淀。土壤中铁锰氧化物为两性胶体,对重金属的吸附主要取决于表面负电荷,而羊栖菜炭的加入提高了土壤的pH值,使土壤溶液中 H+、Fe3+、Al3+、Mn2+等浓度减小,与重金属Cd竞争吸附减弱,形成的铁锰氧化物进一步增强了对Cd2+的吸附。因此,加入羊栖菜炭后土壤的pH随之升高,致使碳酸盐结合态Cd和铁锰氧化物结合态Cd升高。另外,由红外光谱图(图3)可知,羊栖菜炭富含大量的含氧官能团,如羧基、羟基等,这些羧基和羟基官能团通过络合或螯合作用与土壤溶液中的Cd2+反应形成难溶性络合物,从而改变了土壤对Cd2+的吸附能力[24]。因此,土壤中的有机质与Cd2+结合更紧密,进一步导致可交换态Cd含量降低。综上所述,添加羊栖菜炭能促进土壤重金属Cd由交换态向碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态转化,降低重金属Cd的生物有效性和生态毒性,从而大幅降低重金属Cd的危害。而且,不同羊栖菜炭添加量对土壤Cd形态的影响不同,羊栖菜炭施用量为2%时,交换态Cd含量降幅最大,碳酸盐结合态、铁锰氧化物结合态、有机结合态Cd形成最多,效果最佳。因此,在施用羊栖菜炭改良重金属Cd污染土壤过程中,可根据不同生物炭添加量对土壤Cd形态的影响特点,合理选择炭添加量获得最佳改良效果。
3 结论
(1)制备的三种生物炭中羊栖菜炭对重金属Cd的吸附效果最佳。
(2)污染土壤添加羊栖菜炭后可以明显提高污染土壤pH、有效磷、速效钾、全氮和有机质含量,而且随羊栖菜炭添加量增加而增大。
(3)不同量的羊栖菜炭的施入均显著降低了土壤有效态Cd含量,促使土壤重金属Cd由交换态向碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态转化。羊栖菜炭施用量为2%时,交换态Cd含量降幅最大,碳酸盐结合态、铁锰氧化物结合态、有机结合态Cd形成最多,效果最佳。
[1]Bozkurt S,Moreno L,Nerenieks I.Long term processes in waste deposits[J].Science of the Total Environment,2000,250(1):101-121.
[2]黄益宗,郝晓伟,雷 鸣,等.重金属污染土壤修复技术及其修复实践[J].农业环境科学学报.2013,32(3):409-417.
HUANG Yi-zong,HAO Xiao-wei,LEI Ming,et al.The remediation technology and remediation practice of heavy metals-contaminated soil[J].Journal of Agro-Environment Science,2013,32(3):409-417.
[3]Sun Y,Gao B,Yao Y,et al.Effects of feedstock type,production method,and pyrolysis temperature on biochar and hydrochar properties[J].Chem Eng J,2014,240(6):574-578.
[4]Cornelissen G,Gustafsson Örjan,Bucheli T D,et al.Extensive sorption of organic compounds to black carbon,coal and kerogen in sediments and soils:Mechanisms and consequences for distribution,bioaccumulation,and biodegradation[J].Environmental Science&Technology,2005,39(18):6881-6895.
[5]Chen T,Zhou Z Y,Xu S,et al.Adsorption behavior comparison of trivalent and hexavalent chromium on biochar derived from municipal sludge[J].Bioresource Technology,2015,190:388-394.
[6]Cantrell K B,Hunt P G,Uchimiya M,et al.Impact of pyrolysis temperature and manure source on physicochemical characteristics of biochar[J].Bioresource Technology,2012,107:419-428.
[7]李非里,刘丛强,宋照亮,等.土壤中重金属形态的化学分析综述[J].中国环境监测,2005,21(4):21-27.
LI Fei-li,LIU Cong-qiang,SONG Zhao-liang,et al.A review of fractionation of heavy metals in soils[J].Environmental Monitoring in China,2005,21(4):21-27.
[8]李 力,陆宇超,刘 娅,等.玉米秸秆生物炭Cd(Ⅱ)的吸附机理研究[J].农业环境科学学报,2012(11):2277-2283.
LI Li,LU Yu-chao,LIU Ya,et al.Adsorption mechanisms of cadmium(Ⅱ)on biochars derived from corn straw[J].Journal of Agro-Environment Science,2012(11):2277-2283.
[9]Kuwatsuka S,Watanabe A,Itoh K,et al.Comparison of two methods of preparation of humic and fulvic acids,IHSS method and NAGOYA method[J].Soil Science and Plant Nutrition,1992,38(1):23-30.
[10]Gunasekara A S,Simpson M J,Xing B S.Identification and characterization of sorption domains in soil organic matter using structurally modified humic acids[J].Environmental Science&Technology,2003,37(5):852-858.
[11]Xiao X,Chen B,Zhu L.Transformation,morphology,and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures[J].Environmental Science&Technology,2014,48(6):3411-3419.
[12]Shi J Y,Wang Y Y,Yao Q Z,et al.Bio-inspired synthesis of silica rib-bons with through-holes[J].Colloids and Surfaces A:Physicochem Eng Aspects,2013,436(35):664-674.
[15]Lehmann J.Bio-energy in the black[J].Frontiers in Ecology and the Environment,2007,5(7):381-387.
[16]Laird D A,Fleming P,Davis D D,et al.Impact of biochar amendments on the quality of a typical midwestern agricultural soil[J].Geoderma,158(3):443-449.
[17]Deluca T H,MacKenzie M D,Gundale M J,et al.Biochar effects on soil nutrient transformations[M]//Biochar for Environmental Management:Science and Technology,London,UK:Earthscan,2009:251-270.
[18]Lehmann J,Gaunt J,Rondon M.Bio-char sequestration in terrestrial ecosystems:A review[J].Mitigation and Adaptation Strategies for Global Change,2006,11(2):403-427.
[19]武 玉,徐 刚,吕迎春,等.生物炭对土壤理化性质影响的研究进展[J].地球科学进展,2014,29(1):68-79.
WU Yu,XU Gang,LU Ying-chun,et al.Effects of biochar amendment on soil physical and chemical properties:Current status and knowledge gaps[J].Advances in Earth Science,2014,29(1):68-79.
[20]Glaser B,Lehmann J,Zech W.Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal:A review[J].Biology and Fertility of Soils,2002,35(4):219-230.
[21]Liang B,Lehmann J,Sohi S P,et al.Black carbon affects the cycling of non-black carbon in soil[J].Organic Geochemistry,2010,41(2):206-213.
[22]关天霞,何红波,张旭东,等.土壤中重金属元素形态分析方法及形态分布的影响因素[J].土壤通报,2011,42(2):503-512.
GUAN Tian-xia,HE Hong-bo,ZHANG Xu-dong,et al.The methodology of fractionation analysis and the factors affecting the species of heavy metals in soil[J].Chinese Journal of Soil Science,2011,42(2):503-512.
[23]Martínez C E,Motto H L.Solubility of lead,zinc and copper added to mineral soils[J].Environmental Pollution,2000,107(1):153-158.
[24]王 风,王梦露,许 堃,等.生物炭施用对棕壤重金属镉赋存形态及油菜吸收镉的影响[J].农业环境科学学报,2017,36(5):907-914.
WANG Feng,WANG Meng-lu,XU Kun,et al.Effects of biochar application on cadmium transformation in brown soil and uptake by baby bokchoi[J].Journal of Agro-Environment Science,2017,36(5):907-914.

