肺泡上皮钠离子通道在急性肺损伤模型差异表达的研究
张俊志,张中军,赵 雷,蔡兴涛,李 莹,崔媛媛
(深圳市人民医院·暨南大学第二临床学院 麻醉科,广东 深圳518020)
肺泡上皮细胞的主要功能是维持肺泡液体的动态平衡,促进肺泡多余液体的清除,从而提供最佳的气体交换功能[1]。然而,在急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)过程中,肺泡-毛细血管屏障受损,使得肺泡液体增多,并造成肺泡液体清除功能下降,导致严重的气体交换障碍[2]。钠离子在肺泡上皮细胞的转运促使了肺泡液的转运,是肺水肿液清除的主要驱动力[3]。肺泡上皮钠离子通道(ENaC)分布于细胞膜顶端,由3种亚型(α、β、γ)构成,调控钠离子的转运,在肺泡水肿液体的清除过程中发挥重要作用[4]。
本研究选择3种急性肺损伤实验模型即脂多糖(LPS)诱导、盐酸(HCl)诱导和机械通气(VILI)引起的肺损伤,对钠离子通道(ENaC)3种亚型(α、β、γ)的作用,从而反映不同急性肺损伤的共同潜在原因,为促进肺泡水肿液清除和治疗肺损伤提供依据。
1 材料与方法
1.1 实验动物与试剂
40只雄性SD大鼠由广东省医学实验动物中心提供;脂多糖(LPS)购自美国Sigma公司;小动物呼吸机(型号R407)购自中国瑞沃德公司;总RNA提取试剂盒购自美国Invitrogen公司;qRT-PCR试剂盒购自美国Thermofisher Scientific公司;Western blot检测试剂盒购自美国Upstate Biotechnology公司。
1.2 实验动物分组及急性肺损伤模型制作
清洁级雄性 SD 大鼠 40只,体质量 220-240 g,随机分为4组(n=10)。对照组(Control组)于气管内滴注2 ml/kg生理盐水,24 h后处死;脂多糖诱导组(LPS组,n=10)气管内滴注5 mg/kg 脂多糖,24 h后处死;盐酸诱导组(HCL组,n=10)气管内滴注2 ml/kg盐酸(pH=1.8),24 h后处死;机械通气组(VILI组,n=10)采用小动物呼吸机,使用25 ml/kg的高潮气量和50次呼吸/分钟的呼吸率对大鼠进行通气,机械通气4 h后将大鼠处死。
1.3 支气管肺泡灌洗液(broncho-alveolar lavage fluid,BALF)蛋白浓度和白细胞计数
各组处死大鼠后立即开胸取肺,切开右肺主支气管,插入外径为1.8 mm的气管插管软管固定,左肺结扎,用每份3 ml磷酸盐缓冲盐水(PBS)连续灌洗右肺3次,并回收灌洗液,最后将回收BALF合并,取出80 μl BALF,离心染色并进行白细胞计数。将剩余的BALF,4℃以1 500 r/min离心20 min,取上清液储存在-80℃冰箱保存,用于测定蛋白浓度。
1.4 实时定量PCR(qRT-PCR)检测钠通道各亚型mRNA的表达
取左肺肺组织,按总RNA提取试剂盒说明进行操作,用分光光度法在260和280 nm测定总RNA浓度和质量,同时用甲醛琼脂糖凝胶电泳评估RNA完整性,将总RNA保存在-80℃。实时定量PCR分析采用qRT-PCR试剂盒和荧光染料掺入法进行,按试剂盒说明进行操作,用于扩增GAPDH(内源参照基因)以及不同的ENaC靶基因mRNA序列,根据美国Thermofisher公司生物技术信息序列数据库和程序的信息设计基因特异性引物组,引物序列如表1。参照说明,在95℃孵化30 s后,再以95℃10s PCR循环35次,60 ℃20 s和72℃20 s,最后β-Actin或GAPDH为内参,熔解曲线分析。

表1 引物序列
1.5 Westen-bolt法检测钠通道各亚型蛋白的表达
取左肺组织加1 ml裂解液,然后12 000 r/min 4℃离心2 min,取少量上清Lowry 法测定总蛋白量。每孔蛋白加样量为20 μg,通过80-100V电泳,然后转移到PVDF膜在100V在冷水浴1 h。PVDF膜与PBS含BSA封闭1 h,并孵育抗体(1∶1 000)在4℃,PVDF膜过夜,用PBST洗涤3次,再与HRP标记的二抗孵育(1∶10 000)在37℃ 1 h,与PBST洗3次后,按Western blot检测试剂盒说明进行快速孵育,最后用化学发光法显影,将胶片进行扫描或拍照,用凝胶图象处理系统分析目标带的分子量和净光密度值。
1.6 统计学处理
2 结果
2.1 BALF蛋白浓度和白细胞计数结果
与Control组比较,LPS组、HCL组和VILI组BALF蛋白浓度和白细胞计数均显著升高,差异均有统计学意义(P<0.05),见表2。
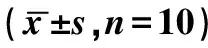
表2 BALF蛋白浓度和白细胞计数
注:与对照组比较aP<0.05
2.2 qRT-PCR检测mRNA的表达结果
与Control组比较,α-ENaCmRNA表达在LPS组和HCL组中明显降低,差异有统计学意义(P<0.05),而α-ENaCmRNA表达在VILI组与Control组比较差异无统计学意义(P>0.05);β-ENaCmRNA表达各组比较差异无统计学意义(P>0.05);与Control组比较,γ-ENaCmRNA在VILI组表达明显降低,差异有统计学意义(P<0.05),而在LPS组和HCL组表达无明显变化,差异无统计学意义(P>0.05),见图1。
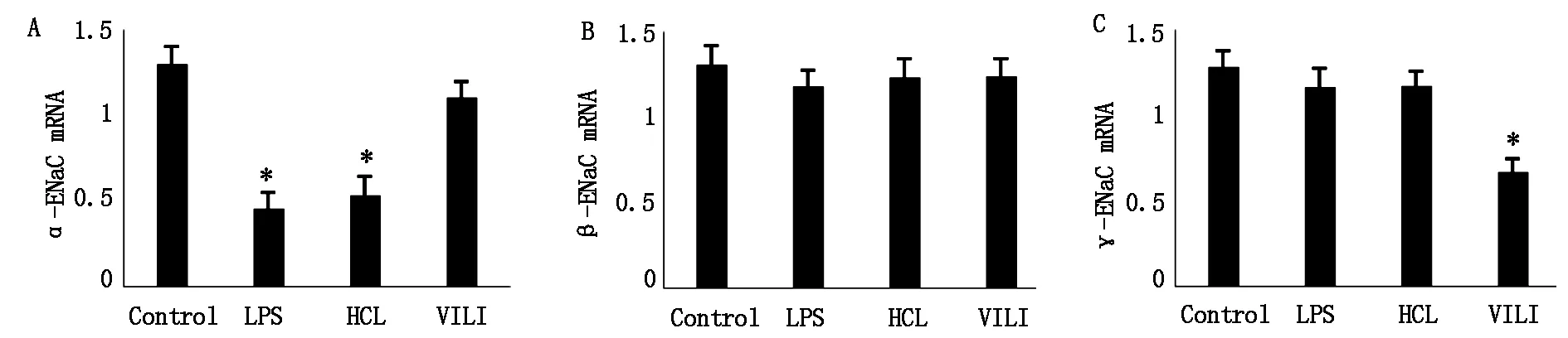
注:与Control组比较,*表示 P<0.05。
2.3 Westen-bolt法检测钠通道各亚型蛋白表达结果
与Control组比较,α-ENaC蛋白表达在LPS组和HCL组明显降低(P<0.05),而γ-ENaC蛋白表达在VILI组明显降低(P<0.05) ,见图2。
3 讨论
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是临床上常见的危重病症,其特征是弥漫性肺泡损伤,毛细血管通透性增加和凝血系统的强烈激活。ARDS诱发因素(如败血症、创伤、误吸和肺炎等)相当常见,但只有少数患者发展为综合征,这种差异性反应提示可以对ARDS易感性和预后的潜在因素进行研究。
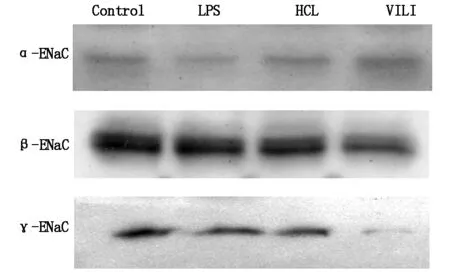
图2 ENaC各亚型蛋白表达(n=10)
阿米洛利敏感上皮钠通道(ENaC),在健康和疾病中发挥重要作用,在肾,结肠和肺中均有表达[5]。ENaC通过重吸收顶膜上的Na+参与维持适宜的盐和水平衡,从而形成促进液体重吸收的渗透梯度,Na+在肺泡上皮细胞的转运促使了肺泡液的转运,是肺水肿液清除的主要驱动力。ENaC调控Na+的转运,在肺泡水肿液体的清除过程中发挥重要作用[6-9]。ENaC由α,β和γ亚基组成,有研究表明,缺乏α-ENaC表达的新生小鼠由于无法清除肺泡内多余的液体,在出生后48 h 内死亡[10]。Mall等[11]发现,β-ENaC过度表达导致肺泡上皮Na+摄取增加,导致肺部脱水并引起肺囊性纤维化样变。Naomi等[12]研究人呼吸道上皮ENaCmRNA水平与细胞上皮基底部电位差(PD)之间的关系分析发现,PD 的降低与γ-ENaCmRNAs表达水平的升高存在相关关系,而α或β-ENaCmRNA的水平与PD 之间没有相关关系。
本研究结果显示3种急性肺损伤实验模型BALF蛋白浓度和白细胞计数均显著升高(P<0.05),提示3种模型均使肺泡壁通透性增加及气血屏障的完整性被破坏。本研究发现α-ENaCmRNA表达和蛋白的表达在LPS组和HCL组中明显降低(P<0.05),提示这两组损伤作用可能主要发生在肺泡上皮顶膜上Na+电导所必需的α亚基,损害肺泡上皮液体输送功能,导致肺泡液体清除作用降低。本研究还发现γ-ENaCmRNA表达和蛋白的表达在VILI组明显降低(P<0.05),提示高潮气量的机械通气损伤作用于可能是抑制了上皮细胞增强信号通路的γ亚基的表达。而β-ENaCmRNA表达和蛋白的表达在肺损伤实验模型中无明显变化(P>0.05),提示β亚基表达水平可能在肺损伤模型中不会降低。
本研究通过对3种急性肺损伤实验模型ENaC各亚基的检测,表明肺损伤具有靶向特异性调节基因和蛋白质表达,从而反映不同急性肺损伤的共同潜在原因,为促进肺泡水肿液清除和治疗肺损伤提供依据。
参考文献:
[1] Ware LB,Matthay MA.The acute respiratory distress syndrome[J].N Engl J Med,2000,342(18):1334.
[2]Matthay MA,Folkesson HG,Clerici C.Lung epithelial fluid transport and the resolution of pulmonary edema[J].Physiol Rev,2002,82(3):569.
[3]Ware LB,Matthay MA.Alveolar fluid clearance is impaired in the majority of patients with acute lung injury and the acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2001,63(6):1376.
[4]Vadasz I,Raviv S,Sznajder JI.Alveolar epithelium and Na,K-ATPase in acute lung injury[J].Intensive Care Med,2007,33(7):1243.
[5]Garty H,Palmer LG.Epithelial sodium channels:function,structure,and regulation[J].Physiol Rev,1997,77(1):359.
[6]Suzuki S,Koike K,Fujimura S.Impairment of transalveolar fluid transport and lung Na(+)-K(+)-ATPase function by hypoxia in rats[J].J Appl Physiol ,1999,87(3):962.
[7]Vadasz I,Hubmayr RD,Sznajder JI.Hypercapnia:a nonpermissive environment for the lung[J].Am J Respir Cell Mol Biol,2012,46(4):417.
[8]Zhou G,Dada LA,Sznajder JI.Regulation of alveolar epithelial function by hypoxia[J].Eur Respir J,2008,31(5):1107.
[9]Matalon S,Bartoszewski R.Collawn JF.Role of epithelial sodium channels in the regulation of lung fluid homeostasis[J].Am J Physiol Lung Cell Mol Physiol,2015,30(9):L1229.
[10]Hummler E.Early death due to defective neonatal lung liquid clearance in alpha-ENaC-deficient mice[J].Nat Genet,1996,12(7):325.
[11]Bjarki Johannesson,Stephanie Hirtz,Marcus A Mall.CFTR Regulates early pathogenesis of chronic obstructive lung disease in βENaC overexpressing mice[J].Plos one,2012,7(8):e44059.
[12]Naomi Niisato,Mariko Ohta,Douglas C.Hypotonic stress upregulates β- and γ-ENaC expression through suppression of ERK by inducing MKP-1[J].Am J Physiol Renal Physiol,2012,303(2):F240.

