降钙素原联合C反应蛋白在脊柱内固定术后感染早期诊断的临床意义
刘 键,陈 科,王先安,林明侠*,李明东
(海南省人民医院 1.脊柱外科;2.创伤骨科,海南 海口570311)
脊柱外伤、脊柱退行性疾病及脊柱肿瘤等的患者手术时间长,出血多,多数需要使用内固定材料,使脊柱手术的感染率较高,有文献报道感染率在0.3%-9%[1]。脊柱术后出现感染,将严重影响患者预后,轻者增加患者痛苦,延长住院时间及增加住院费用,严重者可危及生命。术后患者感染早期可能出现发热、切口渗液等先兆症状,但在术后应激状态、血肿吸收、切口脂肪液化等情况下亦可出现上述症状。目前感染诊断是在送检标本中培养出细菌、真菌等[2],但细菌培养的时间长,若等待培养结果再用药会延误感染治疗的最佳时机,造成严重后果;若患者术后一出现发热即使用抗菌药物治疗,不仅增加了患者经济负担,还扩大抗感染治疗指征,造成抗生素滥用。所以为了能够及时有效的治疗脊柱内固定术后感染患者,同时避免抗菌药物滥用,就需寻求一个在感染早期能敏感反应感染的指标。目前在临床中,常用监测感染的指标有C反应蛋白(CRP)、红细胞沉降率(ESR)、白细胞计数(WBC)等,近些年来,有很多文献[3-6]报道了降钙素原在感染患者诊断及监测中的应用,具有较高的准确度及灵敏性,但降钙素原运用在脊柱内固定术后感染的应用报道较少。本研究的目的是探讨降钙素原联合C反应蛋白在脊柱内固定术后感染早期诊断的临床意义。
1 资料与方法
1.1一般资料
选取 2016年1月-2017年6月在我院脊柱外科接受脊柱(颈椎、胸椎、腰椎) 内固定手术,并术后出现发热或切口渗液的患者60 例。排除标准:①脊柱感染性疾病患者;②术前合并有呼吸道、泌尿道或其他部位感染的患者。根据细菌培养结果分为感染组(26例)和对照组(34例)。两组患者在年龄、手术时间及术中失血量上的比较,差异无统计学意义(P>0.05)。见表1。
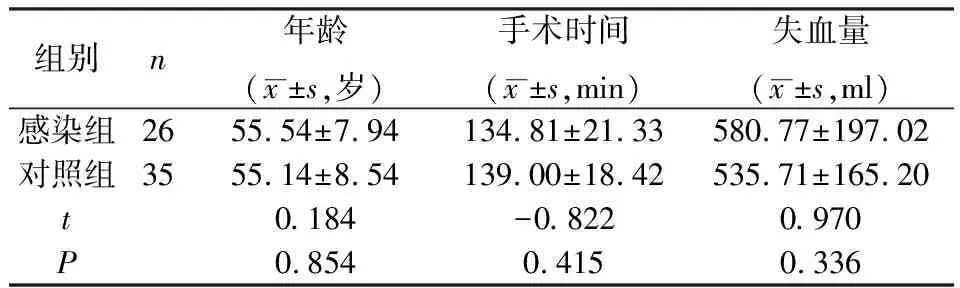
表1 感染组与对照组患者一般情况比较
1.2手术方法
所有病例由我院脊柱外科同一团队严格按照诊疗规范完成围手术期准备及手术,内置物为山东威高骨科材料有限公司生产的脊柱内固定材料。术前30 min预防性使用一次抗生素,入院时以及术后出现发热或切口渗液时抽血化验PCT、CRP、ESR、WBC。
1.3指标检测方法及仪器
PCT采用酶联免疫荧光法检测,由生物梅里埃VIDAS全自动免疫荧光酶标仪完成;CRP采用免疫比浊法检测,由雅培ARCHITECT C16000全自动生化分析仪完成;ESR采用毛细管动态光学检测法检测,由 ALIFAX Roller 20LC自动ESR分析仪完成;WBC采用核酸荧光染色法检测,由Sysmex XN-1000型全血细胞分析仪完成。4个感染监测指标的正常参考范围:PCT<0.5 ng/ml,CRP<8 mg/L,ESR<20 mm/h,WBC(4.0-10.0)×109/L。
1.4统计学分析
2 结果
2.1感染组术前 PCT、CRP、ESR、WBC与对照组术前 PCT、CRP、ESR、WBC差异均无统计学意义(P>0.05)。感染组术后PCT、CRP明显高于对照组术后PCT、CRP,差异有显著性(P<0.05),说明机体受到感染侵袭时PCT、CRP会明显升高,且升高的幅度要大于机体受到创伤应激反应时;而感染组术后ESR、WBC与对照组术后ESR、WBC差异无统计学意义(P>0.05),说明机体受到感染及创伤应激反应时ESR、WBC均升高,且升高幅度无差异。感染灶及对照组术后的PCT、CRP、ESR、WBC均高于术前,差异有显著性(P<0.05),表明手术创伤应激反应会引起4种指标升高。见表2。
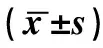
表2 感染组与对照组手术前后实验室指标比较
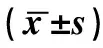
表2(续) 感染组与对照组手术前后实验室指标
2.2感染组PCT、CRP对应的ROC 曲线下面积分别为0.909和0.805,差异有统计学意义(P<0.05)(见表3)。可以作为脊柱内固定术后感染患者诊断感染的指标。PCT的ROC曲线下面积明显大于CRP的(图1),说明PCT反应感染的灵敏度高于CRP。
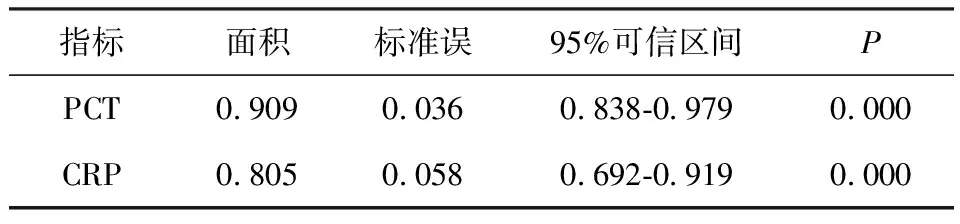
表3 PCT、CRP的ROC曲线比较
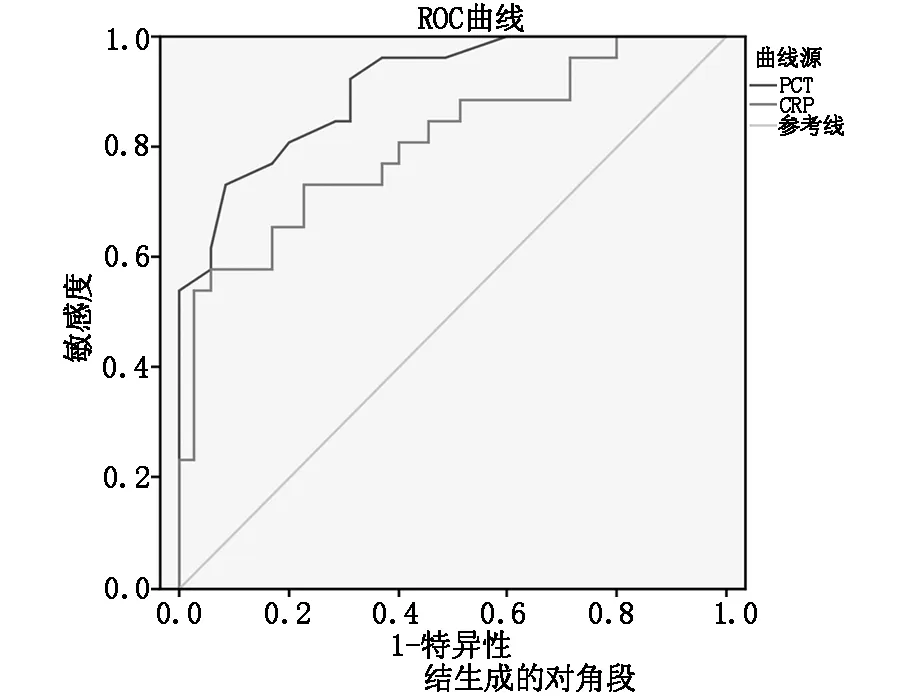
图1 PCT(实线)、CRP(虚线)的ROC曲线
3 讨论
脊柱手术患者术后出现感染并不罕见,临床上我们也非常重视感染的预防及治疗,但因多数脊柱手术病人需使用内固定物,当发生感染时,细菌可以在内固定物上形成一种生物膜,使得感染的治疗较为棘手[7]。若无法控制感染,可引起患者发热,切口流脓渗液、不愈合,内固定松动失效,神经损伤,脓毒血症,败血症等,严重者危及生命。及时诊断和针对性治疗可以有效减少上述不良后果[8]。目前诊断感染的金标准是细菌培养结果,但是培养的时间较长,无法在早期指导治疗,标本污染也可能出现假阳性,影响治疗[9]。若能找到一种适合脊柱内固定术后感染早期诊断的方法,早期用药治疗,则可大大提高感染的治愈率。目前常用于感染监测的炎性指标有CRP、ESR、WBC等,但CRP、ESR、WBC对感染类型无特异性,且手术创伤,应激状态等均可时其升高,从而影响我们对感染的判断。近期有文献报道了PCT联合CRP 应用于呼吸内科[10]、心外科[11]等科室感染的诊断和监测,取得良好的效果,但是应用于脊柱内固定术后诊断和监测感染的文献报道较少,本研究的目的是确定PCT联合CRP在脊柱内固定术后诊断和监测感染的意义。
降钙素原(PCT) 是一段由116 个氨基酸组成的降钙素前肽,由甲状腺、肺等的神经内分泌细胞分泌,正常人体中的PCT含量小,且不受体内激素水平的影响,当患者处于应激状态或过敏反应等情况下,PCT水平变化小。但PCT对细菌感染敏感,当细菌侵入人体后,细菌中的脂多糖可诱导神经内分泌细胞分泌PCT,通常在诱导2 h后在外周血中可以检测到 PCT,在6-12 h 达高峰,半衰期为 24-36 h[12]。PCT在体内含量的骤起骤降可以灵敏反应患者是否受到细菌侵袭,可以用于患者感染早期诊断和治疗效果的评价。所以本研究中发现感染组术后PCT较对照组术后显著升高,差异有统计学意义(P<0.05),因此说明PCT在脊柱内固定术后感染的诊断和监测是同样有意义的。ROC曲线也说明,PCT对于脊柱内固定术后感染的诊断具有良好的敏感性及特异性。
C反应蛋白(CRP) 是一种非特异性急时相蛋白,由肝细胞合成分泌,在正常人血内含量不足1 mg/L。但当人体出现组织细胞损伤、炎症反应刺激等情况时,体内的单核细胞受到激活后释放出白细胞介素I,白细胞介素I刺激肝细胞合成CRP,CRP含量可在短期内迅速增加,在24-48 h达到高峰,且CRP升高的幅度取决于组织损伤的大小及炎症反应的程度,当组织损伤越大、炎症反应越重,CRP也就越高[13]。手术可造成人体组织及细胞的损伤,所以术后患者 CRP 一般均升高,在 2-3 d 达到高峰,随后逐渐下降,约在术后 2周恢复正常[14]。在本研究中两组患者术后CRP 水平均较术前显著升高,也说明了手术创伤对CRP有影响;但感染组患者术后 CRP 较对照组术后CRP还要高,差异有统计学意义(P<0.05)。所以CRP在术后感染的诊断和感染治疗期间的监测同样是有价值的[15]。但ROC曲线也表明,CRP反应感染的敏感性低于PCT。
综上所述,PCT及CRP在脊柱内固定术后感染的患者中均有明显升高,且具有良好的敏感性和特异性,所以我们可以推断PCT联合CRP在脊柱内固定术后感染的早期诊断是有价值的。相比较于细菌培养,检测PCT及CRP操作更简单、快速,有助于我们在早期判断感染及感染严重程度。在临床工作中,对于脊柱内固定术后出现发热或切口渗液的患者,要给予高度重视,及时监测PCT及CRP,对于感染做到早发现、早诊断和早治疗,控制感染的进一步加重,减少感染带来的不良后果,帮助我们为脊柱内固定手术患者得到良好的治疗效果。
参考文献:
[1]Paosong S,Narongroeknawin P,Pakchotanon R,et al.Serum procalcitonin as a diagnostic aid in patients with acute bacterial septic arthritis[J].Int J Rheum Dis,2015,18(3):352.
[2]Garner JS,Jarvis WR,Emori TG,et al.CDC definitions for nosocomial infections,1988[J].Am J Infect Control, 1988, 16(3):128.
[3]Hunziker S,Hügle T,Schuchardt K,et al.The value of serum procalcitonin level for differentiation of infectious from noninfectious causes of fever after orthopaedic surgery[J].J Bone Joint Surg Am,2010, 92(1): 138.
[4]Worthington T, Dunlop D,Casey A,et al.Serum procalcitonin,interleukin-6,soluble intercellular adhesin molecule-1 and IgG to short-chain exocellular lipoteichoic acid as predictors of infection in total joint prosthesis revision[J].Br J Biomed Sci, 2010, 67(2):71.
[5]Sharma P,Patel K,Baria K,et al.Procalcitonin level for prediction of postoperative infection in cardiac surgery[J].Asian Cardiovasc Thorac Ann,2016,24(4):344.
[6]Nie H,Jiang D,Ou Y,et al.Procalcitonin as an early predictor of postoperative infectious complications in patients with acute traumatic spinal cord injury[J].Spinal Cord,2011,49(6):715.
[7]Nishimura S,Tsurumoto T,Yonekura A,et al.Antimicrobial susceptibility of Staphylococcus aureus and Staphylococcus epidermidis biofilms isolated from infected total hip arthroplasty cases[J].J Orthop Sci,2006,11(1):46.
[8]Syvänen J,Peltola V,Pajulo O,Ruuskanen O,et al.Normal behavior of plasma procalcitonin in adolescents undergoing surgery for scoliosis[J].Scand J Surg,2014,103(1):60.
[9]Hall KK,Lyman JA.Updated review of blood culture contamination[J].Clin Microbiol Rev,2006,19(4):788.
[10]Schuetz P,Suter-Widmer I,Chaudri A,et al.Prognostic value of procalcitonin in community-acquired pneumonia[J].Eur Respir J,2011,37(2):384.
[11]Sharma P,Patel K,Baria K,et al.Procalcitonin level for prediction of postoperative infection in cardiac surgery[J].Asian Cardiovasc Thorac Ann,2016,24(4):344.
[12]Tschaikowsky K,Hedwig-Geissing M,Braun GG,et al.Predictive value of procalcitonin,interleukin-6,and C-reactive protein for urvival in postoperative patients with severe sepsis[J].CritCare,2011,26(1):54.
[13]Mok JM,Pekmezci M,Piper SL,et al.Use of C-reactive proteinafter spinal surgery:Comparison with erythrocyte sedimentationrate as predictor of early postoperative infectious complications[J].Spine,2008,33(4):415.
[14]Kang BU,Lee SH,Ahn Y,et al.Surgical site infection in spinalsurgery:detection and management based on serial C reactive protein measurements[J].Neurosurg Spine,2010,13(2):158.
[15]Houten JK,Tandon A. Comparison of postoperative values for Creactive protein in minimally invasive and open lumbar spinal fusion surgery[J].Surg Neurol Int,2011,2:94.

