电针双侧天枢对帕金森病伴便秘患者肛门直肠动力学及UPDRS评分的影响
李立红 金肖青 王晓颖 殷建权 陈晟
帕金森病是一种常见的神经退行性疾病,预计到2040年的发病率约为0.4%[1]。我国帕金森病患者己超过200万例,且每年有近10万例新增病例[2]。帕金森病的主要病理特征是黑质纹状体的多巴胺能神经元发生不可逆的丢失,神经元内部出现α突触核蛋白表达增加并聚集形成路易小体[3-4]。最近研究发现便秘是继嗅觉障碍后的第2个常见非运动症状[5],其病理机制不明,多认为与多巴胺药物的应用、运动量减少、进食减少、肠神经系统α突触核蛋白聚集等有关。美国运动障碍学会推荐使用聚乙二醇治疗帕金森病伴便秘患者[6]。聚乙二醇是渗透型缓泻剂,长期应用会引起患者肠功能紊乱。因此,本研究采用电针双侧天枢来改善帕金森病伴便秘患者的症状,并就疗效以及对患者肛门直肠动力学指标、统一帕金森病评定量表(UPDRS)评分的影响,与口服聚乙二醇的患者进行比较,现将结果报道如下。
1 对象和方法
1.1 对象 选择2017年3至8月门诊就诊的93例帕金森病伴便秘患者(浙江省人民医院32例、浙江省中医院61例)为研究对象。在患者知情同意的前提下,采用随机数字表法分为针刺组47例与对照组46例,两组患者性别、年龄、帕金森病病程、Hoehn-Yahr分级(身体单侧受影响,但不影响平衡为1级;身体双侧受影响,但不影响平衡为2级;平衡受影响,轻度到中度疾病,但患者可以独立生活为3级)[7]、左旋多巴等效剂量比较,差异均无统计学意义(均P<0.05),见表1。纳入标准:符合英国帕金森病脑库的诊断标准;(2)符合便秘罗马Ⅲ诊断标准[8];(3)Hoehn-Yahr分级为 1~3 级;(4)未接受过毁损术或深部脑刺激术治疗;(5)无认知功能障碍;(6)简易精神状态量表(MMSE)评分>24分。排除严重心脑血管疾病、继发性帕金森病、帕金森叠加综合征、精神疾病、结肠镜或结肠钡灌肠检查发现肠道器质性疾病的患者,以及接受过肛肠手术患者。本研究经浙江省人民医院医学伦理委员会审核批准,所有患者签署知情同意书。
1.2 治疗方法 所有患者的液体摄入量增加到2L/d,膳食纤维增加至20~25g/d。(1)对照组:给予聚乙二醇(批号:H20130145,规格:10g×10 片/盒,法国博福一益普生工业公司)口服,10g/次,顿服,1 次/d,共治疗 28d。(2)针刺组:取双侧天枢,常规皮肤消毒。0.35mm×50mm毫针垂直刺入,针刺深度以得气为度,通韩氏穴位神经刺激仪(型号:JC512-HANS100A,南京济生医疗科技有限公司),选择波型疏密波2/15Hz,刺激30min。1次/d,7d为1个疗程,共治疗4个疗程。所有患者遵从试验要求,若治疗时仍有排便困难,可使用开塞露治疗,但需详细记录使用时间和剂量。撤出试验标准:(1)未按治疗方案治疗,治疗期间自行加用其他治疗方法者;(2)不能坚持治疗者;(3)针刺<25次者;(4)试验中出现其他合并疾病或病情恶化者。

表1 两组患者基本情况比较
1.3 观察指标
1.3.1 便秘症状评估 治疗28d后,结合临床症状积分评定标准评估疗效,见表2。便秘症状完全改善或恢复至病前水平,积分接近0分为治愈;便秘症状明显改善,积分较治疗前降低≥2/3为显效;便秘症状较治疗前好转,积分较治疗前降低≥1/2为有效;便秘症状无改善,积分较治疗前未降低为无效。总有效率=(治愈+显效+有效)/总例数×100%。

表2 临床症状积分评定标准
1.3.2 肛门直肠动力学检查 在入组第2天(治疗前)和第30天(治疗后),使用肛肠动力分析仪(型号:ZGJD3,莱博瑞医疗技术公司)检测直肠静息压(PRR)、肛管静息压(PAR)、肛管收缩压(PAs)、直肠初始感觉容积(VFs)、最大耐受容积(VMT)。检查前嘱患者排空尿液、粪便。取患者左侧曲膝卧位,左侧臀部下置1个便盆。测压导管用润滑剂润滑后经肛门插入,不同导管的放置位置不同。
1.3.3 帕金森病情评估 在入组第1天(治疗前)和第30天(治疗后)使用UPDRS 3.0版进行帕金森病情评估,内容包括UPDRSⅠ4项(精神、行为及情绪)、UPDRSⅡ13项(日常生活及活动)、UPDRSⅢ14项(运动检测)、UPDRSⅣ11项(治疗的并发症)。
1.4 统计学处理 应用SPSS 13.0统计软件。计量资料用表示,组间比较采用独立样本t检验,同组治疗前后比较采用配对样本t检验;计数资料用率表示,组间比较采用χ2检验或秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗后便秘症状评估结果比较 针刺组便秘总有效率为82.12%(40/47),明显高于对照组的67.39%(31/46),差异有统计学意义(P<0.05),具体评估结果见表3。

表3 两组患者治疗后便秘症状评估结果比较[例(%)]
2.2 两组患者治疗前后肛门直肠动力学指标比较 两组患者治疗前后肛门直肠动力学指标比较,差异均无统计学意义(均P>0.05);治疗后,针刺组与对照组比较,差异亦均无统计学意义(均P>0.05),见表4。
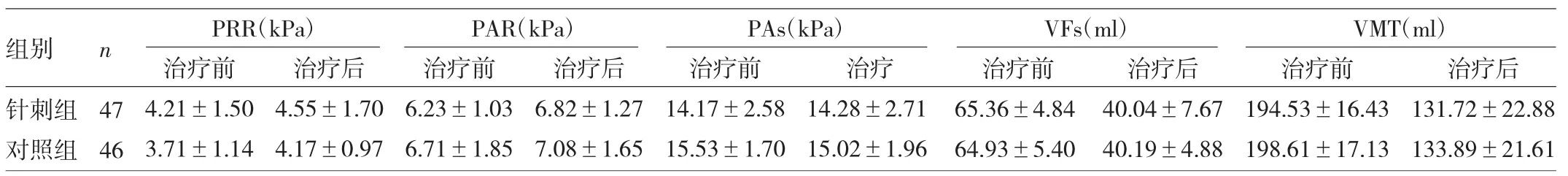
表4 两组患者治疗前后肛门直肠动力学指标比较
2.3 两组患者治疗前后UPDRS评分的比较 两组患者治疗前后UPDRSⅡ、UPDRSⅢ、UPDRSⅣ及总分比较,差异均无统计学意义(均P>0.05);针刺组治疗后UPDRSⅠ低于治疗前,差异有统计学意义(P<0.05)。治疗后,针刺组与对照组UPDRSⅡ、UPDRSⅢ、UPDRSⅣ及总分比较,差异亦均无统计学意义(均P>0.05);UPDRSⅠ为针刺组低于对照组,差异有统计学意义(P<0.05),见表 5。

表5 两组患者治疗前后UPDRS评分比较(分)
3 讨论
便秘在帕金森病患者中的发生率高达70%,可早于帕金森病运动症状20余年就出现[9]。目前,关于帕金森病伴便秘的形成机制以及影响便秘严重程度相关因素的结论尚未统一[10-12]。神经病理学研究表明,在肠神经系统的黏膜下和肌间神经丛有α突触核蛋白异常沉积[13-14]。有文献报道结肠镜活检发现α突触核蛋白在肠道的积累,且发现在帕金森病运动症状出现前7年[15]。然而,抗帕金森病药物也可能降低胃移行性复合运动和胃动力[16]。此外,相关研究表明焦虑、UPDRS评分对患者便秘严重程度起到一定作用,而帕金森病病程、便秘持续时间、左旋多巴等效剂量均未起到主要作用[17]。焦虑情绪可能通过抑制外周自主神经对结肠的支配或通过大脑皮质影响自主神经系统(尤其是副交感神经),使肠管扩张,肠动力减弱,胃肠道分泌消化液减少,从而引起便秘[18]。此外,便秘严重程度可能与患者生活习惯及潜在的胃肠道神经系统变性相关。有人推测,α突触核蛋白的积累可能起源于肠系神经系统,并通过迷走神经以一种逆行的方式进行运输。通过诱导正常的α突触核蛋白以一种类似的方式来折叠,这个循环可能会重复,并导致连接神经元网络的自我传播和细胞丢失,然后蔓延到中枢神经系统[19]。研究表明帕金森病患者便秘的发生与结肠转运时间延长、排便动力低、盆底肌运动不协调等有关[20]。目前采用美国运动障碍学会推荐药物聚乙二醇治疗帕金森病伴便秘患者,但长期服用会引起腹痛、腹泻,甚至电解质紊乱。
帕金森病属于中医“颤证”范畴,病机为阴血不足,肝风内动。祖国医学认为便秘是由大肠传导失职导致的。天枢属于足阳明胃经,是手阳明大肠经募穴。本研究通过电针双侧天枢来调理帕金森病伴便秘患者的胃肠功能,并与口服聚乙二醇的疗效进行比较。针刺组便秘症状总有效率为82.12%,明显高于对照组。此外,两组患者治疗前后肛门直肠动力学指标、UPDRS各因子及总分(UPDRSⅠ除外)比较,差异均无统计学意义;治疗后,针刺组与对照组比较,差异亦均无统计学意义。治疗后,针刺组UPDRSⅠ低于治疗前,且低于对照组。以上结果提示,电针双侧天枢在改善帕金森病患者便秘症状的同时,还能改善患者的精神状态。在治疗观察的28d中,针刺组应用开塞露7次,对照组应用开塞露5次。
笔者前期研究发现,揿针中脘、下脘、气海、关元、大肠俞、小肠俞,能明显提高帕金森病伴便秘患者的临床疗效,改善肛门直肠动力学指标及生活质量评分[21]。由于取穴较多,不能明确治疗穴位的相关性,故本研究仅电针双侧天枢穴位,发现帕金森病患者的便秘症状明显改善。在对肛门直肠动力学和UPDRS评分的影响方面,发现VEs、VMT等指标基本恢复至正常水平,但治疗前后比较差异无统计学意义;此外,电针在改善便秘症状的同时,还能改善患者的精神状态。
[1]KowalSL,DallTM,ChakrabartiR,et al.The current and projected economic burden of Parkinson's disease in the United States[J].Mov Disord,2013,28(3):311-318.
[2]Pringsheim T,Jette N,Frolkis A,et al.The prevalence of Parkinson's disease asystematic review and meta-analysis[J].Mov Disord,2014,29(13):1583-1590.
[3]Goedert M,SpillantiniMG,DelTK.100 years of Lewy pathology[J].Nature reviews Neurology,2013,9(1):13-24.
[4]Oczkowska A,Kozubski W,Dorszewska J.Alpha-synuclein in Parkinson's disease[J].Przeglad lekarski,2014,71(1):26-32.
[5]Chen H,Zhao EJ,Zhang W,et al.Meta-analyses on prevalence of selected Parkinson's nonmotor symptoms before and after diagnosis[J].Transl.Neurodegener,2015,4(1):1.
[6]SeppiK,Weintraub D,Coelho M,et al.The movement disorder society evidence-based medicine review update:treatments for the non-motor symptoms of Parkinson's disease[J].Mov Disord,2011,26(Suppl3):542-580.
[7]Hughes AJ,DanielSE,Kilford L,et al.Accuracy of clinicaldiagnosis of idiopathic Parkinson's disease:a clinico-pathologicalstudy of 100 cases[J].J Neural Neurosurg Psychiatry,1992,55(3):181-184.
[8]Drossman DA.The functional gastrointestinal disorders and the RomeⅢprocess[J].Gastroenteroloy,2006,130(5):1377-1380.
[9]Selkrig J,Wong P,Zhang X,et al.Metabolic tinkering by the gut microbiome:Implications for brain development and function[J].Gut Microbes,2014,58(5):369-380.
[10]李林,张博爱.帕金森病患者便秘的研究进展[J].中国神经精神疾病杂志,2011,37(1):60-61.
[11]Wang J,Bi M,Liu H,et al.The protective effect of lactoferrin on ventral mesencephalon neurons against MPP+is notconnected with its iron binding ability[J].Sci Rep,2015,5:10729.doi:10.1038/srep10729.
[12]Gage H,Kaye J,Kimber A,et al.Correlates of constipation people with Parkinson's[J].Parkinsonism Relat Disord,2011,17(2):106-111.
[13]Braak H,de Vos RAI,Bohl J,et al.Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology[J].NeurosciLett,2006,396(1):67-72.
[14]Beach TG,Adler CH,Sue LI,et al.Multi-organ distribution of phosphorylated alpha-synuclein histopathology in subjects with Lewy body disorders[J].Acta Neuropathol,2010,119(6):689-702.
[15]Hilton D,Stephens M,Kirk L,et al.Accumulation of α-synuclein in the bowel ofpatients in the pre-clinical phase of Parkinson's disease[J].Acta Neuropathol,2014,127(2):235-241.
[16]Asahina M,Vichayanrat E,Low DA,et al.Autonomic dysfunction in Parkinsonian disorders:assessment and pathophysiology[J].NeurolNeurosurg Psychiatry,2013,84(6):674-680.
[17]徐勤荣,袁永胜,佟晴,等.帕金森病便秘的发生机制及其严重程度相关因素分析[J].中华神经科杂志,2015,48(6):509-513.
[18]谢振东,李东冰,贾小强,等.焦虑和抑郁在慢传输型便秘患者发病过程中的作用评估初探[J].世界中医药,2013,8(9):1033-1035.
[19]Walsh DM,Selkoe DJ.Acriticalappraisalof the pathogenic protein spreadhypothesis of neurodegeneration[J].Nat Rev Neurosci,2016,17(4):251-260.doi:10.1038/nrn.2016.13.
[20]Wang CP,Sung WH,Wang CC,et al.Early recognition of pelvic floor dyssynergia and colorectalassessment in Parkinson's diseaseassociated with bowel dysfunction[J].Colorectal Dis,2013,15(3):e130-137.
[21]李立红,张海峰,陈晟,等.揿针对改善帕金森病患者便秘症状的作用[J].医学研究生报,2017,30(7):762-766.

