老年女性乳腺癌的临床病理特征和治疗方式分析
曹博 朱晓萍 江琴
随着社会老龄化的加剧,我国65岁以上老年人乳腺癌的发病率呈逐年上升趋势[1],预计到2030年,65岁以上乳腺癌患者的比例将增至27.0%[2]。老年乳腺癌患者常伴有心脑血管疾病及第二原发癌,对放化疗及手术耐受性较差,多数临床试验尤其是化疗的临床研究将这部分乳腺癌患者排除在外,因而缺乏达成共识的指南,其综合治疗主要参照常规人群乳腺癌的相关指南。目前国内关于老年乳腺癌的研究较少,本研究通过比较老年与非老年乳腺癌患者的临床病理特征、治疗方式及预后情况,为老年乳腺癌的治疗提供依据。
1 对象和方法
1.1 对象 纳入2014年1月1日至2017年11月31日本院收治的女性乳腺癌患者739例,年龄25~82(52.3±9.8)岁;按年龄分为老年组(≥65岁)102例和非老年组(<65岁)637例。老年组年龄 65~82(68.9±3.9)岁,非老年组年龄25~64(49.6±7.6)岁。临床首发症状以可触及肿块最多见,共650例(88.0%);体检影像学检查发现68例(9.2%);乳头溢液18例(2.4%);乳头糜烂3例(0.4%)。合并系统疾病259例(35.0%),第二原发癌或对侧乳腺癌17例(2.3%)。病理确诊浸润性导管癌547例(74.0%),原位癌(伴或不伴微浸润)131例(17.7%),黏液腺癌21例(2.9%),浸润性小叶癌16例(2.2%),乳头状癌11例(1.5%),髓样癌6例(0.8%),小管癌4例(0.5%),大汗腺癌2例(0.3%),恶性分叶状肿瘤伴骨肉瘤和软骨肉瘤分化1例(0.1%)。入组标准:在本院经病理明确诊断并完成辅助治疗。排除标准:数据资料缺失及未完成辅助治疗者。
1.2 资料收集 通过查询本院电子病例系统和上海交通大学乳腺癌数据库收集所有患者的资料,包括年龄、月经状态、家族史、合并症、TNM分期、手术及病理、免疫组化、治疗方案和随访资料等。
1.3 随访 采用门诊复查、住院检查、电话随访等方式,术后1~2年每3个月随访1次,3~5年每半年随访1次。随访截止至2018年3月10日或患者死亡。无病生存期(disease free survival,DFS)为手术时间至疾病复发(包括局部复发、区域复发或远处转移)、发生对侧乳腺癌、第二原发癌或死亡的时间。总生存期(overall survival,OS)为手术时间至任何原因引起死亡的时间。
1.4 统计学处理 采用SPSS 22.0统计软件。计数资料组间比较采用χ2检验或Kruskal-Wallis H检验。以Kaplan-Meier法绘制生存曲线,并行log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 老年与非老年组患者临床病理特征比较 老年与非老年组患者在家族史、首发症状、肿瘤大小、TNM分期、脉管侵犯、病理类型、组织学分级、Ki-67、分子分型、腋窝淋巴结转移方面比较差异均无统计学意义(均P>0.05),但两组患者合并系统疾病比较差异有统计学意义(P<0.05),见表 1。
2.2 老年与非老年组患者治疗方式比较 两组患者行新辅助化疗比例、乳房手术方式、腋窝手术方式和靶向治疗比例比较差异均无统计学意义(均P>0.05)。老年组患者术后更多予内分泌治疗,较少予以辅助化疗及放疗,与非老年组比较差异均有统计学意义(均P<0.05),见表2。

表1 老年与非老年组患者临床病理特征比较[例(%)]
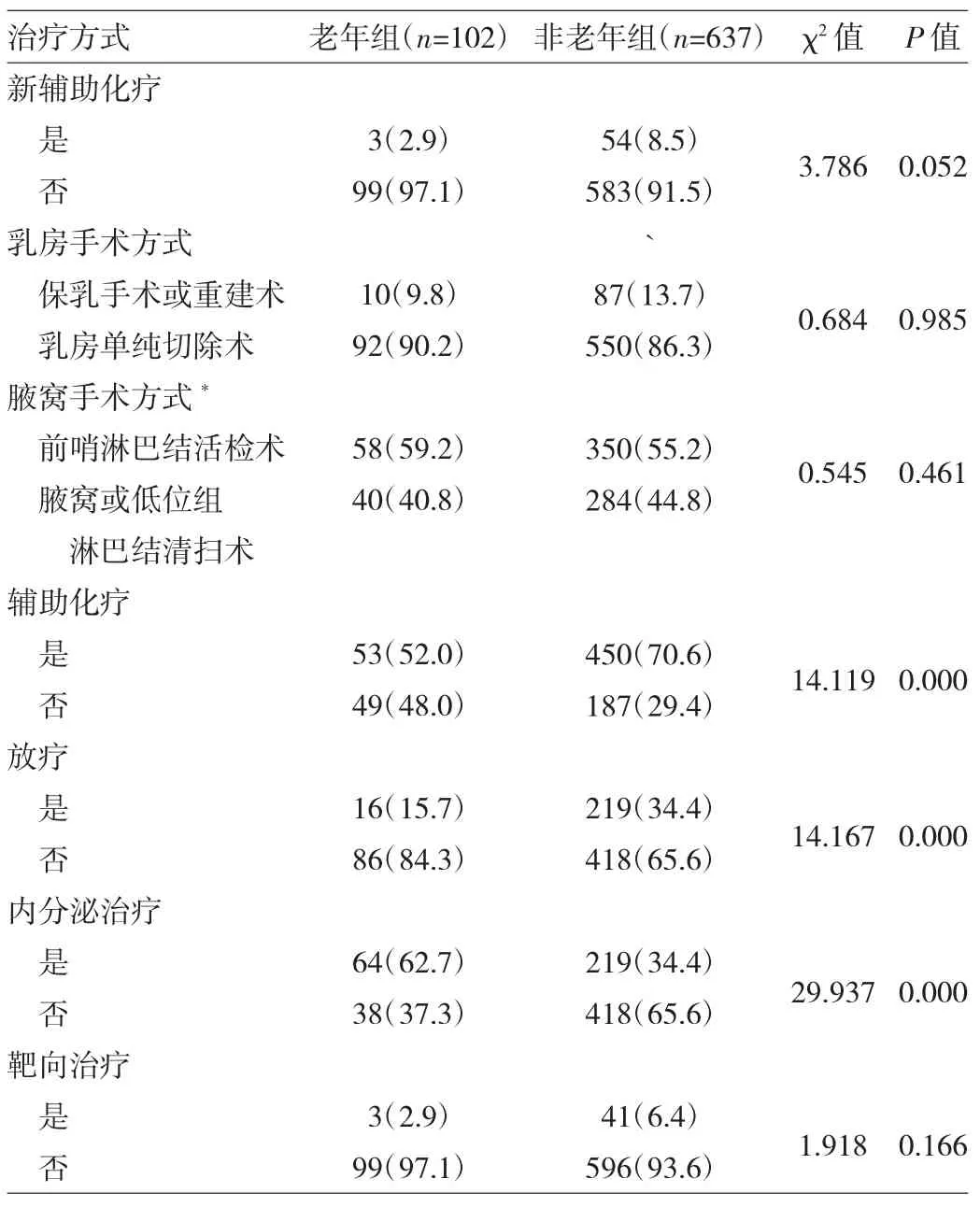
表2 老年与非老年组患者治疗方式比较[例(%)]
2.3 老年组和非老年组患者预后分析 所有患者随访时间2.1~50.3个月,中位随访时间23.5个月,复发25例,死亡10例,Kaplan-Meier生存分析结果显示,老年组和非老年组3年DFS分别为85.8%和93.9%,老年组3年DFS低于非老年组,差异有统计学意义(HR=2.59,95%CI:1.03~5.49,P<0.05),老年组和非老年组 3 年 OS 分别为96.3%和97.6%,两组比较差异无统计学意义(HR=2.09,95%CI:0.44~9.83,P > 0.05),见图 1-2。
3 讨论
目前,普遍认为老年乳腺癌临床病理特征和生物学行为相对较好,伴随疾病多,患者预期寿命较短,临床医师在治疗上更倾向于保守的方式,可能存在治疗不足的情况或相对无序的状态,因此,需要临床工作者更多地了解老年乳腺癌的临床病理特征和治疗方式,结合个体,以最小的损伤治疗达到最大的疗效。文献报道老年乳腺癌常表现出“惰性肿瘤”的生物学特性,表现为低增殖、高分化[3],且激素受体阳性率高。Grumpelt等[4]发现,与50~70岁患者比较,75岁以上患者雌激素受体阳性表达率更高,孕激素受体阳性率也高达71.1%。Chatzidaki等[5]研究表明80岁以上患者雌激素受体阳性率可高达72%。

图1 老年组与非老年组患者DFS比较
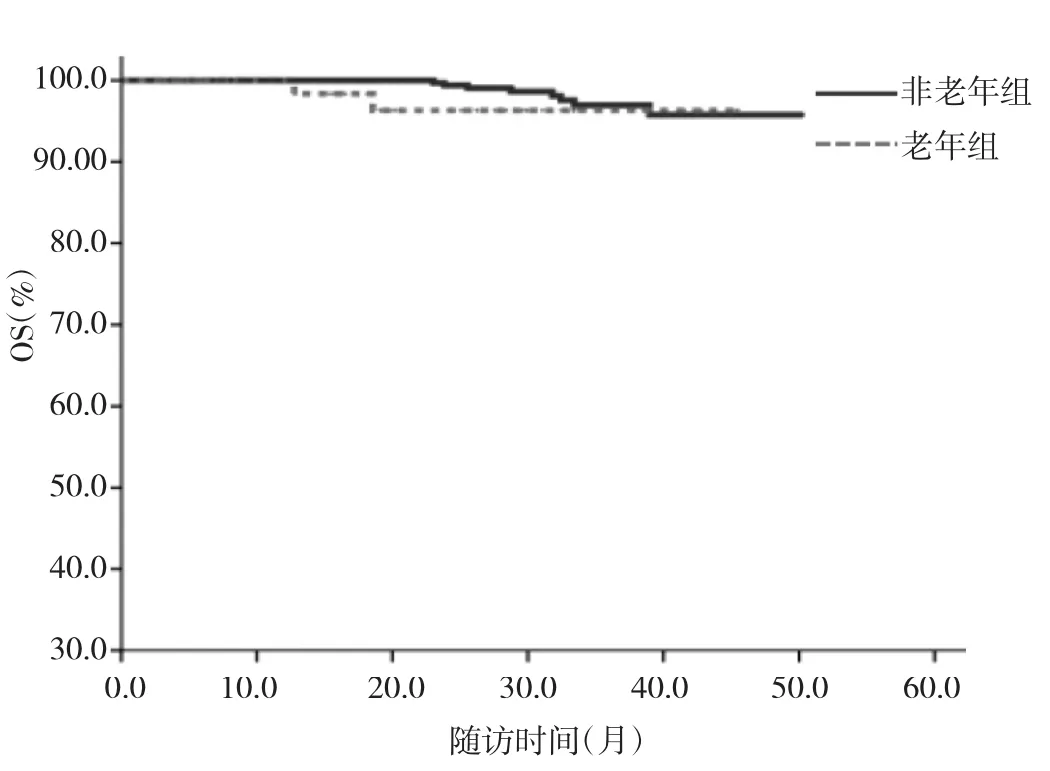
图2 老年组与非老年组患者OS比较
本研究发现,与非老年患者比较,老年患者行新辅助化疗及保乳手术或重建术的比例虽然较低,但差异无统计学意义,两者的腋窝手术方式亦无统计学差异。国内一项多中心研究也发现,我国65岁以上老年乳腺癌患者行乳房单纯切除术的比例显著高于非老年组,与年轻患者相比,老年组较少行化疗和放疗[6]。可能原因为老年患者出于对乳房局部复发的忧虑和进一步放疗的恐惧,更多选择乳房单纯切除术;此外,由于经济条件的限制和基层医院重建技术的不成熟,也常促使这部分患者放弃乳房重建手术。老年患者合并心脑血管疾病、甲状腺疾病、恶性肿瘤较多,虽能耐受手术,但术后恢复也较慢,容易出现淋巴水肿和血栓等并发症。Mandelblatt等[7]研究也表明老年乳腺癌患者接受腋窝手术包括前哨淋巴结活检术和腋窝淋巴结清扫术时更易发生术后并发症。Martelli等[8]发现70岁以上临床腋窝淋巴结阴性的乳腺癌患者即使不进行腋窝处理,也不会影响患者的OS,故老年乳腺癌患者可以酌情不做腋窝淋巴结清扫术,甚至前哨淋巴结活检术。但若不进行腋窝处理,无法评估腋窝淋巴结状态,可能影响后续放化疗方案的制定,造成治疗不足的情况。基于此,笔者认为浸润性乳腺癌的患者仍需腋窝处理以明确腋窝淋巴结状态,且随着麻醉技术和超声刀的使用,手术时间大大缩短,大部分老年患者在生命体征稳定的情况下能够耐受常规的包括乳房单纯切除术和腋窝淋巴结清扫术。临床工作中仍需进一步提高前哨淋巴结检出率,减少手术创伤,避免进一步的腋窝淋巴结清扫术。
内分泌治疗相对毒性更低,易被老年患者接受,因此本研究老年组患者术后更多选择内分泌治疗,较少予以辅助化疗及放疗,与非老年组比较差异均有统计学意义,与闫宇等[6]的回顾性研究相符。Hughes等[9]研究表明行保乳术后的老年乳腺癌患者仅接受内分泌治疗不接受全乳的放疗对OS影响不大,但对局部复发率影响较大(2%vs 9%)。针对部分高龄、心肺功能较差、激素受体阳性的乳腺癌患者,若评估其局部复发概率较小,可考虑豁免术后全乳放疗,仅予以内分泌治疗。另大分割全乳照射和加速部分乳腺照射与传统放疗相比,大大缩短了治疗时间,对老年人来说也许更适宜,但目前应用时间尚短,其有效性和安全性还需要临床大数据支撑。Muss等[10]发现化疗对于激素受体阳性、腋窝淋巴结阴性的老年患者的疗效并不佳,但对于激素受体阴性、腋窝淋巴结阳性者有生存获益。因而对激素受体阴性、腋窝淋巴结阳性的老年乳腺癌患者仍需参照临床指南予以术后的辅助化疗,但在化疗方案的选择上需结合患者全身健康情况。Aapro等[11]发现在既往无心脏病史的66~70岁患者中使用含蒽环类药物的化疗方案后,其充血性心力衰竭发生率明显增高。对于激素受体阴性、腋窝淋巴结阳性的老年乳腺癌患者,化疗方案上4~6次的多西他赛联合环磷酰胺方案是比较好的一种选择。芳香化酶抑制剂是绝经后激素受体阳性患者的标准内分泌治疗,但有引起肌肉关节症状、骨质疏松等风险,因此要注意加强补钙及监测骨密度,必要时予以双磷酸盐预防骨质疏松,减少骨相关事件的发生。如无法耐受芳香化酶抑制剂,选择性雌激素受体调节剂他莫昔芬也是一种可选药物。本研究中,老年组和非老年组分别有52.0%和70.6%的患者接受辅助化疗,62.7%和34.4%的患者接受内分泌治疗,中位随访时间23.5个月,老年组和非老年组3年DFS分别为85.8%和93.9%,3年OS分别为96.3%和97.6%,两组OS比较差异无统计学意义,但老年组DFS低于非老年组,差异有统计学意义,提示化疗可以延长DFS,但不影响老年患者的OS。
本研究尚存在一些不足:第一,本研究为回顾性研究,仅收集本院治疗的乳腺癌患者入组,且老年组入组患者较少,739例患者中,仅102例老年患者,存在入组偏倚;第二,本组患者随访时间较短,所有患者随访时间2.1~50.3个月,中位随访时间23.5个月,事件数亦较少,复发25例,死亡10例,尚不能得出老年组和非老年组长期DFS和OS的差别。
综上所述,本研究发现老年和非老年乳腺癌患者的临床病理特征差异均无统计学意义,但老年组患者合并心脑血管疾病、甲状腺疾病、恶性肿瘤病史较多。老年乳腺癌患者术后更多予内分泌治疗,较少予以辅助化疗及放疗,与非老年组患者OS比较差异无统计学意义,但仅予内分泌治疗是否能获得与化疗类似的长期生存获益有待更长时间的随访及进一步前瞻性研究证实。
[1]Fan L,Strasser-Weippl K,Li JJ,et al.Breast cancer in China[J].Lancet Oncol,2014,15(7):e279-e289.doi:10.1016/s 1470-2045(13):70567-9.
[2]DeSantis CE,Fedewa SA,Goding Sauer A,et al.Breast cancer statistics,2015:Convergence of incidence rates between black and white women[J].CA Cancer J Clin,2016,66(1):31-42.doi:10.3322/caac.21230.
[3]Tang J,Wu CC,Xie ZM,et al.Comparison of clinical features and treatment outcome of breast cancers in young and elderly Chinese patients[J].Breast Cancer(Basel),2011,6(6):435-440.doi:10.1159/000332593.
[4]Grumpelt AM,Ignatov A,Tchaikovski SN,et al.Tumor characteristics and therapy of elderly patients with breast cancer[J].J Cancer Res Clinl Oncol,2016,142(5):1109-1116.doi:10.1007/s 00432-015-2111-2.
[5]Chatzidaki P,Mellos C,Briese B,et al.Does primary breast cancer in older women(≥80 years)have unfavorable histological characteristics?[J].Arch Gynecol Obstet,2011,284(3):705-712.doi:10.1007/s 00404-010-1697-5.
[6]闫宇,任予,范金虎,等.65岁以上中国老年女性原发性乳腺癌临床病理特征及治疗分析:多中心10年回顾性研究[J].中国肿瘤,2017,7(26):561-566.doi:10.11735/j.issn.1004-0242.
[7]Mandelblatt JS,Edge SB,Meroplo NJ,et al.Sequelae of axillary lymph node dissection in older women with stage 1 and 2 breast carcinoma[J].Cancer,2002,95(12):2445-2454.doi:10.1002/cncr.10983.
[8]Martelli G,Miceli R,Daidone MG,et al.Axillary dissection versus no axillary dissection in elderly patients with breast cancer and no palpable axillary nodes:results after 15 years of follow-up[J].Ann Surg Oncol,2011,18(1):125-133.doi:10.1245/s10434-010-1217-7.
[9]Hughes KS,Schnaper LA,Bellon JR,et al.Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer:long-term follow-up of CALGB 9343[J].J ClinOncol,2013,31(19):2382-2387.doi:10.1200/JCO2012.45.2615.
[10]Muss HB,Berry DA,Cirrincione CT,et al.Adjuvant chemotherapy in older women with early stage breast cancer[J].N Engl J Med,2009,360(20):2055-2065.doi:10.1056/NEJMoa0810266.
[11]Aapro M,Bernard-Marty C,Brain EG,et al.Anthracycline cardiotoxicity in the elderly cancer patient:a SIOG expert position paper[J].Ann Oncol,2011,22(2):257-267.doi:10.1093/annonc/mdq609.

