富血小板血浆联合间充质干细胞促进前交叉韧带腱骨愈合的临床疗效研究
陈宇 徐跻峰 章水均 毕擎
前交叉韧带(anterior cruciate ligament,ACL)是膝关节重要的稳定结构,一旦发生断裂会显著降低膝关节稳定性,不仅难以自愈,而且容易引起半月板损伤及关节退行性病变等并发症的发生[1]。目前,ACL重建术已成为治疗ACL损伤的主要方法,但肌腱移植物与骨隧道之间的愈合效果仍未得到很好解决[2],因此,如何选取肌腱移植物是促进术后骨隧道愈合的关键[3]。临床常采用单一生物材料来促进腱骨愈合,其中富血小板血浆(plate let rich plasma,PRP)是较为常用的生物材料[4],疗效虽有一定的提高,但仍不能令人满意。部分学者开始尝试使用间充质干细胞(mesenchymal stem cells,MSCs)来促进腱骨愈合,但多数均为动物研究[5],针对人体的疗效尚不明确。笔者推测联合使用生物材料和MSCs或许可提高腱骨愈合效果,因此,对PRP联合MSCs促进ACL腱骨愈合的临床疗效进行了研究,旨在为临床治疗提供依据。
1 对象和方法
1.1 对象 选取2014年6月至2016年5月本院收治的ACL损伤患者56例,按照随机数字表法分为联合组和单一各组28例,单一组采取单独PRP治疗,联合组采取PRP联合MSCs治疗。纳入标准:经影像学检查确诊为ACL损伤;无既往膝关节手术史。排除标准:合并严重疾病导致不能手术者;合并其他韧带损伤者。联合组男 17 例,女 11 例;年龄 27~45(35.46±9.47)岁;病程5~16(11.68±5.17)d。单一组男 15 例,女 13 例;年龄 26~47(36.11±9.87)岁;病程 7~16(12.20±4.45)d。两组患者性别、年龄和病程等一般资料比较差异均无统计学意义(均P>0.05)。本研究经医院伦理委员会批准和患者知情同意。
1.2 制备方法
1.2.1 自体PRP的制备 采用PRP制作包(山东威高集团医用高分子制品股份有限公司),于无菌条件下抽取患者肘静脉血50ml,置于FRONTIERTM5000 MULTI PRO多功能离心机[奥豪斯国际贸易(上海)有限公司],2 000r/min离心10min,弃去下层红细胞,取上层悬液再次离心,取下层血浆成分为PRP,将PRP与凝血酶(北京索莱宝科技有限公司,YZ-280013-97IU)按比例10∶1进行混合,形成PRP凝胶。
1.2.2 自体骨髓MSCs的制备 局部麻醉下用骨穿针抽取患者两侧骼后上棘骨髓血约80ml,置于肝素抗凝管内进行过滤,分离集合物和脂肪,置于血细胞分离机进行离心,弃去上清液、无核红细胞层及多核细胞层,取下层浓集液作为骨髓MSCs。
1.3 治疗方法
1.3.1 手术方法 将单一组制备好的肌腱移植物置于5ml PRP凝胶中浸泡30min,将联合组制备好的肌腱移植物置于5ml PRP凝胶及5ml MSCs中分别浸泡30min。所有患者均采取ACL重建术,手术均由同一组医师完成。蛛网膜下腔阻滞麻醉下,通过膝前内、外侧入路,先行关节镜关节探查,将胫骨端定位器定位于ACL解剖足印点中心处,极度屈膝关节至120°,制备胫骨隧道,其次通过保留的股骨外踝内侧壁ACL残端识别ACL解剖足印点,并将股骨端定位器定位于此处,制备股骨隧道。通过克氏针及引线将两组浸泡后的移植肌腱分别经胫骨隧道引入膝关节,并拉入股骨隧道,拉紧移植肌腱胫骨端,屈伸膝关节20次左右,使肌腱顺应骨隧道。拉紧胫骨端肌腱,屈膝30°,通过平头3mm克氏针自外向内扭入可吸收挤压螺钉,使胫骨隧道的肌腱固定。术闭,放出关节腔液体,缝合伤口。
1.3.2 治疗方案 单一组于关节腔内注射PRP凝胶,在损伤关节处常规消毒并麻醉,在C型臂X线机透视下,使用注射器针头对关节腔进行定位,确认针尖置于关节腔内后,注入制备好的5ml PRP凝胶,注射完毕后,退出穿刺针头,使用无菌敷料覆盖包扎。联合组于关节腔内注射PRP凝胶联合MSCs,在C型臂X线机透视下,先将制备好的5ml PRP凝胶注入关节腔内,再将5ml MSCs经定位针头注入关节腔,注射完毕后,退出穿刺针头,使用无菌敷料(上海弘生医疗科技有限公司)覆盖包扎。
1.4 观察指标 于术前及术后3、6、12个月对两组患者进行MRI检查,测量胫骨隧道斜矢状面位最大层面直径,比较两组术后胫骨隧道缩小程度。并于术前及术后3、6、12个月使用Lysholm评分、国际膝关节文献委员会(International Knee Documentation Committee,IKDC)评分对患者膝关节功能进行评价,总分均为100分,分数越高,膝关节功能越好。
1.5 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,组间比较采用两独立样本t检验,组内比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术前后胫骨隧道斜矢状面位最大层面直径比较 两组术前、术后3个月胫骨隧道斜矢状面位最大层面直径比较差异均无统计学意义(均P>0.05),两组术后3、6、12个月胫骨隧道斜矢状面位最大层面直径均明显低于术前(均P<0.05),且术后6、12个月联合组均明显低于单一组(均P<0.05),见表1。
2.2 两组患者手术前后Lysholm评分比较 两组术前Lysholm评分比较差异无统计学意义(P>0.05),两组术后3、6、12个月Lysholm评分均明显高于术前(均P<0.05),且联合组均明显高于单一组(均P<0.05),见表2。

表1 两组患者手术前后胫骨隧道斜矢状面位最大层面直径比较(mm)
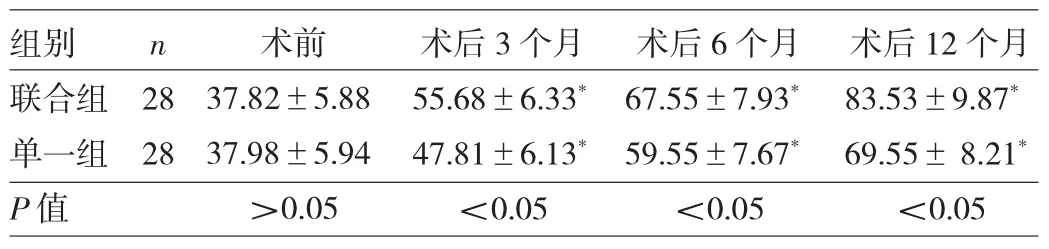
表2 两组患者手术前后Lysholm评分比较(分)
2.3 两组患者手术前后IKDC评分比较 两组术前IKDC评分比较差异无统计学意义(P>0.05),两组术后3、6、12个月IKDC评分均明显高于术前(均P<0.05),且联合组明显高于单一组(均P<0.05),见表3。

表3 两组患者手术前后IKDC评分比较(分)
3 讨论
ACL断裂是目前青壮年多发的运动性损伤,其原因是膝盖稳定性降低导致活动力下降[6],患者多出现打软、扭伤关节疼痛等症状,严重时可发展成为骨性关节炎[7],严重影响患者日常生活,因此,采取积极有效的治疗措施至关重要。多数学者主张进行关节镜下ACL重建术,通过肌腱移植物促进腱骨愈合[8],但肌腱移植物与骨组织常存在愈合缓慢的现象,有关研究显示,术后仍有2%~25%的患者存在腱骨愈合慢、骨隧道扩大等情况[9]。
ACL重建术后,腱骨愈合常需转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)、血小板衍生因子(PDGF)等多种细胞因子作用[10-11]。PRP是全血中分离的血小板浓缩物,可通过血小板α-颗粒释放大量细胞因子[12],修复肌肉骨骼系统的损伤,促进腱-骨隧道界面瘢痕化,从而促进骨组织愈合。但PRP单独使用时容易在关节液破坏下迅速流失[13],使骨细胞再生能力受限,常存在术后腱骨愈合缓慢的状况,而将PRP与凝血酶混合制成PRP凝胶,可防止血小板流失,使其长时间停留在腱骨界面释放细胞因子,从而延长作用时间,同时PRP中含有白细胞,对防治重建术后感染具有一定意义。MSCs是存在于外周血、脐带血及骨髓里的一种干细胞,具有多向分化潜能[14],可在特定条件下诱导分化为成骨细胞、软骨细胞、肌肉细胞等,直接促进组织生长。MSCs同样能够分泌多种细胞因子,促进组织快速愈合,目前已广泛应用于软骨修复、神经修复及烧伤创面修复等治疗中[15],但用于ACL重建术后腱骨愈合的研究较少。PRP、MSCs取材方便,且均来源于自体血液,无排斥反应,生物活性安全,减少了疾病传播风险。
杨军军等[16]研究表明PRP联合MSCs对促进兔ACL重建后腱骨愈合效果较好,在此试验基础下,本研究采用PRP联合MSCs对人体进行了研究,将肌腱移植物置于制备好的PRP、MSCs中浸泡,使得在注入PRP、MSCs时肌腱移植物可充分适应PRP、MSCs环境,进而发挥最佳疗效,结果显示,两组患者术后6和12个月胫骨隧道斜矢状面位最大层面直径较术前明显缩小,且联合组明显低于单一组,表明PRP联合MSCs用于ACL重建术可明显缩小胫骨隧道,促进腱骨愈合,且疗效优于单独使用PRP,这与两者治疗方式有关,PRP、MSCs通过关节腔直接注入,可与损伤部位直接接触,使释放的细胞因子直接作用于腱骨界面[17],加速腱骨愈合。此外PRP中的PDGF可以促进MSCs的分泌,加速MSCs向肌腱细胞分裂,使MSCs在骨道内大量增殖及分化[18],加速了腱骨愈合过程。腱骨愈合的效果还可通过膝关节功能反映,Lysholm评分、IKDC评分是评价膝关节功能的标准[19-20],得分越高表明膝关节功能越好。本研究显示,术后两组患者Lysholm评分、IKDC评分均明显升高,且联合组均明显高于单一组,表明PRP联合MSCs改善膝关节功能更加显著。
综上所述,PRP联合MSCs可明显加快ACL重建术后腱骨愈合,改善膝关节功能,较单一使用PRP具有显著优势,值得临床推广应用。
[1]Noyes FR,Huser LE,Levy MS.Rotational knee instability in ACL-deficient knees:role of the anterolateral ligament and iliotibial band as defined by tibiofemoral compartment translations and rotations[J].Journal of Bone&Joint Surgery American Volume,2017,99(4):305.doi:10.2106/JBJS.16.00199.
[2]李雁,姜兆伟,赵兴海,等.关节镜下前交叉韧带重建术股骨侧2种不同固定方式的疗效分析[J].中国骨与关节损伤杂志,2017,32(6):636-638.doi:10.7531/j.issn.1672-9935.2017.06.028.
[3]郑晓佐,李彤,王娟,等.异体肌腱重建前交叉韧带术后临床效果及关节镜下再探查分析[J].中国矫形外科杂志,2017,25(8):695-699.doi:10.3977/j.issn.1005-8478.2017.08.05.
[4]张明宇,张宪,杨镇,等.PRP明胶海绵复合物在前交叉韧带重建术后腱骨愈合的作用[J].中国矫形外科杂志,2017,25(8):737-742.doi:10.3977/j.issn.1005-8478.2017.08.13.
[5]赵亮,韩长旭,任逸众.前交叉韧带损伤与干细胞的治疗[J].中国组织工程研究,2017,21(21):3420-3425.doi:10.3969/j.issn.2095-4344.2017.21.023.
[6]Bonanzinga T,SignorelliC,GrassiA,et al.Kinematics of ACL and anterolateral ligament.Part II:anterolateral and anterior cruciate ligament reconstruction[J].Knee Surg Sports Traumatol Arthrosc,2017,25(4):1062-1067.doi:10.1007/s00167-017-4496-8.
[7]李林立,董有海.前交叉韧带重建术后骨隧道愈合研究进展[J].国际骨科学杂志,2016,37(1):25-30.doi:10.3969/j.issn.1673-7083.2016.01.007.
[8]刘鹏鹤,代志鹏,赵甲军,等.自体血纤维蛋白凝块对前交叉韧带重建术后腱-骨愈合影响的临床研究[J].中国修复重建外科杂志,2017,31(7):799-804.doi:10.7507/1002-1892.201701089.
[9]杨自权,冯军宇,张晨,等.前交叉韧带重建术后康复期应用透明质酸钠凝胶的疗效分析[J].中国骨伤,2016,29(4):311-315.doi:10.3969/j.issn.1003-0034.2016.04.005.
[10]张凤军,王晓峰,巴昭臣,等.单束与双束异体肌腱重建前交叉韧带[J].中国矫形外科杂志,2017,25(12):1102-1107.doi:10.3977/j.issn.1005-8478.2017.12.10.
[11]刘铭,王宇,刘欣伟,等.脂肪干细胞移植对兔前交叉韧带损伤的修复作用及其机制[J].山东医药,2016,56(48):28-30.doi:10.3969/j.issn.1002-266X.2016.48.008.
[12]秦豪,李晓,谭海涛.富血小板血浆应用于前交叉韧带重建后腱骨愈合的研究进展[J].广西医科大学学报,2017,34(5):792-794.doi:10.16190/j.cnki.45-1211/r.2017.05.043.
[13]Dragoo JL,Braun HJ,Durham JL,et al.Comparison of the Acute inflammatory response of two commercial platelet-rich plasma systems in healthy rabbit tendons[J].American Journalof Sports Medicine,2015,40(6):1274.doi:10.1177/0363546512442334.
[14]郝滋辰,吴浩,李阳,等.大鼠骨髓来源与前交叉韧带来源MSCs体外生物学特性比较研究[J].中国修复重建外科杂志,2017,31(4):473-480.doi:10.7507/1002-1892.201611021.
[15]李晓,刘玲英,柴家科.MSCs来源exosomes促进组织损伤修复的研究进展[J].中国修复重建外科杂志,2015,29(2):234-238.doi:10.7507/1002-1892.20150049.
[16]杨军军,徐斌,徐洪港,等.MSCs联合PRP对兔前交叉韧带重建后腱骨愈合的影响[J].安徽医科大学学报,2016,51(3):368-372.doi:10.19405/j.cnki.issn1000-1492.2016.03.013.
[17]张松,张涛,付桂红,等.自体富血小板血浆联合骨髓间充质干细胞治疗长骨干骨折术后骨不连[J].中国组织工程研究,2017,21(29):4716-4721.doi:10.3969/j.issn.2095-4344.2017.29.021.
[18]童茜茜,张云云,周君,等.铁结合蛋白对镉损伤的MSCs分化的保护作用[J].中国食品学报,2017,17(5):10-17.doi:10.16429/j.1009-7848.2017.05.002.
[19]Ateschrang A,Ahmad SS,Sto ckle U,et al.Recovery of ACL function after dynamic intraligamentary stabilization is resultant to restoration of ACL integrity and scar tissue formation[J].Knee Surgery Sports Traumatology Arthroscopy Official Journal of the Esska,2018,26(2):589-595.doi:10.1007/s00167-017-4656-x.
[20]Meister M,Koch J,Amsler F,et al.ACL suturing using dynamic intraligamentary stabilisation showing good clinical outcome but a high reoperation rate:a retrospective independent study[J].Knee Surgery Sports Traumatology Arthroscopy,2018,26(2):655-659.doi:10.1007/s00167-017-4726-0.

