利拉鲁肽早期干预对高脂饮食大鼠代谢的影响
王良雪 李春盈 洪莹 郑超
随着西方高热量生活方式的传播,近几十年来肥胖的患病率急剧增加,是一个非常普遍的全球公共健康问题。目前,改变生活方式和运动干预被视为肥胖的预防和治疗的基石,但许多患者很难改变生活方式;减肥手术虽然有效,但有手术相关风险和体重反弹的可能性,许多减肥药物因为严重的不良反应已经退出市场。胰高血糖素样肽-1(GLP-1)是一种肠道内分泌L细胞分泌的促胰岛素分泌的激素,葡萄糖依赖性促进胰腺β细胞分泌胰岛素,减慢胃排空和控制食物摄入量,除了对食欲的影响外,GLP-1还可能在能量代谢中起作用。然而,在生理条件下,内源性GLP-1的活性很快被二肽基肽酶IV(DPP-4)降解[1]。利拉鲁肽是一种GLP-1受体激动剂,2014年9月,美国食品药物管理局(FDA)批准利拉鲁肽3mg用于治疗肥胖,在此之前,低剂量利拉鲁肽1.8mg已被广泛用于治疗2型糖尿病,且已经证明利拉鲁肽治疗非糖尿病肥胖患者具有减肥和改善心血管的作用[2]。笔者通过建立高脂喂养大鼠模型,旨在观察利拉鲁肽早期干预对高脂喂养大鼠代谢的影响。
1 材料和方法
1.1 材料 60%脂肪的高脂饲料购自江苏美迪森股份有限公司;利拉鲁肽购自丹麦诺和诺德公司;大鼠血清TG、TC、GLP-1的ELISA试剂盒购自上海博蕴生物科技有限公司;麻醉药戊巴比妥钠购自美国Sigma公司;GLP-1受体一抗购自英国Biorbyt公司,CD34一抗购自英国Abcam公司。
1.2 动物 SPF级6周龄雄性SD大鼠18只,体重(160±10)g,购自上海斯莱克实验动物有限责任公司,饲养在温州医科大学实验动物中心。实验动物合格证编号为XI504106,实验动物获得伦理委员会批准。适应性喂养1周后随机分为正常饮食(ND组)、高脂饮食(HFD组)、高脂饮食的同时利拉鲁肽干预(Lira组),每组6只,利拉鲁肽皮下注射200μg/kg,1次/d,高脂组皮下注射等量0.9%氯化钠注射液。每周记录进食量、体重、每2周测定血糖,16周行葡萄糖耐量实验。18周末行胰岛素钳夹实验,胰岛素钳夹实验结束后颈动脉取血、心脏灌流法处死、取组织。
1.3 方法
1.3.1 总摄食量 1~13周每天记录每组每只大鼠进食量,直至实验结束计算得到每只大鼠总进食量;食物利用率(%)=每只大鼠总体重增长量/每只大鼠总摄食量×100%;脂体比(%)=睾丸与肾周内脏脂肪湿重/总体重×100%。
1.3.2 血清生物化学测定 采用酶联免疫法测定血清TG、TC、GLP-1水平。
1.3.3 肝组织及骨骼肌组织染色 观察每只大鼠取相同部位新鲜肝组织和骨骼肌组织,4%多聚甲醛固定,常规脱水,石蜡包埋,切片,HE染色后镜下观察肝脏脂肪变程度;石蜡切片经脱蜡、脱水、高压抗原修复、5%BSA室温封闭1h,肝组织GLP-1受体一抗4℃孵育过夜,骨骼肌组织CD34一抗4℃孵育过夜,PBS洗3次,5min/次,荧光二抗37℃ 1h,DAPI染核10min,封片镜下观察肝细胞GLP-1受体免疫荧光染色,确定是否有GLP-1受体表达;CD34特异表达于血管内皮细胞,染色结果骨骼肌横切面绿色荧光代表一个血管,观察骨骼肌组织毛细血管密度。
1.3.4 胰岛素敏感性实验 葡萄糖耐量实验:大鼠饥饿12h,测0min空腹血糖,腹腔注射20%的葡萄糖,分别测定15、30、60和90min的血糖水平。胰岛素钳夹实验:18周开始大鼠饥饿15h,腹腔注射1.5%戊巴比妥钠40mg/kg,麻醉平稳20min后迅速完成气管插管,颈外动静脉置管,动脉通过装有肝素生理盐水30U/ml的微量注射泵连接血压仪,监测血流动力学;静脉通过3通管连接2个微量注射泵,分别注射30%的葡萄糖和胰岛素30mU/(kg·min),每10min测定1次颈动脉血糖,葡萄糖速率逐渐增加使血糖波动在基础血糖±10%以内,最后3次稳态葡糖糖输注率的均值作为胰岛素钳夹实验的葡萄糖输注率[GIR,mg/(kg·min)]。
1.4 统计学处理 应用SPSS 21.0统计软件。正态分布的计量资料用 表示,多组间采用单因素方差分析,两两比较方差齐者用Tukey检验,方差不齐者用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3 组大鼠一般状态、肝脏和内脏脂肪情况 3组大鼠全部存活,ND组大鼠毛顺、灵活好动、肝脏红润细腻、睾丸及肾周脂肪少;HFD组大鼠毛色黄有光泽、温顺不喜动、肝脏黄腻且切面呈颗粒状、睾丸及肾周脂肪堆积;Lira组大鼠的一般情况与ND组相似。
2.2 3 组大鼠摄食量、食物利用率、体重、脂体比的比较由于正常饲料干爽,高脂饲料油腻湿润,两者质量及性状不一样,两种饲料之间摄食量与食物利用率的比较没有意义。HFD组大鼠体重和脂体比分别增加了19%、89%,与ND组比较差异均有统计学意义(均P<0.05);Lira组大鼠体重和脂体比与ND组均无统计学差异(均P>0.05);HFD组大鼠摄食量与食物利用率显著高于Lira组(P<0.05),详见表 1。
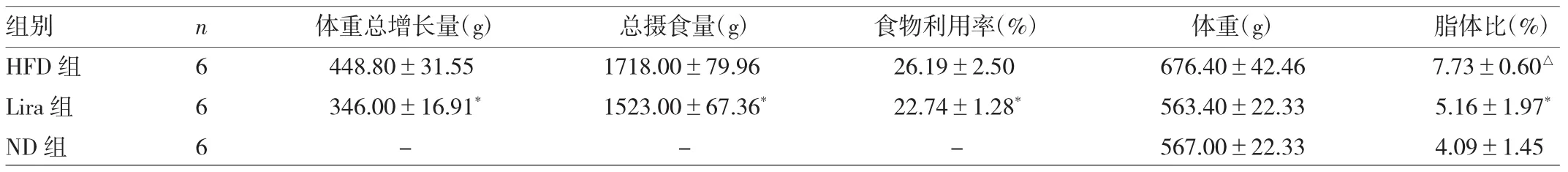
表1 3组大鼠摄食量、食物利用率、体重、脂体比的比较
2.3 大鼠血脂和血清GLP-1浓度的变化 与ND组相比,HFD组大鼠血清TG、TC显著升高,差异均有统计学意义(均P<0.05);与HFD组相比,Lira组大鼠血清TG、TC显著下降,GLP-1浓度显著增加,差异均有统计学意义(均 P<0.05),详见表 2。
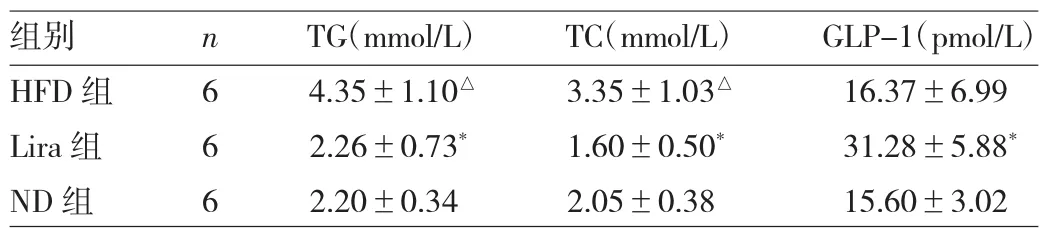
表2 3组大鼠血清学结果的比较
2.4 3 组大鼠葡萄糖耐量及胰岛素钳夹实验结果的比较 与ND组相比,HFD组大鼠葡萄糖耐量实验AUC显著增高,胰岛素钳夹实验GIR显著下降,差异均有统计学意义(均P<0.05)。Lira组大鼠葡萄糖耐量正常,GIR与ND组相比未发生显著性变化,详见图1-2。
2.5 3 组大鼠肝组织切片观察 ND组大鼠肝组织结构清晰,肝细胞呈放射状有序排列,未见脂肪空泡;HFD组大鼠肝组织结构紊乱,肝细胞杂乱无章,布满脂肪空泡;Lira组大鼠与正常组类似,未发生明显变化。肝组织存在GLP-1受体。详见图3-4(插页)。
2.6 3 组大鼠骨骼肌血管染色观察 与ND组相比,HFD组大鼠骨骼肌毛细血管密度(镜下毛细血管数/肌纤维数)显著下降,差异均有统计学意义(均P<0.05)。利拉鲁肽干预保留了骨骼肌的毛细血管密度。详见图5。
3 讨论
人类每天皮下注射1.8mg的利拉鲁肽,食物的摄入量与对照组相比平均减少18%[3],与本研究一致,在1~13周,与高脂组相比,利拉鲁肽组大鼠食物摄入平均减少约11.4%,最终高脂组与利拉鲁肽组体重比较差异有统计意义(P<0.05)。利拉鲁肽一方面延缓胃排空增加饱腹感,另一方面通过肠脑轴的摄食中枢减少食欲。脑干尾部的孤束核是调节能量平衡的关键核,孤束核作为循环神经内分泌因子的传感器,是大脑中接收和处理胃肠道产生迷走神经介导的饱食信号的第一站,最新研究表明,孤束核的星形胶质细胞不仅结合、内化GLP-1受体激动剂,并对其有相应的信号反应,孤束核星形胶质细胞介导GLP-1受体信号的能量平衡[4]。
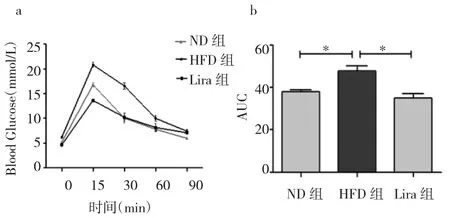
图1 葡萄糖耐量实验(a:腹腔注射葡萄糖耐量实验动态过程;b:葡萄糖耐量实验AUC,*P<0.01)
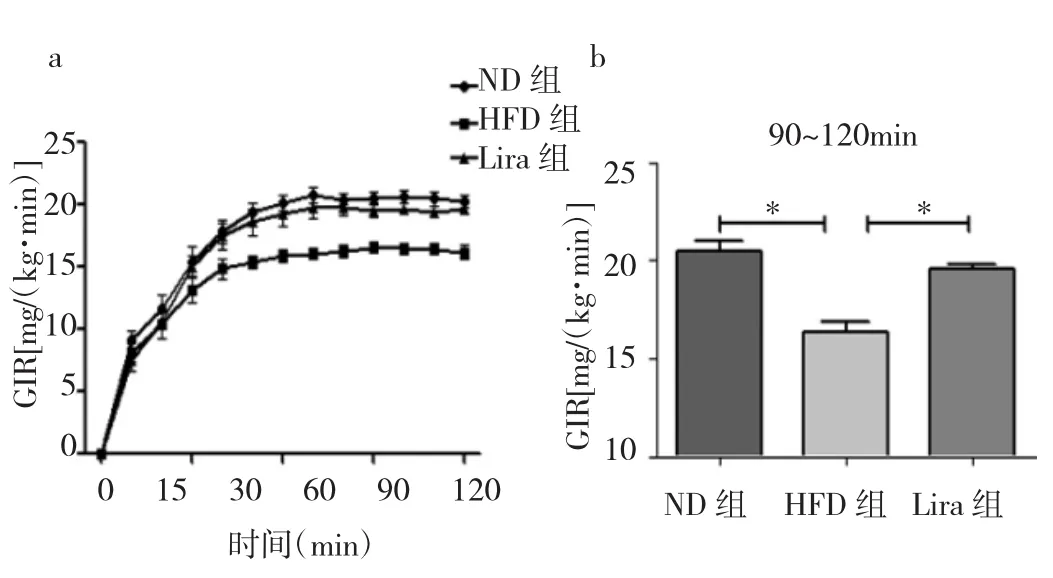
图2 胰岛素钳夹实验(a:胰岛素钳夹实验动态过程;b:胰岛素钳夹的葡萄糖输注率GIR,*P<0.01)
Lira组大鼠的食物利用率显著低于比HFD组,除了对食欲的影响外,GLP-1还可能在能量代谢中起作用。已有研究证明人类空腹血浆GLP-1浓度越高,静息能量消耗和脂肪氧化率越高,对啮齿动物的研究表明,侧脑室注射GLP-1可能增加能量消耗和改变燃料的利用率,有利于脂肪和碳水化合物的氧化。本研究结果显示,Lira组大鼠食物利用率降低、血浆GLP-1水平显著升高(P<0.05),可能与利拉鲁肽增加能量代谢率有关。在哺乳动物主要有两种脂肪组织,白色脂肪组织(WAT)和棕色脂肪组织(BAT)。棕色脂肪组织通过线粒体呼吸链中的解偶联蛋白1(UCP1)专门提供产热,经过多年的研究,第三种脂肪细胞既褐色脂肪已在啮齿类动物和人类的白色脂肪组织中发现,类似于棕色脂肪细胞表达UCP1和其他产热的基因消耗能量[5]。由于褐色脂肪组织产热性,能越来越多的科学研究都集中于白色脂肪组织褐变,促进白色脂肪组织(WAT)获得棕色脂肪组织的特点是减少肥胖的一种有效方法。已报道,在小鼠侧脑室快速注射利拉鲁肽活跃棕色脂肪组织产热(BAT)和白色脂肪组织褐变,显著减少白色脂肪细胞的大小[5]。
HFD组大鼠脂体比、血清TG、TC比ND组显著增加;肝组织病理观察脂肪肝明显,Lira组大鼠脂体比、血清TG和TC显著减少,脂肪未发生明显病理变化。除了进食量和能量代谢,利拉鲁肽可以改善血脂谱和肝脏参数,已经证实,利拉鲁肽在离体实验中,减少人原代肝细胞脂肪酸的从头合成,从而减少肝细胞脂肪变性[6],且通过增加肝脏腺苷酸活化蛋白激酶磷酸化(AMPK)促进脂肪酸氧化和抑制脂肪酸的合成[7-8]。本研究结果也证实肝组织的确存在GLP-1受体。
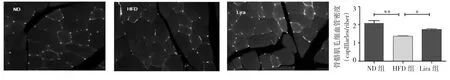
图5 骨骼肌毛细血管密度(*P<0.05,**P<0.01)
解释外周组织胰岛素抵抗的潜在机制是理解2型糖尿病病因的基石之一,骨骼肌对胰岛素的敏感性逐渐降低,被认为是疾病过程中的主要事件。胰岛素介导的葡萄糖摄取在骨骼肌占80%左右,从而肌肉葡萄糖摄取受损是胰岛素抵抗的发病机制的重要因素[9]。有证据表明胰岛素跨内皮细胞转移到骨骼肌是胰岛素刺激肌肉葡萄糖摄取的限速步骤。因此,减少肌肉血流量或毛细血管密度与胰岛素抵抗有关。高脂大鼠微循环可能存在结构或功能缺陷,导致肌肉毛细血管灌注减少。骨骼肌胰岛素抵抗实际上是由于肌肉和脉管系统的缺陷,影响葡萄糖的输送和提取。在本实验中,利拉鲁肽保留高脂喂养大鼠骨骼肌中毛细血管密度,改善胰岛素抵抗,虽然Lira组大鼠的胰岛素敏感性与控制体重有关,但是骨骼肌毛细血管的密度也起着一定的作用[10]。
总之,高脂饮食大鼠利拉鲁肽早期干预可以显著控制体重,改善脂质代谢和脂肪肝的发生、发展,葡萄糖依赖性控制血糖且维持胰岛素敏感性,随着高热量饮食生活方式的盛行,急剧增加的肥胖患病率给全球带来了巨大的经济负担,利拉鲁肽对摄食、能量代谢、脂肪代谢、胰岛素敏感性等多方面的影响,是临床肥胖患者早期干预的一种潜在治疗药物。
[1]Liu Y,Wei R,Hong TP.Potential roles of glucagon-like peptide-1-based therapies in treating non-alcoholic fatty liver disease[J].World journalofgastroenterology,2014,20(27):9090-9097.doi:10.1016/S0140-6736(14)60460-8.
[2]Krentz AJ,Fujioka K,Hompesch M.Evolution of pharmacological obesity treatments:focus on adverse side-effect profiles[J].Diabetes,obesity&metabolism,2016,18(6):558-570.doi:10.1111/dom.12657.
[3]Flint A,Kapitza C,Zdravkovic M.The once-daily human GLP-1 analogue liraglutide impacts appetite and energy intake in patients with type 2 diabetes after short-term treatment[J].Diabetes,obesity&metabolism,2013,15(10):958-962.doi:10.1111/dom.12108.
[4]Reiner DJ,Mietlicki-Baase EG,McGrath LE,et al.Astrocytes Regulate GLP-1 Receptor-Mediated Effects on Energy Balance[J].The Journalof neuroscience:the official journal of the Society for Neuroscience,2016,36(12):3531-3540.doi:10.1523/JNEUROSCI.3579-15.2016.
[5]Zhu E,Yang Y,Zhang J,et al.Liraglutide suppresses obesity and induces brown fat-like phenotype via Soluble Guanylyl Cyclase mediated pathway in vivo and in vitro[J].Oncotarget,2016,7(49):81077-81089.doi:10.18632/oncotarget.13189.
[6]Armstrong MJ,Hull D,Guo K,et al.Glucagon-like peptide 1 decreases lipotoxicity in non-alcoholic steatohepatitis[J].Journal of hepatology,2016,64(2):399-408.doi:10.1016/j.jhep.2015.08.038.
[7]Castao D,Larequi E,Belza I,et al.Cardiotrophin-1 eliminates hepatic steatosis in obese mice by mechanisms involving AMPK activation[J].Journal of hepatology,2014,60(5):1017-1025.doi:10.1016/j.jhep.2013.12.012.
[8]Yamazaki S,Satoh H,Watanabe T.Liraglutide enhances insulin sensitivity by activating AMP-activated protein kinase in male Wistar rats[J].Endocrinology,2014,155(9):3288-3301.doi:10.1210/en.2013-2157.
[9]Bonner JS,Lantier L,Hasenour CM,et al.Muscle-specific vascular endothelial growth factor deletion induces muscle capillary rarefaction creating muscle insulin resistance[J].Diabetes,2013,62(2):572-580.doi:10.2337/db12-0354.
[10]ChaiW,Fu Z,Aylor KW,et al.Liraglutide prevents microvascular insulin resistance and preserves muscle capillary density in high-fat diet-fed rats[J].Am J Physiol Endocrinol Metab,2016,311(3):E640-8.doi:10.1152/ajpendo.00205.2016.

