siRNA沉默Msi1表达对宫颈癌Hela细胞增殖、迁移及侵袭的影响
赵芳 许春伟 魏建国 梁文清 吴芬英 王宁
宫颈癌是全球女性第二种最常见的恶性肿瘤,宫颈癌的浸润和转移是肿瘤患者死亡的最主要原因之一。目前宫颈癌的综合治疗尽管包括手术、化疗及放疗等不同手段,但患者的5年生存率仍然未见明显提高[1]。近年来,宫颈癌发病呈年轻化趋势,并且出现易复发及易早期转移的特点,肿瘤一旦发生复发或远处转移,综合治疗效果极差。因此,在目前基因研究的基础上,寻找有效的基因治疗靶点,可能是提高患者预后的关键举措之一。而Msi1是最近才发现的一种特殊的RNA结合蛋白,研究证明Msi1在中枢神经系统的发展和干细胞的生长增殖过程中均发挥着十分重要的作用[2]。近年来多项研究发现Msi1在多种恶性肿瘤中高表达[3-4]。研究认为Msi1基因不仅仅是不同肿瘤的肿瘤干细胞和(或)祖细胞的原始标志物[5],而且在多种肿瘤的发生、发展及恶性转归过程中可能作为一个主控调节者,扮演着十分重要的角色[6]。为此,本实验首先通过RTPCR法检测Msi1在人宫颈癌Hela细胞中的表达情况,然后使用siRNA沉默Msi1的表达,采用四甲基偶氮唑盐(MTT)比色试验、群体倍增时间分析、平皿克隆实验、细胞划痕及Transwell小室侵袭实验等技术方法,研究沉默Msi1基因后对人宫颈癌Hela细胞增殖、迁移及侵袭的影响情况。
1 材料和方法
1.1 材料 人宫颈癌Hela细胞由南华大学肿瘤研究所提供;siRNA片段的设计及合成均由上海锐博生物技术公司完成;转染过程中用到的Lipo2000脂质体转染试剂和Trizol试剂均来自美国Invitrogen公司;FBS购自杭州四季青生物技术有限公司;逆转录试剂盒(ABScriptⅡ cDNA第一链合成试剂盒)购自美国Promega公司;Transwell小室(聚碳酸酯微孔膜孔径8μm)购自美国Costar公司;MTT购自美国Sigma公司。
1.2 细胞培养 Hela细胞常规培养在含10%FBS的RPMI 1640完全培养基中,放置于37℃、5%CO2、95%湿度的细胞培养箱中培养。当Hela细胞在培养瓶底部呈单层片状弥漫生长时,如果融合贴壁达到80%时,则进行常规的细胞传代;Hela细胞传代时常规吸去培养瓶中的陈旧培养液,用0.25%胰蛋白酶及时消化,同时在倒置显微镜下观察,如果发现Hela细胞的胞质回缩,Hela细胞之间的间隙逐渐增大后,立即倒去胰酶,防止细胞过度消化,立刻加入适量含血清的培养液,吹打Hela细胞成单细胞的悬液,然后常规传代分装继续培育,准备足够量的细胞进行后续实验。
1.3 RNA干扰试验 首先配制siRNA-Lipo2000的混合液:(1)轻轻晃荡摇匀脂质体Lipo2000,然后用不含血清的DMEM溶液稀释适量的Lipo2000,放置于室温下孵育3min;(2)用不含血清的DMEM稀释已备好的siRNA片段,最后将稀释的siRNA片段和稀释的Lipo2000轻轻混和摇匀,放置于室温下培养20min,形成siRNA-Lipo2000融合的混和液。siRNA转染细胞:首先取处于对数生长期的Hela细胞按照5×105/孔的原则,接种于6孔板细胞培养器中,每孔中加入不含抗生素的培养基适量,待Hela细胞密度达40%左右时及时进行转染。注意在加入混合液前,应该换用1ml无抗生素、无血清的培养基,将已备好的siRNA-Lipo2000混和液加入6孔中,轻轻摇晃孔板使其与细胞充分混和;最后放置于37℃的CO2培养箱中孵育5h后,更换含有血清的培养基继续培养,观察细胞铺满后备用。
1.4 RT-PCR法检测宫颈癌Hela细胞中Msi1 mRNA表达水平 待6孔板中的Hela细胞转染Msi1 siRNA 24h后收集细胞,按Trizol Rengent试剂盒说明,立即提取Hela细胞的总RNA,利用琼脂糖凝胶电泳实验初步评价RNA的质量。按照Promega两步法试剂盒提供的说明书进行RT-PCR实验。Msi1上游引物为5′-AGCATTATCATTACCACGCTCATTT-3′,下游引物为 3′-GATCCTTCAC CGTCTCGACCCTG-5′,扩增产物为384bp;β-actin 上游引物为 5′-ATCTGGCACCACACCT-3′,下游引物为 5′-CGTCATACTCCTGCTT-3′,产物大小为838bp。最后对RT-PCR的实验产物进行琼脂糖凝胶电泳实验,利用凝胶成像系统分析结果。
1.5 MTT比色试验检测细胞增殖速度 将预备好的Hela细胞1×105/m接种于96孔板细胞培养器,在细胞培养箱中孵育24h后加入siRNA-Lipo2000混合液作为Msi1 siRNA组,同时设4个平行实验孔。另设空白对照组、脂质体组及阴性对照组,空白对照组在后续的实验过程中不添加任何试剂,脂质体组仅添加脂质体试剂,阴性对照组添加FBS作对照实验;分别放置培养箱中孵育 24、48、72h 后,加 MTT 溶液 20μl/孔(5mg/ml)。继续放置于培养箱中孵育3h后终止Hela细胞的培养,吸弃孔内液体,于每孔加入100μl二甲基亚砜,晃荡振荡15min,然后置于酶标仪上测定各孔波长570时的吸光度(OD)值。
1.6 Hela细胞群体倍增时间分析 常规取对数生长期的Hela细胞,按照3×105/孔的原则,将Hela细胞接种于24孔细胞培养板培养6h,待Hela细胞贴壁后更换成无抗生素、无血清的培养基继续培养,实验分组同前,Msi1 siRNA组加入siRNA-Lipo2000混合液。培养6h后,更换成有血清的培养基继续培养,每24h取4复孔细胞计数,连续反复操作96h,然后求其均值及标准差,最后绘制各组Hela细胞的生长曲线。肿瘤细胞群体倍增时间按公式计算:倍增时间=t×lg2/lg(Nt/N0)(Nt为t时间的细胞数,N0为初种细胞数)。
1.7 平皿克隆实验检测细胞克隆时间分析 常规取对数生长期的Hela细胞接种于24孔细胞培养板中,待细胞基本完全贴壁后,更换用无血清、无抗生素的培养基继续培养,实验分组同前,Msi1 siRNA组中加入均匀的siRNA-Lipo2000混合液,继续培养6h后,更换成含有血清的培养基继续孵育,每隔48h重复以上操作。按照以上培养原则继续培养Hela细胞 14d,最后弃去培养液,用0.01mol/L PBS浸洗3次后放于95%的乙醇溶液中固定8min,最后弃去固定液,然后加入适量甲基紫染色15min,弃去甲基紫染液,放置于空气中充分干燥。肉眼观察不同实验组Hela细胞的克隆形成情况,并用数码相机拍照。
1.8 细胞划痕实验对细胞迁移能力分析 将Hela细胞按照5×105/孔的原则,接种于6孔细胞培养板中,按照以上方法进行转染Hela细胞,并进行Hela细胞的培养,当细胞长至95%左右时,用10μl的Eppendorf Tip头在单层细胞上垂直划过,形成一个均匀的创伤通道。并利用新鲜配置的PBS溶液冲洗细胞3次后继续进行培养。24h后在倒置显微镜下观察伤口通道的愈合情况。用Image-Pro Plus 6.0软件计算划痕宽度。计算公式:迁移距离=初次划痕创伤通道之间的距离-24h后创伤通道之间的距离,即迁移距离=原划痕宽度-现划痕宽度,迁移率=(原划痕宽度-现划痕宽度)/原划痕宽度。
1.9 细胞侵袭实验对细胞侵袭能力分析 首先将无血清的RPMI 1640培养基和10mg/ml的Matrigel以5:1的比例均匀充分混合后,以平均每孔30μl均匀平铺在Transwell小室的聚碳酸酯微孔膜上制作人工基底膜,然后置于细胞超净台内开启紫外灯照射12h。在Hela细胞进行Transwell小室侵袭实验前30min时,必须重新成胶。将Msi1 siRNA组、空白对照组、脂质体组及阴性对照组的Hela细胞悬液400μl分别接种到成胶的Transwell小室内,然后将小室放入24孔细胞培养板;在24孔板内加入含趋化因子的培养基500μl,然后再放置于37℃,5%CO2饱和湿度条件下培养箱中培养24h;最后将小室中的培养液迅速抽出,用棉签擦净上室的细胞,膜下层的Hela细胞再用95%乙醇溶液固定30min后进行结晶紫溶液染色,最后在倒置显微镜下计数下层的Hela细胞数。计算公式为:侵袭抑制率=[(对照组穿膜细胞数-处理组穿膜细胞数)/对照组穿膜细数]×100%。
1.10 统计学处理 采用SPSS 16.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组宫颈癌Hela细胞中Msil mRNA表达水平比较 空白对照组、脂质体组和阴性对照组3组之间Msi1 mRNA表达水平比较差异均无统计学意义(均P>0.05),而Msi1 siRNA组与空白对照组、脂质体组和阴性对照组Msi1 mRNA表达水平比较,差异均有统计学意义(均P<0.05)。转染24h后空白对照组、脂质体组、阴性对照组和Msi1 siRNA组细胞中Msil mRNA表达情况见图1。

图1 各组宫颈癌Hela细胞中Msi1 mRNA表达水平比较(a:电泳图显示各组Msi1 mRNA表达水平;b:柱状图显示Msi1 mRNA表达水平;与Msi1 siRNA组比较,*P<0.05)
2.2 Msi1 siRNA对宫颈癌Hela细胞增殖的抑制作用Msi1 siRNA 转染宫颈癌Hela细胞24、48、72h后,细胞的增殖速度显著降低,Msi1 siRNA组与空白对照组、脂质体组和阴性对照组比较差异均有统计学意义(均P<0.05),脂质体组、空白对照组和阴性对照组3组之间比较差异均无统计学意义(均P>0.05),见表1。
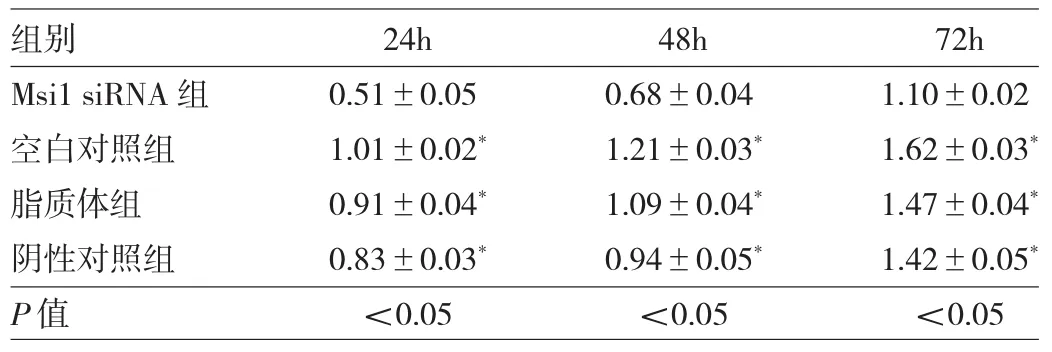
表1 Msi1 siRNA转染Hela细胞后的OD值变化
2.3 Msi1 siRNA对Hela细胞群体倍增时间的影响Msi1 siRNA组群体倍增时间较空白对照组、脂质体组和阴性对照组延长,差异均有统计学意义(均P<0.05),见表2。

表2 Msi1 siRNA对Hela细胞群体倍增时间的影响
2.4 平皿克隆实验分析Msi1 siRNA对宫颈癌Hela细胞形成克隆能力的影响 与空白对照组、脂质体组和阴性对照组比较,Msi1 siRNA组Hela细胞的生长速度明显减慢,形成克隆的能力明显下降,而此结果与MTT结果保持一致,表明Msi1 siRNA作用于Hela细胞后,细胞生长增殖明显受到抑制,见图2(插页)。
2.5 Msi1 siRNA对宫颈癌Hela细胞迁移的影响Msi1 siRNA组Hela细胞迁移率均低于空白对照组、脂质体组和阴性对照组(均P<0.05),见表3。
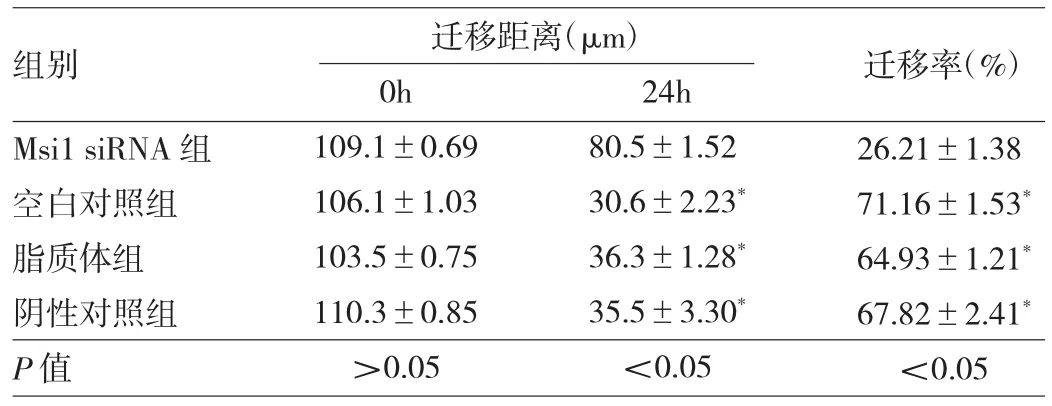
表3 Msi1 siRNA对宫颈癌Hela细胞迁移的影响
2.6 Msi1 siRNA对宫颈癌Hela细胞侵袭的影响 宫颈癌Hela细胞转染Msi1 siRNA后,Hela细胞穿透聚碳酸脂膜的细胞均数均明显低于空白对照组、脂质体组和阴性对照组(均P<0.05),侵袭抑制率均明显高于空白对照组、脂质体组和阴性对照组(均P<0.05),见表4。
3 讨论
全球范围内宫颈癌是女性患者中发病率仅次于乳腺癌而位居第二位的恶性肿瘤,近年来宫颈癌的发病年龄一度呈现年轻化趋势,研究表明宫颈癌的发生也是一个多步骤、多基因参与的复杂过程,从不典型增生、原位癌到浸润性癌,经历了一个漫长的过程。近年来国外研究发现Msi1基因与多种恶性肿瘤的发生、发展、侵袭、转移等恶性行为密切相关[1-4]。
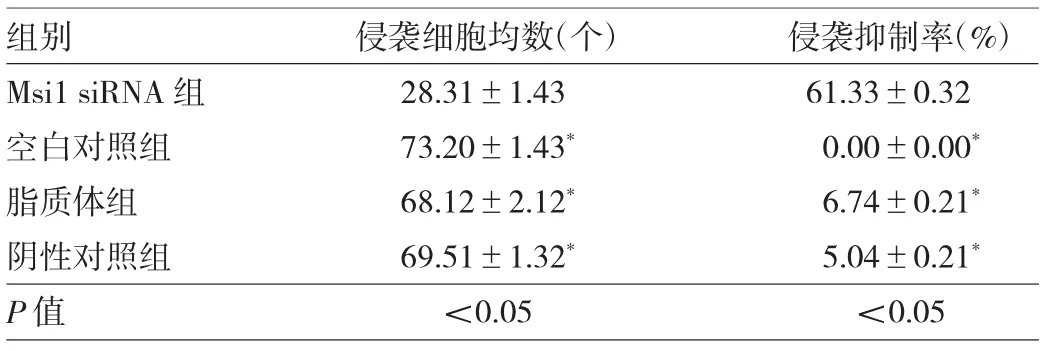
表4 Msi1 siRNA对宫颈癌Hela细胞侵袭的影响
Msi1是一类在神经系统发育过程中特异表达的RNA结合蛋白,其在线虫[7]、果蝇[8-9]的表达有较高的保守性和特殊性。研究表明哺乳动物中包含Msi1和Msi2两种结合蛋白,分别由Msi1和Msi2基因编码[10-11]。Glazer等[12]研究发现Msi1基因不仅仅可作为肿瘤干细胞的标志物而影响神经发育,它还可能在肿瘤的发生、发展、侵袭、转移过程中起十分重要的作用。有研究表明Msi1表达产物在胶质母细胞瘤、神经胶质瘤、星形细胞瘤、视网膜母细胞瘤、结肠癌、肝癌、胃癌、食管癌等多种恶性肿瘤中高表达,其通过促进恶性肿瘤细胞的增殖、抑制恶性肿瘤细胞的凋亡发挥作用[13-18]。目前Msi1在各种肿瘤细胞中的功能尚未被阐述清楚,有研究表明Msi1可以通过增强Notch通路的活性,并维护周期性依赖性蛋白激酶抑制剂p21CIP1的功能,从而达到维持肿瘤干细胞自我更新的能力,进一步调节其生长发育[19]。
本实验将Msi1 siRNA瞬时转染到人宫颈癌Hela细胞后,通过RT-PCR实验发现Msi1基因的表达水平显著下降;另外通过MTT实验进一步发现分别转染宫颈癌Hela细胞24、48、72h后,与空白对照组、脂质体组和阴性对照组相比,Msi1 siRNA组Hela细胞的增殖速度明显降低;同时Hela细胞的群体倍增时间与其他各组相比明显延长,表明宫颈癌Hela细胞经Msi1 siRNA作用后,其细胞增殖周期延长,从而使得Hela细胞增殖速度明显减慢。同样平皿克隆实验结果也表明Msi1 siRNA组Hela细胞的生长明显减慢,形成克隆的能力显著下降。同时笔者通过细胞划痕实验和细胞侵袭实验分别显示:Msi1 siRNA组Hela细胞迁移和侵袭能力都明显下降,以上结果表明沉默Msi1基因不仅可明显抑制Hela细胞的生长和增殖,而且还可以明显降低Hela细胞的迁移和侵袭能力。
综上所述,Msi1基因的表达与人宫颈癌Hela细胞的增殖、迁移及侵袭有着十分密切的关系。沉默人宫颈癌Hela细胞中Msi1基因的表达,会对Hela细胞的增殖、迁移及侵袭有着负性调节的作用,这一发现可能为治疗宫颈癌提供新的分子治疗靶点,并进一步启发抗肿瘤新药的研制。但是,肿瘤的发生、发展往往是多因素、多步骤共同启动进展的过程,并受到多种因子及涉及不同信号通路途径的调节过程,Msi1基因能否作为一个恰当的关键点从而被用于宫颈癌的分子靶向治疗仍然有待于进一步研究。
[1]Katanyoo K.Comparing treatment outcomes of stage IIIB cervical cancer patients between those with and without lower third of vaginalinvasion[J].J GynecolOncol,2017,28(6):e79.doi:10.3802/jgo.2017.28.e79.
[2]Kawase S,ImaiT,Miyauchi-Hara C,et al.Identification of a novel intronic enhancer responsible for the transcriptional regulation of musashi1 in neural stem/progenitor cells[J].Mol Brain,2011,4:14.doi:10.1186/1756-6606-4-14.
[3]Gong P,Wang Y,Gao Y,et al.Msi1 promotes tumor progression by epithelial-to-mesenchymal transition in cervical cancer[J].Hum Pathol,2017,65:53-61.doi:10.1016/j.humpath.
[4]魏建国,赵芳,孙爱静.Msi1 siRNA对人结肠癌SW-480细胞增殖的影响[J].临床与实验病理学杂志,2012,28(2):124-127.doi:10.13315/j.cnki.cjcep.2012.02.028.
[5]Uren PJ,Vo DT,de Araujo PR,etal.RNA-Binding protein musashi1 Is a central regulator of adhesion pathways in glioblastoma[J].Mol Cell Biol,2015,35(17):2965-2978.doi:10.1128/MCB.00410-15.
[6]Chen K,Gao Q,Zhang W,et al.Musashi1 regulates survival of hepatoma cell lines by activation of Wnt signalling pathway[J].Liver Int,2015,35(3):986-998.doi:10.1111/liv.12458.
[7]Yoda A,Kouike H,Okano H,et al.Components of the transcriptionalMediator complex are required for asymmol/Letric cell division in C.elegans[J].Development,2005,132(8):1885-1893.doi:10.1242/dev.01776.
[8]Siddall NA,McLaughlin EA,Marriner NL,et al.The RNA-binding protein Musashi is required intrinsically to maintain stem cell identity[J].Proc NatlAcad SciUSA,2006,103(22):8402-8407.doi:10.1073/pnas.0600906103.
[9]Nakamura M,Okano H,Blendy JA,et al.Musashi,a neural RNA-binding proteinrequired for Drosophila adult external sensory organ development[J].Neuron,1994,13(1):67-81.
[10]Moghbeli M,Forghanifard MM,Aarabi A,et al.Clinicopathological sex-related relevance of musashi1 mRNA expression in esophageal squamous cell carcinoma patients[J].Pathol Oncol Res,2014,20(2):427-433.doi:10.1007/s12253-013-9712-3.
[11]Kudinov AE,Karanicolas J,Golemis EA,et al.Musashi RNA-binding proteinsascancer driversand novel therapeutic targets[J].Clin Cancer Res,2017,23(9):2143-2153.doi:10.1158/1078-0432.CCR-16-2728.
[12]Glazer RI,Wang XY,Yuan H,et al.Musashi1:A stem cellmarker no longer in search of a function[J].Cell Cycle,2008,7(17):2635-2639.doi:10.4161/cc.7.17.6522.
[13]Ying M,Wang S,Sang Y,et al.Regulation of glioblastoma stem cells by retinoic acid:role for Notch pathway inhibition[J].Oncogene,2011,30(31):3454-3467.doi:10.1038/onc.2011.58.
[14]魏建国,赵芳,孙爱静.Msi1 siRNA对人结肠癌SW-480细胞迁移和侵袭能力的影响[J].医学研究杂志,2012,41(12):73-76.
[15]王燕,章建国,张曙,等.Msi1基因沉默对人肝癌HepG2细胞的影响[J].交通医学,2014,28(2):115-118.
[16]Chen HY,Lin LT,Wang ML,et al.Musashi-1 enhances glioblastoma cell migration and cytoskeletal dynamics through translational inhibition of tensin3[J].Sci Rep,2017,7(1):8710.doi:10.1038/s41598-017-09504-7.
[17]Qin G,Lian J,Yue D,et al.Musashi1,a potential prognostic marker in esophageal squamous cell carcinoma[J].Oncol Rep,2017,38(3):1724-1732.doi:10.3892/or.2017.5809.
[18]Ma L,Xu YL,Ding WJ,et al.Prognostic value of Musashi1 in endometrioid adenocarcinoma[J].Int J Clin Exp Pathol,2015,8(5):4564-4572.
[19]Wang XY,Yin Y,Yuan H,et al.Musashi1 modulates mammary progenitor cellexpansion through proliferin-mediated activation of the Wnt and Notch pathways[J].Mol Cell Biol,2008,28(11):3589-3599.doi:10.1128/MCB.00040-08.

