维生素D受体基因启动子甲基化异常与婴儿尿路感染相关性研究
杨建环 王德选 陈敏广 胡小涵
尿路感染是婴幼儿时期最常见的发热性疾病之一,约2%的男孩和8%的女孩在6岁内曾患过急性尿路感染,反复的尿路感染可引起肾瘢痕形成、高血压、肾功能不全等[1]。维生素D受体(vitamin D receptor,VDR)是核受体超家族成员之一,在哺乳动物中几乎所有组织均表达VDR[2]。维生素D3/VDR信号涉及机体的矿物质代谢和骨稳态,调节机体的生长发育,并在癌症预防及调节免疫功能等方面发挥重要作用[3-4]。
DNA甲基化是最早发现的表观遗传修饰途径之一,而DNA甲基化转移酶(DNA methyltransferase,DNMTs)参与了DNA甲基化过程[5]。基因启动子区域和增强子区域CpG岛的甲基化可以使一些转录因子无法与DNA相结合,从而抑制基因的转录;而特定基因的低甲基化可导致该基因呈过度表达状态,从而参与疾病的发生和发展过程[6]。研究表明VDR基因启动子甲基化异常可能与某些疾病的发生相关,如乳腺癌患者的VDR基因启动子甲基化异常可能与化疗耐药相关[7]。然而目前国内外有关VDR基因启动子甲基化异常与婴儿尿路感染的相关性研究尚少,因此本研究旨在探讨尿路感染婴儿VDR基因表达变化,同时研究DNA甲基化异常对VDR基因表达的影响。
1 对象和方法
1.1 对象 选择2015年8月至2016年2月在本院儿童肾内科住院的急性尿路感染患儿32例(尿路感染组),年龄1~12个月。入选标准:(1)初发的发热性尿路感染;(2)主要临床症状为发热、喂养困难、呕吐、尿液浑浊、尿臭、排尿哭吵不安、精神萎靡等;(3)白细胞尿或脓尿;(4)肾静态核素显像提示肾盂肾炎。排除标准:(1)合并肾脏或泌尿道先天性畸形的婴儿;(2)合并尿路结石。选择同期本院门诊健康体检婴儿30例作为健康对照组,年龄1~12个月。本研究获得医院伦理委员会批准和患儿家属知情同意。
1.2 VDR、DNMTs mRNA表达水平检测 采用荧光定量PCR法。先用Trizol法提取外周血单个核细胞的总mRNA,逆转录成 cDNA(PrimeScript RT reagent Kit,大连宝生物工程有限公司)。再用SYBR Green荧光定量PCR法检测mRNA的表达水平[FastStart Universal SYBR Green Master(ROX),罗氏(Roche)生物公司],反应条件:95℃预变性5min,然后95℃变性 10s,60℃退火 20s、72℃延伸 20s,共 40 个循环。结果以 2-ΔCT相对定量表示,所有样本均设置复孔。引物合成由上海生工生物有限公司完成,引物序列见表1。

表1 PCR引物序列
1.3 重亚硫酸氢钠测序技术(BSP)检测VDR基因启动子的甲基化水平 提取样本的全血基因组DNA 1ng~2μg,血液基因组DNA提取试剂盒购置天根生化科技(北京)有限公司,操作过程参考说明书。经亚硫酸氢钠处理后[EpiTect bisulfite kit试剂盒,凯杰生物技术(上海)有限公司,操作过程参考说明书],DNA序列中非甲基化的脱氧胞嘧啶(C)均被亚硫酸氢钠转变为脱氧尿嘧啶(U),而甲基化状态下脱氧胞嘧啶(C)不会被亚硫酸氢钠转变。将亚硫酸氢钠处理后的基因组DNA送检上海生工生物有限公司进行BSP分析。尿路感染组和健康对照组各送检12例样本,每例样本检测5个克隆。
1.4 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组VDR mRNA表达水平比较 尿路感染组患儿VDR mRNA表达水平为0.096±0.015,高于健康对照组婴儿的0.046±0.009,两组比较差异有统计学意义(P<0.05),见图 1。

图1 两组VDR mRNA表达水平比较
2.2 两组DNMTs mRNA表达水平比较 尿路感染组患儿DNMT1 mRNA表达水平为0.034±0.006,低于健康对照组婴儿的0.057±0.009,两组比较差异有统计学意义(P<0.05),见图2。尿路感染组患儿 DNMT3a mRNA表达水平为0.056±0.009,健康对照组婴儿为0.072±0.010,两组比较差异无统计学意义(P>0.05),见图3。尿路感染组患儿DNMT3b mRNA表达水平为0.038±0.005,低于健康对照组婴儿的 0.045±0.007,两组比较差异无统计学意义(P>0.05),见图4。
2.3 两组VDR基因甲基化水平比较 BSP检测结果显示,VDR基因片段中共含有13个CpG位点。12例尿路感染组患儿VDR基因启动子的甲基化水平为(0.00±0.00)%,而健康对照组婴儿VDR基因启动子的甲基化水平为(5.31±8.19)%,两组比较差异有统计学意义(P<0.05),提示尿路感染患儿的VDR基因启动子呈低甲基化状态,见图5。
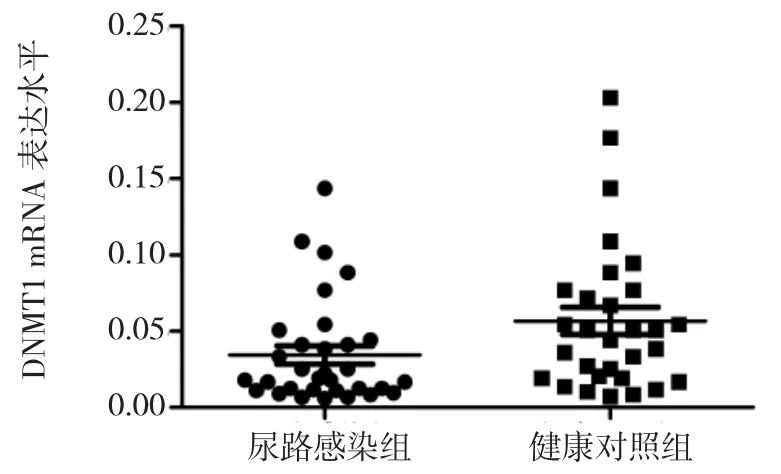
图2 两组DNMT1 mRNA表达水平比较

图3 两组DNMT3a mRNA表达水平比较
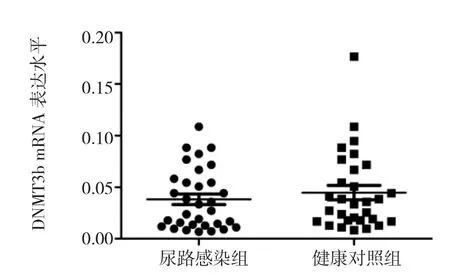
图4 两组DNMT3b mRNA表达水平比较

图5 两组VDR基因甲基化水平比较
3 讨论
VDR是介导维生素D发挥生物学效应的细胞内生物大分子,属于甲状腺激素受体和类固醇激素受体的超家族成员。既往研究发现维生素D缺乏与婴儿尿路感染相关[8],本研究探讨了VDR与婴儿尿路感染的关系,结果提示尿路感染患儿VDR mRNA表达水平升高。这可能与机体通过提高VDR的表达水平,来增强维生素D与VDR的结合,从而弥补尿路感染患儿维生素D不足所带来的效应。
为进一步探讨尿路感染患儿VDR mRNA表达增高的机制,笔者进一步研究了DNA甲基化对VDR基因启动子的调控作用。笔者采用BSP检测VDR启动子的甲基化水平,发现12例尿路感染组患儿VDR基因启动子为完全低甲基化,甲基化水平为(0.00±0.00)%;而健康对照组婴儿VDR基因启动子甲基化水平为(5.31±8.19)%。因此尿路感染患儿VDR基因启动子呈低甲基化状态,导致VDR mRNA表达水平增高,从而影响维生素D与VDR的结合。由此推测尿路感染患儿的VDR基因表达受DNA甲基化水平的影响,DNA低甲基化水平促进VDR基因的表达。
DNA甲基化通常发生在CpG二核苷酸的5′侧胞嘧啶上,而绝大多数CpG位点在细胞的整个生命周期中保持着甲基化状态[9]。CpG岛的位置主要处于基因启动子区域,且CpG岛的甲基化可直接导致相关基因发生转录沉默[10]。既往研究表明VDR基因甲基化异常可能与某些疾病的发生相关,例如乳腺癌患者的VDR基因甲基化异常可能与化疗耐药相关[7]。本研究发现VDR基因甲基化异常与婴儿尿路感染相关。
DNMTs是催化DNA甲基化的主要反应酶,包括DNMT1、DNMT3a、DNMT3b 和 DNMT3L,它们之间相互协调,共同维持基因组DNA的甲基化稳定[11]。在正常成人组织中,DNMT1呈持续性低表达状态,DNMT3a与DNMT3b呈失表达或低表达状态;而在癌细胞中DNMTs呈过度表达。研究发现在子宫内膜样腺癌中,DNMT1、DNMT3b的表达水平比正常组织升高2~4倍[12]。本研究对DNMT1、DNMT3a、DNMT3b mRNA表达水平进行检测,发现尿路感染患儿的DNMT1 mRNA表达水平降低,而DNMT3a、DNMT3b mRNA表达水平无明显差异,提示DNMT1表达水平降低可能与尿路感染患儿VDR基因启动子的低甲基化水平相关。
综上所述,笔者推测尿路感染患儿DNMT1表达水平降低导致VDR基因启动子的低甲基化水平,从而引起VDR mRNA表达水平升高。本研究从表观遗传学水平上探讨了VDR基因表达调控的可能机制,为今后深入研究表观遗传学与VDR基因表达的关系提供理论基础。由于本研究是基于临床的病例对照分析,可能存在样本偏差,今后需要更大的临床样本数及分子生物学实验来验证。
[1]翟荣群.儿童尿路感染相关因素研究新进展[J].中华小儿外科杂志,2015,36(10):796-800.doi:10.3760/cma.j.issn.0253-3006.2015.10.021.
[2]Coleman LA,Mishina M,Thompson M,et al.Age,serum 25-hydroxyvitamin D and vitamin D receptor(VDR)expression and function in peripheral blood mononuclear cells[J].Oncotarget,2016,7(24):35512-35521.doi:10.18632/oncotarget.9398.
[3]Zhu T,Liu TJ,Shi YY,et al.Vitamin D/VDR signaling pathway ameliorates 2,4,6-trinitrobenzene sulfonic acid-induced colitis by inhibiting intestinalepithelialapoptosis[J].Int J MolMed,2015,35(5):1213-1218.doi:10.3892/ijmm.2015.2150.
[4]Slattery ML,Wolff RK,Herrick JS,et al.Calcium,vitamin D,VDR genotypes,and epigenetic and genetic changes in rectal tumors[J].Nutr Cancer,2010,62(4):436-442.doi:10.1080/01635580903441204.
[5]Bird A.DNA methylation patterns and epigenetic memory[J].Genes Dev,2002,16(1):6-21.doi:10.1101/gad.947102.
[6]白剑.DNA甲基化与食管癌的研究进展[J].重庆医学,2016,45(24):3436-3438.doi:10.3969/j.issn.1671-8348.2016.24.044.
[7]Marik R,Fackler M,Gabrielson E,et al.DNA methylation-related vitamin D receptor insensitivity in breast cancer[J].Cancer Biol Ther,2010,10(1):44-53.doi:org/10.4161/cbt.10.1.11994.
[8]Yang J,ChenG,Wang D,etal.Lowserum25-hydroxyvitaminDlevel and risk ofurinary tract infection in infants[J].Medicine(Baltimore),2016,95(27):e4137.doi:10.1097/MD.0000000000004137.
[9]王瑞娴,徐建红.基因组DNA甲基化及组蛋白甲基化[J].遗传,2014,36(3):191-199.doi:10.3724/SP.J.1005.2014.0191.
[10]Tang Y,Jiang S,Gu Y,et al.Promoter DNA methylation analysis reveals a combined diagnosis of CpG-based biomarker for prostate cancer[J].Oncotarget,2017,8(35):58199-58209.doi:10.18632/oncotarget.16437.
[11]Jia D,Jurkowska RZ,Zhang X,et al.Structure of Dnmt3a bound to Dnmt3L suggests a model for de novo DNA methylation[J].Nature,2007,449(7159):248-251.doi:10.1038/nature06146.
[12]Xiong Y,Dowdy SC,Xue A,et al.Opposite alterations of DNA methyltransferase gene expression in endometrioid and serous endometrial cancers[J].Gynecol Oncol,2005,96(3):601-609.doi:https://doi.org/10.1016/j.ygyno.2004.11.047.

