海藻酸钠微囊化JS25噬菌体的制备、表征及其在食品模拟体系中的释放
龙 门,周 卉,谢 文,廖 琪,王 冉*
(1.江苏省农业科学院食品质量安全与检测研究所,江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,农业部农产品质量安全控制技术与标准重点实验室,南京 210014;2.滁州学院生物与食品工程学院,安徽省热敏性物料加工工程技术中心,安徽 滁州 239000)
噬菌体广泛存在于自然界中,烈性噬菌体可感染或裂解细菌,目前已经广泛应用在对人类疾病的治疗方面[1-2]。近年来,通过噬菌体杀菌已经得到了广泛的应用,其中弯曲杆菌[3]、大肠杆菌[4-5]、假单胞菌[6]、热死环丝菌[7]、沙门菌[8]和李斯特菌[9]等均有大量的研究。从食品安全的角度来说,噬菌体是预防和控制一些有害细菌,而不干扰自然生物群落细菌的最佳方式[10-11],噬菌体不仅可以提高食品的安全性,而且也不会改变食物的色、香、味[12],在温度低至1 ℃时仍然能够裂解宿主细胞,可抑制冷藏食品中细菌(特别是嗜冷菌)的生长,并且一旦食品取出置于室温条件下,噬菌体便可进一步控制其增殖。虽然噬菌体具有巨大的应用优势,并且已经取得了广泛的应用,但是由于其保存时间相对较短的特点也限制了在食品、医药领域中的应用范围。研究表明,浮游状态的噬菌体稳定性极差,在室温条件下贮藏6~12 h后即失活,严重制约了其应用范围[13-14]。
微囊化技术是一种常用的活性物质包埋技术,该技术不但可以通过包埋法固定活性物质以提高其稳定性,还可以通过包埋技术调控活性物质的释放速率,以增加活性物质的应用可能性[15-16]。O’Brien等[17]通过功能性油脂微囊粉的加工,极大地促进了其应用可行性及稳定性;Burgain等[18]通过微胶囊成功开发了益生菌的包埋技术,并且应用至工业化生产中。尽管活性物质微囊化技术具有诸多优点,已经在医药、食品包装、生物技术、环境保护等领域得到了广泛的应用,但是该技术并不能实现对活性物质的全部包埋,即在微囊化过程中会导致部分活性物质的损失[19-20]。因此,针对不同活性成分制定合适的微囊化工艺是该技术使用的前提。
JS25噬菌体分离于牛奶厂污水中,属于肌尾噬菌体科噬菌体,具有极强的细菌裂解能力,可以较好地感染并杀死宿主细胞[21];并且该类噬菌体可以应用到食品的重要优势是其没有遗传功能并不能转录细菌DNA,并且可以通过高效价感染杀死宿主细胞[22]。目前国内外对于噬菌体微囊化工艺的研究相对较少,并且针对海藻酸钠微囊化JS25噬菌体及其结构表征的研究鲜见报道。因此,本实验通过海藻酸钠微囊化JS25噬菌体,并对制备的JS25噬菌体微囊粉进行结构表征,通过构建4 种不同的食品模拟体系,建立微囊化JS25噬菌体在不同食品模拟体系中的释放模型,以期为噬菌体在食品非热杀菌的应用中提供技术支持。
1 材料与方法
1.1 材料与试剂
vB_SauM_JS25噬菌体(以下简称JS25噬菌体)由江苏省农科院食品质量安全与检测研究所提供,分离自奶牛场污水;金黄色葡萄球菌ATCC6538 北京陆桥技术有限公司;营养琼脂、营养肉汤培养基、Baird-Parker培养基 青岛新希望生物科技有限公司;MgSO4、CaCl2、柠檬酸钠、碳酸氢钠、海藻酸钠、盐酸(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
LRH-250A生化培养箱 韶关市泰宏医疗器械有限公司;TXQ-LS-50G立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;FA2204B电子天平 上海越平科学仪器有限公司;R-134A型恒温振荡摇床 美国热电公司;JL-1166型激光粒度分布测试仪 成都精新粉体测试设备有限公司;JSM-6510扫描电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 溶液的配制
SM缓冲液:称取硫酸镁2 g、氯化钠5.8 g、溶解于900 mL去离子水中,再加入50 mL 1 mol/L的Tris-HCl溶液,去离子水定容至1 L,121 ℃灭菌20 min,置于4 ℃冰箱中保存备用。
微球破解液:称取柠檬酸钠14.7 g,碳酸氢钠16.8 g,溶于1 L的SM缓冲液中,0.22 μm滤膜过滤除菌,常温保存备用。
1.3.2 海藻酸钠微囊化JS25噬菌体的制备[23-24]
将4 ℃保存的金黄色葡萄球菌噬菌体JS25采用液体增殖法扩增培养。将所需的海藻酸钠溶解于100 mL、50 mmol/L Tris-HCl溶液中(pH 7.5),然后加入噬菌体悬液,搅拌混匀,噬菌体终浓度约为107PFU/mL,真空脱气除去溶液中气泡。将上述溶液用2 mL无菌注射器逐滴滴入所需的CaCl2溶液中形成海藻酸钙凝胶,(20±2)℃静置硬化30 min。过滤收集微球,用去离子水洗涤后,于4 ℃生理盐水中保存待用。将收集到的微球于4 ℃干燥,密封保存。
1.3.3 单因素试验
固定CaCl2添加量2.0 g/100 mL,分别以2.0、2.5、3.0、3.5、4.0、4.5、5.0 g/100 mL的海藻酸钠及按照1.3.2节中的微囊化工艺制备JS25噬菌体微囊粉,分析海藻酸钠添加量对JS25噬菌体包埋率的影响。
固定海藻酸钠添加量为4.0 g/100 mL,分别以0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 g/100 mL的CaCl2溶液按照1.3.2节中的微囊化工艺制备JS25噬菌体微囊粉,分析CaCl2添加量对JS25噬菌体包埋率的影响。
1.3.4 JS25噬菌体微囊粉制备工艺优化
在上述试验的基础上,分别以海藻酸钠添加量(X1)为2.5~4.5 g/100 mL、CaCl2添加量(X2)为1.5~3.5 g/100 mL,通过Design-Expert中心组合设计响应面试验,试验的因素与水平见表1。

表1 响应面试验因素与水平Table1 Coded levels of independent variables used for central composite design
1.3.5 JS25噬菌体微囊粉稳定性的测定
以浮游态JS25噬菌体为对照,分别分析在微囊化前后JS25噬菌体在4 ℃及20 ℃贮藏过程中的效价变化。
1.3.6 JS25噬菌体微囊粉的表征
针对上述实验制备的JS25噬菌体微囊粉,分别通过测定其粒径分布及扫描电子显微镜结果进行表征。
1.3.7 JS25噬菌体微囊粉释放性能的测定
分别分析在不同食品模拟体系中的释放性能,具体食品模拟体系如下[25]:高水分活度食品模拟体系(T1):取105 mL 95%乙醇溶液加去离子水至1 000 mL配成10%乙醇溶液;高醇溶液食品模拟体系(T2):取526 mL 95%乙醇溶液,添加去离子水定容至1 000 mL;水分活度为0.6~0.7的食品模拟体系(T3):取600 mL丙三醇加去离子水至1 000 mL配成60%甘油溶液;脂肪类食品模拟体系(T4):1 000 mL正己烷。
1.3.8 指标的测定
1.3.8.1 JS25噬菌体包埋率[26]测定
取5 g湿微球加入45 mL微球破解液中,室温下溶解3 h后,检测破解液中噬菌体效价,按照下式计算包埋率。对于干燥后的微球,需先在SM缓冲液中37 ℃水化15 min后再破解。

1.3.8.2 粒径测定[27]
采用马尔文纳米粒度基于动态光散射原理测定仪测定JS25噬菌体微囊粉的平均粒径。
1.3.8.3 扫描电子显微镜观察[28]
取适量JS25噬菌体微囊粉,将其用胶黏附于铝制的样品载物台上,再放入真空喷涂仪内进行蒸镀Au/Pd,最终于JSM-6510扫描电子显微镜下观察形态。
1.3.8.4 释放率测定[29]
JS25噬菌体微囊粉释放率为不同模拟液中JS25噬菌体效价与微球裂解液中JS25噬菌体效价的比值。
1.4 数据统计
所有数据利用Microsoft Excel 2010进行统计处理,用SAS 9.2进行ANOVA分析,不同平均值之间利用LSD(least-significant difference)法进行差异显著性检验( ±s,n=3)。
2 结果与分析
2.1 不同处理条件对JS25噬菌体微囊粉包埋率的影响
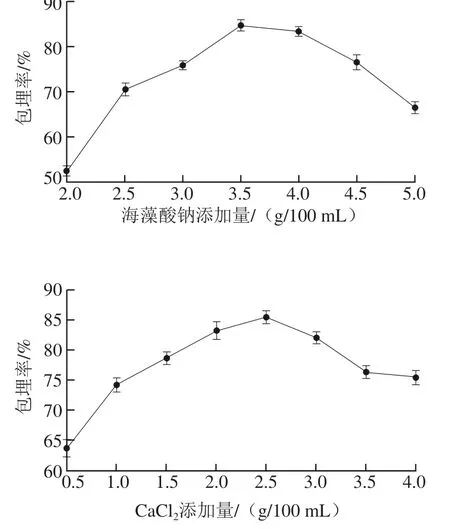
图1 不同处理条件对包埋率的影响Fig.1 Effects of different conditions on microencapsulation eff i ciency
从图1可以看出,随着二者添加量的增加,JS25噬菌体的包埋率均呈现显著的(P<0.05)先增加后降低的趋势。对于海藻酸钠,当添加量在2.5~4.5 g/100 mL时,噬菌体有较高的包埋率。过高的添加量(大于5.0 g/100 mL)增加了溶液凝胶的黏稠度,造成胶体结块,从而降低了噬菌体的包埋率;而过低的添加量(低于2.5 g/100 mL)则降低了胶体的黏稠度,从而不能完成对噬菌体的包埋。而对于CaCl2,当添加量在1.5~3.5 g/100 mL时,噬菌体有较高的包埋率;而过低的添加量不能够完成对胶体颗粒的硬化,过高添加量则可能会导致胶体微球破解,从而降低了JS25噬菌体的包埋率。
2.2 JS25噬菌体微囊粉制备工艺优化结果
如表2所示,海藻酸钠及CaCl2不同添加量对微囊粉的包埋率有显著的影响(P<0.05)。
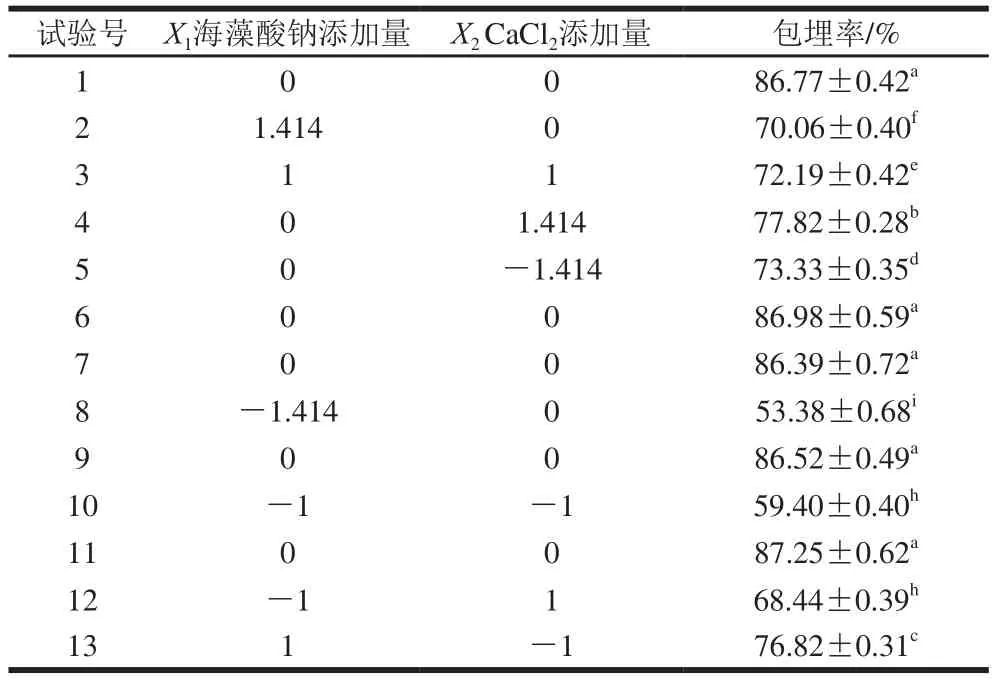
表2 响应面试验设计与结果Table2 Central composite design with experimental values of microencapsulation eff i ciency
利用Design-Expert 8.0.6软件对表2中响应面试验数据进行二次多项式回归分析,建立包埋率对试验中涉及的2 个因素变量的二次多项式的回归方程:Y=-151.98+100.87X1+40.62X2-3.42X1X2-12.39X12-5.46X2
由图2可知,2 个因素对JS25噬菌体的包埋率有明显的交互作用,并且在试验研究范围内,单一因素的临界值(最适添加量)随另外因素的增加呈先升高后降低的趋势,与单因素试验结果相似。
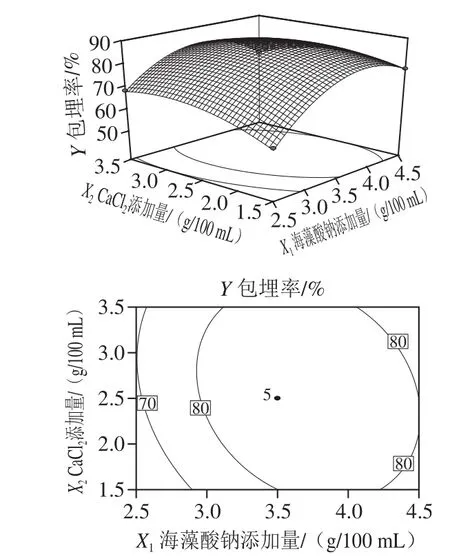
图2 海藻酸钠和CaCl2添加量交互作用结果Fig.2 Response surface and contour plots showing the interactive effects of sodium alginate and CaCl2 on microencapsulation eff i ciency
以JS25噬菌体包埋率最大值为目标值,对构建的二次回归方程进行优化后得到,在海藻酸钠添加量3.72 g/100 mL、CaCl2添加量2.55 g/100 mL条件下,JS25噬菌体存在最大的包埋率为87.43%,以该条件进行验证实验得到,JS25噬菌体包埋率为(88.38±0.38)%,与理论值相对误差小于5%。说明该工艺准确可靠,可以用于JS25噬菌体微囊粉的生产加工。
2.3 JS25噬菌体微囊粉结构表征结果
2.3.1 扫描电子显微镜结果

图3 扫描电子显微镜结果Fig.3 Scanning electron micrographs of sodium alginate and microcapsules
为了进一步表征JS25噬菌体的颗粒形态,通过扫描电子显微镜对JS25噬菌体微囊粉(图3b)及海藻酸钠凝胶(图3a)进行表征后可以看出,微囊粉呈均匀的颗粒状分布,而海藻酸钠胶体大致呈网状、块状结构。说明该方法能有效制备JS25噬菌体微囊粉,并且微囊颗粒分布均匀。
2.3.2 JS25噬菌体微囊粉粒径分布
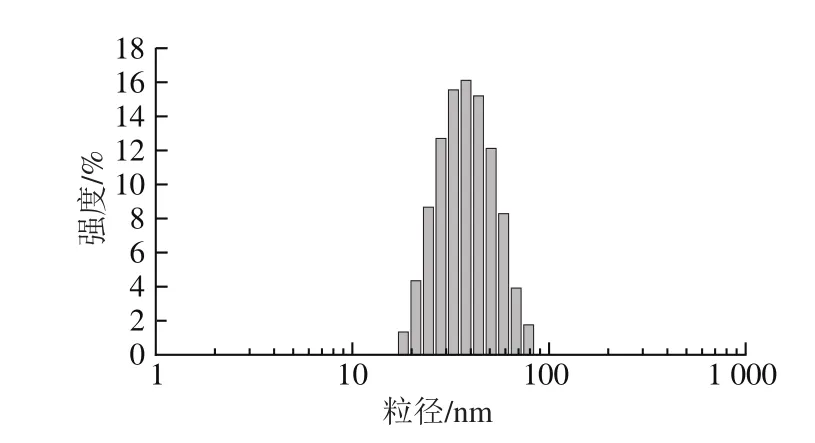
图4 JS25噬菌体粒径分布Fig.4 Size distribution of microcapsules
由图4可知,微囊粉粒径范围在20~90 μm之间,且呈正态分布。其中粒径范围在30~50 μm之间的微囊粉约占60%。说明实验得到的JS25噬菌体微囊粉颗粒均匀,该工艺能有效、均匀地完成对噬菌体的包埋。
2.4 JS25噬菌体微囊粉的稳定性结果
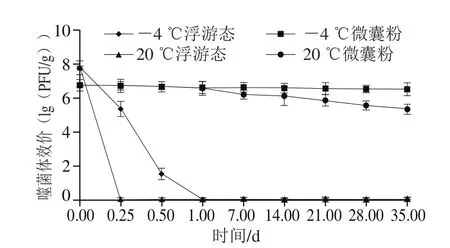
图5 JS25噬菌体微囊粉稳定性结果Fig.5 Stability of microcapsules
从图5可以看出,在4 ℃时,浮游态噬菌体在贮藏1 d时,效价从7.8(lg(PFU/g))迅速降至0(lg(PFU/g)),而JS25噬菌体微囊粉在贮藏35 d后,效价发生轻微降低,但是无显著差异(P>0.05)。在20 ℃时,浮游态噬菌体在6 h后即失活,而噬菌体微囊粉在1 d后呈略微的降低,在贮藏35 d后,效价从6.81(lg(PFU/g))降低至5.41(lg(PFU/g)),仅下降1.4(lg(PFU/g))。说明微囊粉能有效地完成对JS25噬菌体的包埋,并且可维持噬菌体活性至35 d。
2.5 食品模拟体系中JS25噬菌体微囊粉释放结果
释放性能是载药微囊粉的重要性能指标,既可以保持活性物质在体系中不断释放,也可以提高活性物质的稳定性,从而达到长效作用[30]。从图6可以看出,在不同种类的食品模拟体系中,JS25噬菌体释放规律相同,在0~5 min均能够快速地释放,在释放5~8 min后变缓并逐渐稳定。具体表现为:JS25噬菌体在T1体系中有最快的释放速度,在体系中2 min后释放率可达79.35%,随着时间的继续延长,释放率逐渐增加,在6 min后达到98%,随后无显著差异(P>0.05)。另外,JS25噬菌体在T4体系中的释放率在5 min后趋于稳定,可达到91%;在T3体系中在6 min时趋于稳定,释放率可达到84%;在T2体系中释放率最低,在7 min后逐渐稳定,释放率可达75%。
对图6不同食品模拟体系中JS25噬菌体的释放曲线进行数学释放模型拟合,拟合所得方程对应的决定系数R2见表3。从表3可以看出,在T1、T2、T4体系中,噬菌体的释放行为符合一级动力学模型y=a×(1-exp(-bx)),且R2均大于0.9;而在T3体系中,噬菌体的释放行为符合Higuchi模型。综合上述结果可以看出,JS25噬菌体微囊粉在不同食品模拟体系中均有理想的释放效果,并且释放率均高于75%。
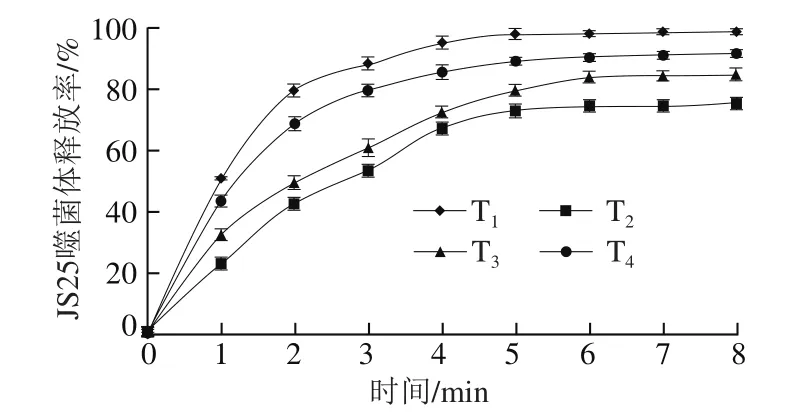
图6 食品模拟体系中JS25噬菌体释放曲线Fig.6 Release curve of microencapsulated phage in food simulant systems

表3 JS25噬菌体释放动力学模型拟合Table3 Kinetic model equations and determination coeff i cients for release of microencapsulated phage
3 结论与讨论
海藻酸钠和CaCl2组成的体系能有效地构建JS25噬菌体微囊粉,表现为随着二者添加量的增加,JS25噬菌体的包埋率呈显著的(P<0.05)先增加后降低的趋势,并且二者对包埋率有显著的交互作用;通过响应面试验优化得到海藻酸钠和CaCl2添加量分别为3.72、2.55 g/100 mL时,JS25噬菌体包埋率可达到最大值88.38%。实验得到的JS25噬菌体微囊粉有稳定的颗粒结构,且颗粒粒径在20~90 μm之间呈正态分布。另外,该状态的噬菌体稳定性显著增加,表现为与浮游态噬菌体失活相比,在4 ℃及20 ℃条件下噬菌体微囊粉贮藏35 d也有较高的效价。JS25噬菌体微囊粉在不同的食品模拟体系中均迅速释放并逐渐稳定,在不同体系中释放8 min后,释放率可达到75%以上;并且其释放规律符合一级动力学模型及Higuchi模型。说明该工艺可以用于对JS25噬菌体的微囊化包埋,以提高JS25噬菌体的稳定性。
JS25噬菌体作为一种天然的杀菌剂,广泛应用于食品保鲜中,可增强食品的安全性和延长食品的保质期,但是天然噬菌体大多为浮游态,极易失活,从而限制了其在食品保鲜加工中的应用。目前,采用海藻酸盐固定天然活性成分已经取得了广泛应用,Diamante等[31]通过海藻酸盐成功包埋了乳酸链球菌,并显著提高了其稳定性;Prisco等[32]通过微囊化技术固定了Lactobacillus reuteri DSM 17938益生菌,增强了其在食物和肠道中的稳定性。但是,在不同的研究成果中得到的微囊粉形态却存在较大的差异,从扫描电子显微镜结果可以看出,通过海藻酸钠-CaCl2体系可以将噬菌体包埋为微米级别的微囊粉,微囊粉呈不规则的圆球状,可能是因为海藻酸钠在挤出阶段或在CaCl2溶液中硬化过程中导致,但是也有研究报道可能是由于噬菌体表面和海藻酸钠之间的相互作用导致[10]。另外,在20 ℃条件下,与浮游态噬菌体在6 h即失活相比,微囊粉态噬菌体在贮藏35 d仅失活15.66%,说明微囊粉能有效地实现对JS25噬菌体的包埋,并且可维持噬菌体活性至35 d以上。JS25噬菌体微囊粉在不同液态食品模拟液中的释放率存在差异,可能是由于液态食品中的水分活度及黏度不同导致。
[1] ANANOU S, MAQUEDA M, MARTÍNEZ-BUENO M, et al. Control of Staphylococcus aureus in sausages by enterocin AS-48[J]. Meat Science, 2014, 24(71): 549-556. DOI:10.1016/j.meatsci.2005.04.039.
[2] CHAO G C, FABRI L J, WILSON M J, et al. One-step zerobackground IgG reformatting of phage-displayed antibody fragments enabling rapid and high-throughput lead identification[J]. Nucleic Acids Research, 2014, 42(4): 194-201. DOI:10.1093/nar/gkt1142.
[3] TOMAT D, QUIBERONI A, CASABONNE C, et al. Phage adsorption on enteropathogenic and shiga toxin-producing Escherichia coli strains: inf l uence of physicochemical and physiological factors[J].Food Research International, 2014, 66: 23-28. DOI:10.1016/j.foodres.2014.08.047.
[4] GOODE D, ALLEN V M. Reduction of experimental Salmonella and Campylobacter contamination of chicken skin by application of lytic bacteriophages[J]. Applied & Environmental Microbiology, 2003,69(8): 5032-5036. DOI:10.1128/AEM.69.8.5032-5036.2003.
[5] O’FLYNN G, ROSS R P, FITZGERALD G F, et al. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157:H7[J]. Applied & Environmental Microbiology, 2004, 70(6):3417-3424. DOI:10.1128/AEM.70.6.3417-3424.2004.
[6] KIM K P, KLUMPP J, LOESSNER M J. Enterobacter sakazakii bacteriophages can prevent bacterial growth in reconstituted infant formula[J]. International Journal of Food Microbiology, 2007, 115(2):195-203. DOI:10.1016/j.ijfoodmicro.2006.10.029.
[7] GREER G G. Homologous bacteriophage control of Pseudomonas growth and beef spoilage[J]. Journal of Food Protection, 1986, 49(2):104-109. DOI:10.4315/0362-028X-49.2.104.
[8] GREER G G, DILTS B D. Control of Brochothrix thermosphacta spoilage of pork adipose tissue using bacteriophages[J]. Journal of Food Protection, 2002, 65(5): 861-863. DOI:10.4315/0362-028X-65.5.861.
[9] MODI R, HIRVI Y, HILL A, et al. Effect of phage on survival of Salmonella enteritidis during manufacture and storage of Cheddar cheese made from raw and pasteurized milk[J]. Journal of Food Protection, 2001, 64(7): 927-933. DOI:10.4315/0362-028X-64.7.927.
[10] GUENTHER S, HUWYLER D, RICHARD S, et al. Virulent bacteriophage for efficient biocontrol of Listeria monocytogenes in ready-to-eat foods[J]. Applied & Environmental Microbiology, 2009,75(1): 93-100. DOI:10.1128/AEM.01711-08.
[11] KLUMPP J, DORSCHT J, LURZ R, et al. The terminally redundant,nonpermuted genome of Listeria bacteriophage A511: a model for the SPO1-like myoviruses of Gram-positive bacteria[J]. Journal of Bacteriology, 2008, 190(17): 5753-5765. DOI:10.1128/JB.00461-08.
[12] EL-ARABI T F, GRIFFITHS M W, SHE Y M, et al. Genome sequence and analysis of a broad-host range lytic bacteriophage that infects the Bacillus cereus group[J]. Virology Journal, 2013, 10(1):1-11. DOI:10.1186/1743-422X-10-48.
[13] DIEZ M R, PAZ H D D, GARCIA F E, et al. A novel chimeric phage lysin with high in vitro and in vivo bactericidal activity against Streptococcus pneumoniae[J]. Journal of Antimicrobial Chemotherapy,2015, 70(6): 1763-1773. DOI:10.1093/jac/dkv038.
[14] OLIVEIRA H, BOAS D V, MESNAGE S, et al. Structural and enzymatic characterization of ABgp46, a novel phage endolysin with broad anti-Gram-negative bacterial activity[J]. Frontiers in Microbiology, 2016, 7: 208. DOI:10.3389/fmicb.2016.00208.
[15] WANG L, JIANG Y L, ZHANG J R, et al. Structural and enzymatic characterization of the choline kinase LicA from Streptococcus pneumoniae[J]. PLoS ONE, 2015, 10(3): e0120467. DOI:10.1371/journal.pone.0120467.
[16] HASANZADEH M, SHAHIDI M, KAZEMIPOUR M. Application of EIS and EN techniques to investigate the self-healing ability of coatings based on microcapsules filled with linseed oil and CeO2,nanoparticles[J]. Progress in Organic Coatings, 2015, 80: 106-119.DOI:10.1016/j.porgcoat.2014.12.002.
[17] O’BRIEN C M, CHAPMAN D, NEVILLE D P, et al. Effect of varying the microencapsulation process on the functionality of hydrogenated vegetable fat in shortdough biscuits[J]. Food Research International,2003, 36(3): 215-221. DOI:10.1016/S0963-9969(02)00139-4.
[18] BURGAIN J, GAIANI C, LINDER M, et al. Encapsulation of probiotic living cells: from laboratory scale to industrial applications[J]. Journal of Food Engineering, 2011, 104(4): 467-483.DOI:10.1016/j.jfoodeng.2010.12.031.
[19] MIYAGAWA A M, INUI T, NAKAJIMA K, et al. Thermal microcapsule transfer technology for full-color printing controlled by photo and thermal energies[J]. Proceedings of SPIE, 1990, 1253:264-270. DOI:10.1117/12.19821.
[20] LIU Z, TAKEUCHI M, NAKAJIMA M, et al. Three-dimensional hepatic lobule-like tissue constructs using cell-microcapsule technology[J]. Acta Biomaterialia, 2016, 50: 178-187. DOI:10.1016/j.actbio.2016.12.020.
[21] LANG L H. FDA approves use of bacteriophages to be added to meat and poultry products[J]. Gastroenterology, 2006, 131(5): 1370.DOI:10.1053/j.gastro.2006.10.012.
[22] MA Y L, LU C P. Isolation and identif i cation of a bacteriophage capable of infecting Streptococcus suis type 2 strains[J]. Veterinary Microbiology,2008, 132(3/4): 340-347. DOI:10.1016/j.vetmic.2008.05.013.
[23] HUO W, XIE G, ZHANG W, et al. Preparation of a novel chitosanmicrocapsules/starch blend film and the study of its drug-release mechanism[J]. International Journal of Biological Macromolecules,2016, 87: 114-122. DOI:10.1016/j.ijbiomac.2016.02.049.
[24] MAZUMDER M A, BURKE N A, SHEN F, et al. Core-cross-linked alginate microcapsules for cell encapsulation[J]. Biomacromolecules,2009, 10(6): 1365. DOI:10.1021/bm801330j.
[25] MAISANABA S, PICHARDO S, JORDA B M, et al. Cytotoxicity and mutagenicity studies on migration extracts from nanocomposites with potential use in food packaging[J]. Food & Chemical Toxicology,2014, 66(4): 366-372. DOI:10.1016/j.fct.2014.02.011.
[26] BEKHIT M, SANCHEZ G L, MESSAOUD G B, et al. Design of microcapsules containing Lactococcus lactis subsp. lactis in alginate shell and xanthan gum with nutrients core[J]. LWT-Food Science and Technology, 2016, 68: 446-453. DOI:10.1016/j.lwt.2015.12.037.
[27] MASUDA Y, KUGIMIYA S, MURAI K, et al. Enhancement of activity and stability of the formaldehyde dehydrogenase by immobilizing onto phenyl-functionalized mesoporous silica[J].Colloids & Surfaces B: Biointerfaces, 2013, 101(1): 26-33.DOI:10.1016/j.colsurfb.2012.05.037.
[28] TANAKA M, KIMURA I, SAITO N, et al. Preparation of microcapsule toner and their properties[J]. Annals of Global Analysis &Geometry, 2014, 41(1): 25-45. DOI:10.4011/shikizai1937.67.624.
[29] ICHIKAWA H, FUKUMORI Y. A novel positively thermosensitive controlled-release microcapsule with membrane of nano-sized poly(N-isopropylacrylamide) gel dispersed in ethylcellulose matrix[J].Journal of Controlled Release, 2000, 63(1/2): 107-119. DOI:10.1016/S0168-3659(99)00181-9.
[30] RESURRECCION F P, TANG J, PEDROW P, et al. Development of a computer simulation model for processing food in a microwave assisted thermal sterilization (MATS) system[J].Journal of Food Engineering, 2013, 118(4): 406-416. DOI:10.1016/j.jfoodeng.2013.04.021.
[31] MARESCA D, PRISCO A D, STORIA A L, et al. Microencapsulation of nisin in alginate beads by vibrating technology: preliminary investigation[J]. LWT-Food Science and Technology, 2016, 66: 436-443. DOI:10.1016/j.lwt.2015.10.062.
[32] PRISCO A D, MARESCA D, ONGENG D, et al. Microencapsulation by vibrating technology of the probiotic strain Lactobacillus reuteri,DSM 17938 to enhance its survival in foods and in gastrointestinal environment[J]. LWT-Food Science and Technology, 2015, 61(2):452-462. DOI:10.1016/j.lwt.2014.12.011.

