HPGFC双柱串联检测右旋糖酐蔗糖酶催化产物及右旋糖酐聚合过程
黄双霞,侯殿志,2,陈华磊,于 玥,陈 山,3,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.中国农业大学食品科学与营养工程学院,北京 100083;3.广西蔗糖产业协同创新中心,广西 南宁 530004)
右旋糖酐是蔗糖经右旋糖酐蔗糖酶催化产生的一种主链含α-(1,6)糖苷键大于90%的葡聚糖,并伴有以α-(1,2)、α-(1,3)或α-(1,4)糖苷键连接的分支[1-2]。右旋糖酐的用途与其聚合的葡聚糖分子数目密切相关,分子质量不同,其作用也不尽相同[3-5]。大分子质量的右旋糖酐(mw>106Da)可用作色谱柱填充剂[6];中等分子质量的右旋糖酐(105Da<mw<106Da)性质稳定、有良好的生物相容性和保湿性,可用作冰淇淋和果酱的增稠剂,化妆品和眼药水的添加剂等[7];低分子质量的右旋糖酐(104Da<mw<105Da)是优良的血浆代替品[8];小分子质量的右旋糖酐(mw<104Da)可用于右旋糖酐衍生品的制备[9-10]。
目前,多糖类物质的分子质量测定方法主要有渗透压法、超速离心法、黏度法、高压电泳法和光散射法等[11]。然而,这些方法普遍存在着操作麻烦且误差大等问题。高效凝胶过滤色谱(high performance gel filtration chromatography,HPGFC)法以其快速、高分辨和重复性好的优点,在多糖及聚合物分子质量、分子质量分布及多聚分散性的测定方面得到广泛应用[12]。HPGFC法测定多糖时,通常采用单柱分析或与质谱联用[13-14]。而以酶法催化蔗糖制备右旋糖酐的体系中除了产物右旋糖酐外,还含有底物蔗糖及副产物果糖、葡萄糖等[15]。因此,建立一种能够精密监测产物右旋糖酐分子质量变化、蔗糖、葡萄糖及果糖浓度等指标的方法对于后续的实验非常重要。
工业上右旋糖酐的制备主要是通过肠膜状明串珠菌(Leuconstoc mesenteriodes)分泌的右旋糖酐蔗糖酶催化蔗糖来完成的[16]。但由于发酵体系成分复杂,除含有大量菌体外,还含有其他营养成分,导致其合成机理难以实现有效的解析[17]。以分离纯化得到的右旋糖酐蔗糖酶与蔗糖溶液直接接触制备右旋糖酐,反应体系简单,使得右旋糖酐合成机理的研究更具可行性[18-19]。目前,关于右旋糖酐的聚合机理还不明了,对该合成规律进行研究和探讨有助于实现对不同分子质量右旋糖酐的定向制备[20]。此外,右旋糖酐合成机理方面的研究基本都是限制在同一反应体系中进行的,未采用干预措施,对于制备过程中是否存在抑制或者间歇合成的现象不能做出合理的解释[21-23]。在此基础上,本实验通过构建右旋糖酐蔗糖酶耦合两级膜对右旋糖酐的聚合过程进行探讨和分析[24],以期为酶法耦合膜分离技术定向制备特定分子质量右旋糖酐的实现提供理论依据。
1 材料与方法
1.1 材料与试剂
肠膜明串珠菌CICC-21724 中国工业微生物菌种保藏管理中心。
右旋糖酐标准品(色谱纯) 美国Polymer Laboratories公司;果糖、蔗糖、葡萄糖、磷酸氢二钠、磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、硫酸、氯化钙、3,5-二硝基水杨酸(均为分析纯) 国药集团化学试剂有限公司;聚乙二醇6000(分析纯) 广东光华科技股份有限公司;牛肉膏、酵母膏(生物试剂)北京奥博星生物技术有限责任公司;琼脂(生物试剂)广东环凯生物科技有限公司;蛋白胨(生物试剂)北京陆桥技术有限责任公司。
1.2 仪器与设备
1100 HPGFC仪(配有G1362A示差折光检测器及GPC数据分析软件) 美国Agilent公司;LS-B50L立式压力蒸汽灭菌器 上海华线医用核子仪器有限公司;ZHJH-1115C垂直流超净工作台、ZHWY-211B全温度恒温培养振荡器 上海智城分析仪器制造有限公司;SHP-150生化培养箱 上海精宏实验设备有限公司;Avanti J-E多用途高效离心机 美国贝克曼库尔特有限公司;Stat Fax 2100酶标仪 美国Awarendss公司;Barnstead Easy Pure LF超纯水机 美瑞泰克科技(天津)有限公司;323E/D蠕动泵 斯派沙克集团公司;膜包(PXBO05A50、PXBO10A50、PXBO50A50、PXBO100C50) 默克密理博实验室设备(上海)有限公司。
1.3 方法
1.3.1 右旋糖酐蔗糖酶的制备与分离纯化
25 ℃斜面培养基中复活肠膜明串珠菌,24 h后进行平板划线获取单菌落,25 ℃、24 h恒温培养;挑取单菌落至种子培养基中,25 ℃、150 r/min摇床培养;对数期接种至产酶培养基中(摇床培养条件同上),24 h后将发酵液4 ℃离心20 min,转速为12 000 r/min,离心后的上清液即为右旋糖酐蔗糖粗酶液。采用课题组前期研究得到的双水相法对右旋糖酐蔗糖粗酶液进行纯化[25]。
1.3.2 右旋糖酐蔗糖酶的酶活测定
25 ℃催化单底物蔗糖1 min内生成1 μmol果糖所需的右旋糖酐蔗糖酶酶量,定义为一个酶活单位(U)。作为一种糖基转移酶,右旋糖酐蔗糖酶能将催化蔗糖产生的D-吡喃葡萄糖基转移到右旋糖酐链上,同时释放出果糖分子。通常情况下,果糖含量采用3,5-二硝基水杨酸法进行测定,根据吸光度与还原糖含量的线性关系计算酶活[26]。
1.3.3 HPGFC单柱和双柱的检测对比实验
对比单柱和双柱对系列右旋糖酐标准品的分离效果以及对催化反应混合液中右旋糖酐、底物蔗糖及副产物果糖、葡萄糖的检测效果。样品的制备:在右旋糖酐蔗糖酶为0.2 U/mL,底物蔗糖浓度为0.2 mol/L,反应体系为400 mL条件下制备得到的催化产物经沸水浴灭活后,用超纯水稀释100 倍,过0.45 μm微孔膜,待测。
色谱柱:分别为KS-Guard+KS-801、KS-Guard+KS-805、KS-Guard+KS-805+KS-801。KS-Guard为保护柱。
色谱分离条件:安捷伦1100系统配示差检测器,流动相为超纯水,流速1.0 mL/min,检测器温度33 ℃,柱温箱温度65 ℃,进样20 μL。
1.3.4 HPGFC双柱串联检测各标准曲线的绘制
右旋糖酐标准溶液:将分子质量分别为5 900、22 800、47 300、112 000、212 000、404 000、778 000 Da的右旋糖酐标准品,配成10 mg/mL的溶液,经0.45 μm微孔膜过滤,进样量20 μL,每个样品平行操作3 次。
精确配制系列浓度蔗糖、葡萄糖和果糖溶液,在1.3.3节色谱分离条件下进样检测,绘制标准曲线,计算R2值,验证HPGPC双柱串联是否可有效实现对样品中蔗糖、葡萄和果糖的定量测定。
1.3.5 HPGFC双柱串联的精密性实验
精确配制0.1、0.2、0.4、0.6、0.8 mmol/L和1.0 mmol/L系列浓度蔗糖溶液,将样品的3 次峰面积进行平均,计算峰面积的相对标准偏差(relative standard deviation,RSD),验证系统的精密度。
1.3.6 蔗糖转化率、右旋糖酐产量和得率测定方法的构建
反应体系中底物蔗糖经右旋糖酐蔗糖酶作用,被等量的转化为葡萄糖和果糖,绝大部分葡萄糖被用于合成目标产物右旋糖酐,果糖则被游离于反应体系中。因此,实验以果糖峰开始下降的前一个取样点作为聚合反应的终点。最后反应体系的终止样中,含有未转化的蔗糖、合成的右旋糖酐和生成的果糖、未来得及合成右旋糖酐的游离葡萄糖。
根据样品中蔗糖、葡萄糖和果糖的峰面积分别代入标准曲线得到对应浓度,即可计算出样品中剩余的蔗糖、葡萄糖和果糖的质量;最后按照质量守恒定律,通过公式(1)~(3)可以得出各指标:

1.3.7 右旋糖酐蔗糖酶添加量及蔗糖浓度对各指标的影响
右旋糖酐蔗糖酶添加量为0.2 U/mL时,探索0.2、0.4、0.6、0.8 mol/L和1.0 mol/L系列蔗糖浓度对蔗糖转化率、右旋糖酐产量和得率的影响规律;蔗糖浓度为0.1 mol/L时,探索0.1、0.2、0.4、0.6 U/mL和0.8 U/mL不同右旋糖酐蔗糖酶添加量对蔗糖转化率、右旋糖酐产量和得率的变化规律。反应体系均为400 mL,30 h进行取样,样品处理按1.3.3节方法。
1.3.8 右旋糖酐蔗糖酶耦合两级膜对右旋糖酐聚合过程
1.3.8.1 酶法耦合两级膜装置的示意图及其运行过程
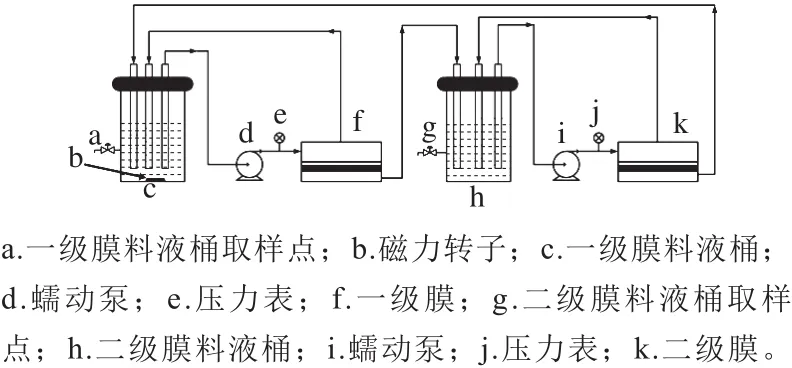
图1 酶法耦合两级膜过程装置图Fig.1 Schematic diagram of the process of enzymatic treatment coupled with two-stage membrane separation
如图1所示,将膜装置按实验流程图进行连接,然后将经高压灭菌过的蔗糖溶液进行膜的预处理,使连接管路内预充满本次实验的蔗糖溶液。然后将配制好的蔗糖酶溶液放进料液桶中(进行磁力搅拌和水浴恒温25 ℃),分别启动一级膜和二级膜的蠕动泵(大约在0.5 h左右启动二级膜蠕动泵),通过调节2 个蠕动泵的转速来平衡膜装置的流速,使整个系统处于平衡循环状态。
1.3.8.2 右旋糖酐聚合过程
为了更加细致准确地分析酶法耦合两级膜干预条件下右旋糖酐的聚合过程,本实验对一级膜料液桶和二级膜料液桶分别进行定时取样检测,以监测反应过程中目标产物分子质量的走势。从右旋糖酐蔗糖酶和底物蔗糖溶液接触时开始计时,在两者反应0、2、4、6、8、10、20、30、40 h和50 h分别进行取样,样品处理按1.3.3节方法。以蔗糖(浓度0.1~1.0 mol/L)为反应底物,加入右旋糖酐蔗糖酶(浓度0.1~0.8 U/mL),耦合膜过程,构建终体积为400 mL的反应体系。
2 结果与分析
2.1 HPGFC单柱和双柱串联对不同分子质量右旋糖酐标准品的检测效果
由图2可以看出,在单柱KS-801检测情况下,7 种不同分子质量的右旋糖酐标准品的出峰时间十分接近,色谱峰几乎重叠和覆盖在一起,很难完全分离鉴定。各右旋糖酐样品的分子质量由于均超过了柱子的最大分离范围,根据尺寸排阻的分离原理,它们无法进入凝胶孔隙而直接被流动相超纯水淋洗出来。相比而言,KS-805柱由于排阻极限达到5×105,可以实现7 种分子质量右旋糖酐的完全分离。在KS-805+KS-801双柱串联的情况下,7 种不同分子质量的右旋糖酐分离效果很理想,各个色谱峰之间不存在重叠和覆盖的问题,且相比于KS-805,各个色谱峰分布也相对比较分散。在此检测条件下,样品先进入KS-805柱内,根据分子质量大小,依次得到有效分离;进入KS-801柱后,直接被洗脱出。KS-805+KS-801双柱串联可以很好地实现对右旋糖酐各个分子质量的分离和鉴定,且效果较好。
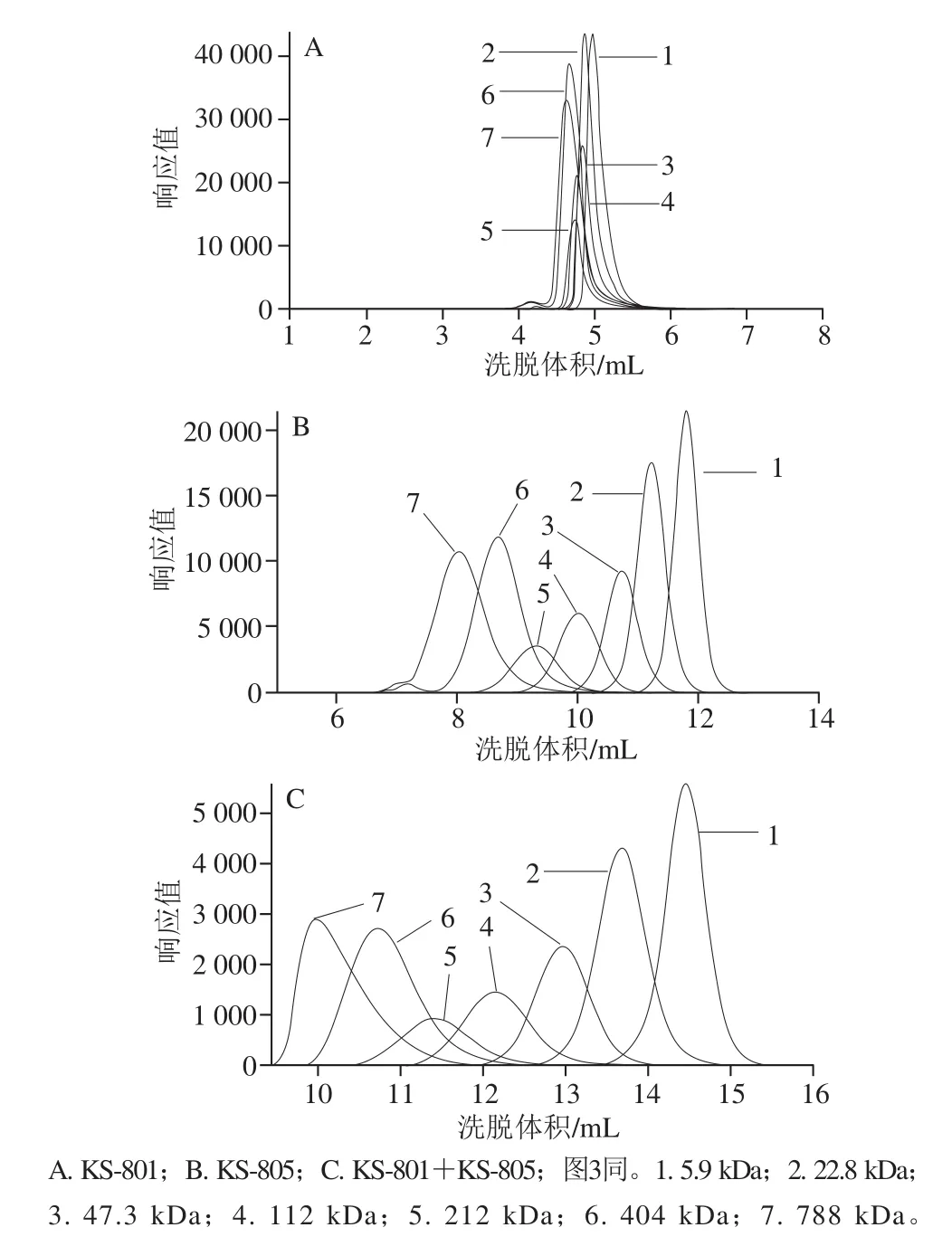
图2 单柱和双柱条件下不同分子质量右旋糖酐标准品的出峰情况Fig.2 Chromatographic peaks for different molecular masses of dextran under single-column and double-column separation conditions
2.2 HPGFC单柱和双柱串联对催化反应混合液的检测效果
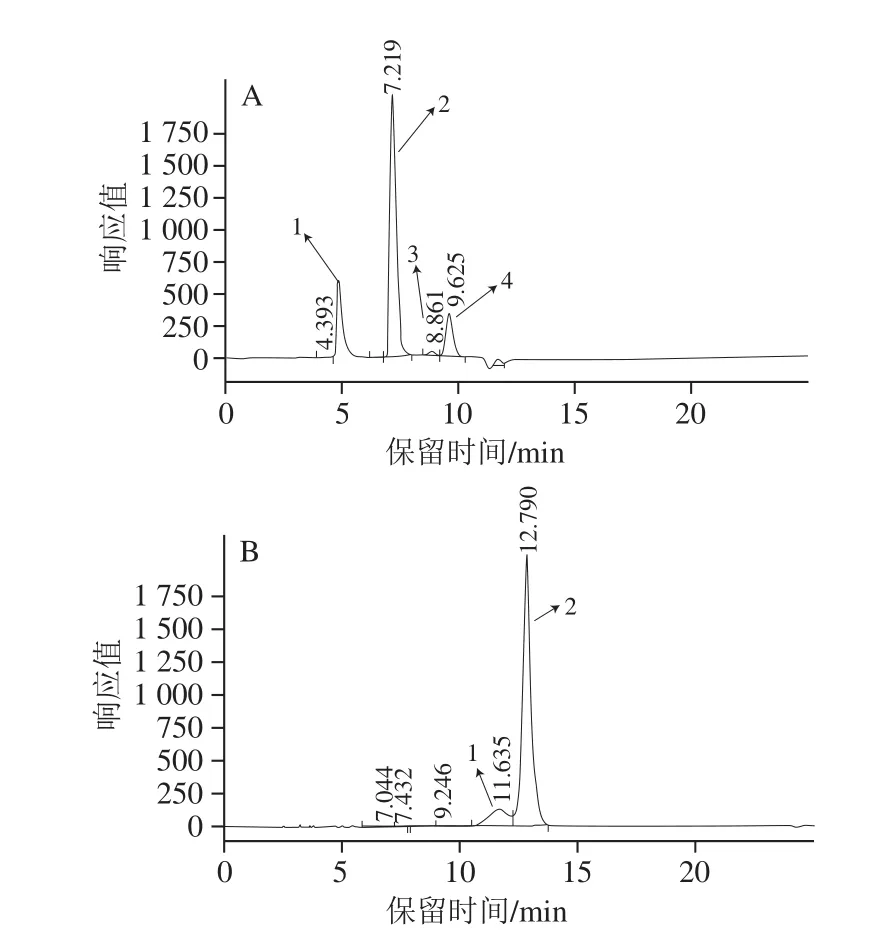
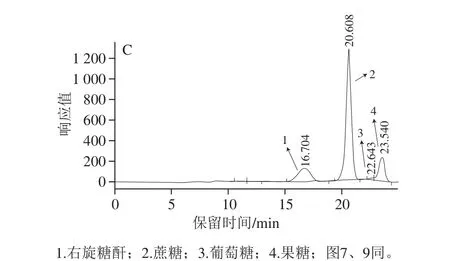
图3 单柱和双柱检测条件下催化产物的出峰情况Fig.3 Chromatographic peaks of catalytic reaction products under single-column and double-column separation conditions
从图3可以看出,KS-801单柱可有效分离和鉴定小分子右旋糖酐、葡萄糖和果糖,但由2.1节结果可知KS-801单柱无法对大分子右旋糖酐的分子质量进行准确的计算和分析;KS-805单柱虽然排阻限较大,但是由于不具备配位体功能,无法分离和鉴定出小分子葡萄糖和果糖,且产物右旋糖酐的峰出现拖尾,连接到蔗糖峰,这对于右旋糖酐分子质量的计算和分析会产生不良的影响。
在KS-805+KS-801双柱串联使用的情况下,根据尺寸排阻与配位体交换原理,右旋糖酐和其他小分子糖类(葡萄糖、果糖等)得到了有效的分离和鉴定;右旋糖酐峰与其他糖类峰之间也没有出现拖尾和连接的现象。另外,由于葡萄糖基被链接到右旋糖酐蔗糖酶上进行右旋糖酐的合成,故在图3中,葡萄糖峰很低。由以上分析可见,KS-805+KS-801双柱串联对样品中的大小分子糖类均可实现有效的检测。
2.3 HPGFC双柱串联检测右旋糖酐分子质量校正曲线的绘制

图4 右旋糖酐分子质量校正曲线Fig.4 Calibration cure of dextran
根据检测数据,绘制得到的右旋糖酐分子质量校正曲线如图4所示。其拟合方程为:Y=13.619 9-1.548 08X+0.115 34X2-0.003 79X3。Y为右旋糖酐分子质量的对数,X为洗脱体积,R2为0.999 8,表明KS-805和KS-801双柱串联使用能够很好地实现对产物中各个分子质量右旋糖酐的测定。
2.4 HPGFC双柱串联检测蔗糖、葡萄糖和果糖标准曲线的拟合方程
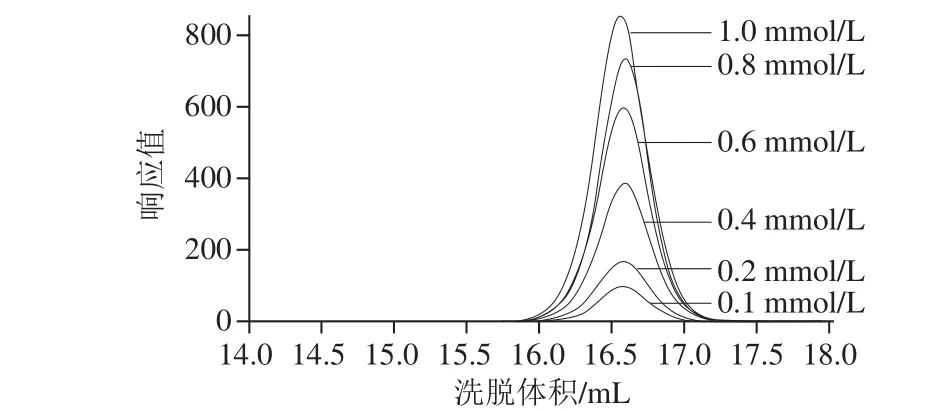
图5 不同浓度蔗糖的HPGFC洗脱叠加图Fig.5 Overlapping chromatograms for different concentrations of sucrose

表1 蔗糖、葡萄糖及果糖标准曲线的拟合方程Table1 Fitting equations of standard curves for sucrose,glucose and fructose
从图5可以看出,不同浓度的蔗糖出峰时间稳定,随着蔗糖浓度的增大,峰面积增大,也表明检测方法具有较好的稳定性。由表1可知蔗糖、葡萄糖及果糖标准曲线的拟合方程,三者R2均大于0.998,线性相关性比较好。根据上述分析可知,HPGFC双柱串联可以很好地实现对反应体系中蔗糖、葡萄糖及果糖浓度的定量跟踪检测。
2.5 HPGFC双柱串联检测的精密性结果
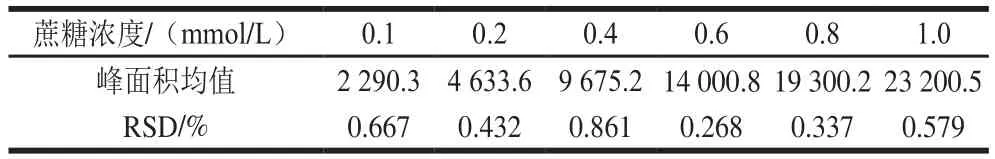
表2 不同浓度蔗糖的峰面积均值及RSDTable2 Mean values of peak area and RSD for different concentrations of sucros
由表2可知,不同蔗糖浓度3 次峰面积均值的RSD较小(低于1%),表明KS-805+KS-801双柱串联检测具有较高的精密性,实验结果具有可靠和准确性。
2.6 右旋糖酐蔗糖酶添加量及蔗糖浓度对蔗糖转化率、右旋糖酐产量和得率的影响
根据1.3.6节中公式(1)~(3)计算得到各反应体系系列的蔗糖转化率、右旋糖酐产量及右旋糖酐得率,如表3所示。
同一右旋糖酐蔗糖酶添加量体系各反应系列,随着蔗糖底物浓度的升高,蔗糖转化率呈下降趋势,右旋糖酐产量不断增加,右旋糖酐得率也不断上升。在右旋糖酐蔗糖酶添加量一定的情况下,当蔗糖底物浓度和右旋糖酐蔗糖酶添加量都充足时,蔗糖转化率自然会较高,但是随着蔗糖浓度的提升,右旋糖酐蔗糖酶量不足,高浓度的蔗糖又会对右旋糖酐蔗糖酶表现出抑制作用,进而导致蔗糖转化率降低。另外一方面,尽管蔗糖浓度升高出现其转化率降低的现象,但是相对低浓度的蔗糖底物,其合成产物右旋糖酐的产量仍会持续增加。右旋糖酐得率自然也会因为2 种指标的改变不断上升。
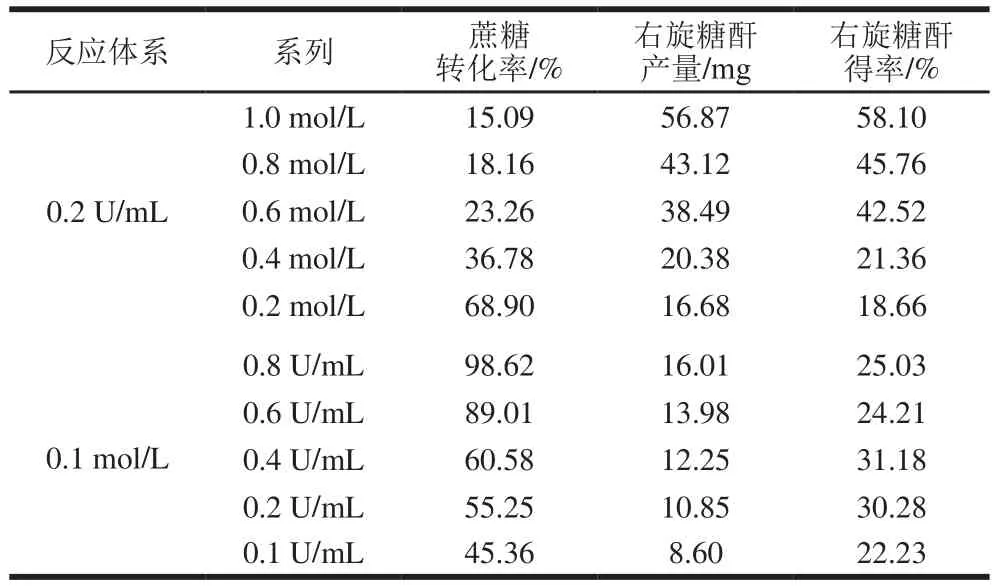
表3 不同右旋糖酐蔗糖酶添加量及蔗糖底物浓度条件下蔗糖转化率、右旋糖酐产量及得率的变化Table3 Effect of enzyme dosage and sucrose concentration on the conversion of sucrose and dextran yield
同一蔗糖底物浓度反应体系,整体上则表现为随着右旋糖酐蔗糖酶添加量的增加,蔗糖转化率和右旋糖酐产量相应上升,但右旋糖酐得率出现先上升后下降的现象。蔗糖底物浓度一定时,右旋糖酐蔗糖酶添加量的不断增加使得合成反应持续进行且相对比较完全,进而蔗糖转化率和右旋糖酐产量会不断上升。右旋糖酐得率表现出先上升后略微下降的现象有可能是因为底物蔗糖有限,导致被右旋糖酐蔗糖酶水解成的葡萄糖基有限,即便全部的葡萄糖基被用于右旋糖酐的合成,其得率相对于大量被转化的蔗糖仍然相对较小。进而当右旋糖酐蔗糖酶添加量超过一定限度时(0.4 U/mL),右旋糖酐得率出现下降的现象。
2.7 右旋糖酐聚合过程分析
在检测方法建立的基础上,本实验通过构建右旋糖酐蔗糖酶耦合两级膜干预右旋糖酐的聚合过程,对其合成机理进行更深一步的研究。为更加细致准确地分析其聚合过程,本实验分别在一级膜料液桶和二级膜料液桶进行定时取样,监测右旋糖酐的分子质量变化。
2.7.1 蔗糖浓度对一级膜料液中产物右旋糖酐分子质量的影响
在右旋糖酐蔗糖酶添加量为0.2 U/mL不变的情况下,改变反应体系的底物浓度(0.2~1.0 mol/L),一级膜料液桶中产物右旋糖酐分子质量变化如图6。从整体上看,同一右旋糖酐蔗糖酶添加酶量反应体系,不同浓度蔗糖底物溶液中聚合成的产物右旋糖酐分子质量随着反应时间的延长并没有表现出大幅度波动的现象(从小分子慢慢形成大分子),而是在检测的初始阶段即为百万级别分子质量的右旋糖酐。5 个反应系列的产物右旋糖酐分子质量变化趋势在一级膜料液桶中整体趋于一致,在反应的前10 h呈现出很小幅度的上升趋势,之后产物右旋糖酐分子质量几乎不再改变,趋于平衡。从各个反应系列的变化曲线可以看出,产物右旋糖酐的分子质量随着蔗糖底物溶液浓度的升高出现小幅度下降,但重均分子质量还都是维持在106Da以上。同一右旋糖酐蔗糖酶添加量反应体系,产物右旋糖酐的分子质量与蔗糖底物的浓度呈负相关关系。Kim等[27]在右旋糖酐蔗糖酶添加量一定的条件下,改变蔗糖底物浓度(0.1~4.0 mol/L),研究终产物右旋糖酐分子质量的变化情况,结果表明,随着蔗糖底物浓度的升高,产物右旋糖酐分子质量逐渐降低,这也与本实验的研究结果相一致。另外,有研究表明[28-29],高浓度的蔗糖溶液会致使右旋糖酐蔗糖酶的活性位点构象发生改变,进而造成聚合反应受到一定程度的抑制,反应稍微倾向于合成低聚糖,结果产物右旋糖酐分子质量相对较小。
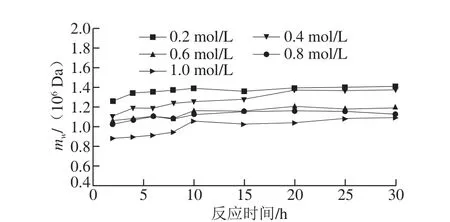
图6 0.2 U/mL反应体系中一级膜料液桶中右旋糖酐分子质量变化Fig.6 Changes in molecular mass of dextran during reaction catalyzed by 0.2 U/mL dextransucrase in the fi rst stage of membrane treatment
2.7.2 蔗糖浓度对二级膜料液中产物右旋糖酐分子质量的影响
以0.2 U/mL和1.0 mol/L反应体系为代表,得到的一级膜料液桶和二级膜料液桶中起始样和终止样的色谱叠加对比如图7所示。
通过对0.2 U/mL反应体系各系列设置时间段的样品进行检测分析表明,在二级膜料液桶中均未有目标产物右旋糖酐的出现。由于样品数量较多,但为了更好地研究证实右旋糖酐的聚合机理,以0.2 U/mL、1.0 mol/L为代表得到起始点2 h和终止点30 h两个时间点的一级膜料液桶和二级膜料液桶中样品的色谱叠加图。对比图7的2 个相同时间点的一级膜料液桶和二级膜料液桶中样品色谱叠加图,可以明显的看出在一级膜料液桶样品色谱叠加图中有大分子质量右旋糖酐的峰显现,而二级膜料液桶样品色谱叠加图中除蔗糖、游离葡萄糖、果糖外,并没有右旋糖酐的峰出现;这一现象很好地证明了右旋糖酐的聚合可能不是一个从小到大慢慢聚合、不断释放的过程;而是右旋糖酐链在酶活性位点上不断聚合葡萄糖基,当达到一定分子质量水平(mw>106Da)时才从酶活性位点脱落的过程。在单酶法耦合两级膜的作用下,如果右旋糖酐的聚合是一个从小到大且不断从酶活性位点上脱落的过程,则在两级膜的作用下,按照检测条件要求,应该会相应地检测到中小分子质量的右旋糖酐;但是根据目前的实验结果,在各个系列样品中均未检测到产物右旋糖酐,而只有小分子的糖类(蔗糖、葡萄糖、果糖)。同时从图7也可以看出,随着反应时间的延长,底物蔗糖由于被消耗,其峰值明显下降较多;水解蔗糖产生的葡萄糖也被用于右旋糖酐的合成,峰值明显小于果糖;此外,随着反应的持续进行也使得果糖峰不断增大。
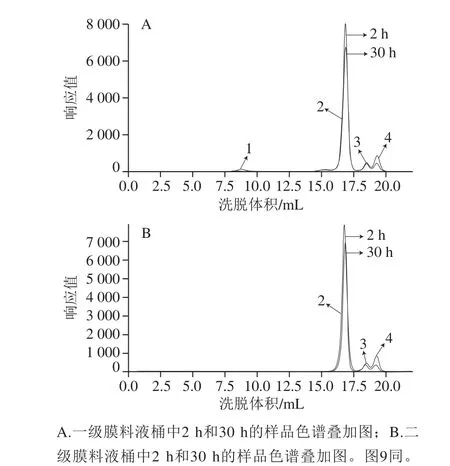
图7 0.2 U/mL、1.0 mol/L反应体系中反应起始样和终止样的叠加谱图Fig.7 Overlapping chromatograms of reaction products at 2 and 30 h from 0.2 U/mL dextransucrase and 1.0 mol/L surocse in two stage of membrane treatment
2.7.3 右旋糖酐蔗糖酶添加量对一级膜料液中产物右旋糖酐分子质量的影响

图8 0.1 mol/L反应体系中一级膜料液桶中右旋糖酐分子质量变化Fig.8 Changes in molecular nass of dextran during catalysis of 0.1 mol/L sucrose the fi rst stage of membrane treatment
在蔗糖底物浓度为0.1 mol/L不变的情况,改变反应体系的右旋糖酐蔗糖酶添加量(0.1~0.8 U/mL),一级膜料液桶中产物右旋糖酐分子质量的变化如图8所示。从产物右旋糖酐分子质量变化趋势曲线可以看出,除了0.8 U/mL反应系列分子质量低于106Da之外,其他系列产物右旋糖酐的分子质量水平普遍都处于106Da以上。从开始检测到有大分子右旋糖酐生成,到反应终止,整个反应体系各个系列的产物右旋糖酐分子质量在整个聚合反应过程并没有出现大幅度的波动现象。结合图6和图8两个不同反应体系各系列的产物右旋糖酐分子质量的变化情况,可以从一个侧面间接证明,在单酶法作用底物蔗糖制备右旋糖酐时,整个聚合过程应该是葡萄糖基被不断的被转移到右旋糖酐链上,直至达到一定分子质量水平(106Da左右)才从右旋糖酐蔗糖酶上脱落。另外,在蔗糖底物浓度相同的情况,不同的右旋糖酐蔗糖酶添加量对产物右旋糖酐分子质量变化的影响并不是很大,基本都维持在百万级别以上;随着右旋糖酐蔗糖酶添加量的增加,产物右旋糖酐的分子质量整体上呈下降趋势,这与Falconer等[30]的研究结果相一致。同一蔗糖底物浓度反应体系,产物右旋糖酐的分子质量与右旋糖酐蔗糖酶添加量呈反相关关系。右旋糖酐蔗糖酶催化蔗糖产生的D-葡萄糖基被不断的转移到右旋糖酐链上,共价结合到右旋糖酐蔗糖酶的活性位点上;右旋糖酐蔗糖酶添加量的减少导致反应体系溶液中的酶分子也相应减少,进而用于共价链接右旋糖酐链的酶活性位点也随着减少;因此相同浓度的蔗糖底物反应溶液,右旋糖蔗糖酶添加量少的反应体系中酶活性位点也相对较少,右旋糖酐链附着在较少数量的活性位点上不断聚合葡萄糖基,形成较高分子质量的右旋糖酐。
2.7.4 右旋糖酐蔗糖酶添加量对二级膜料液中产物右旋糖酐分子质量的影响
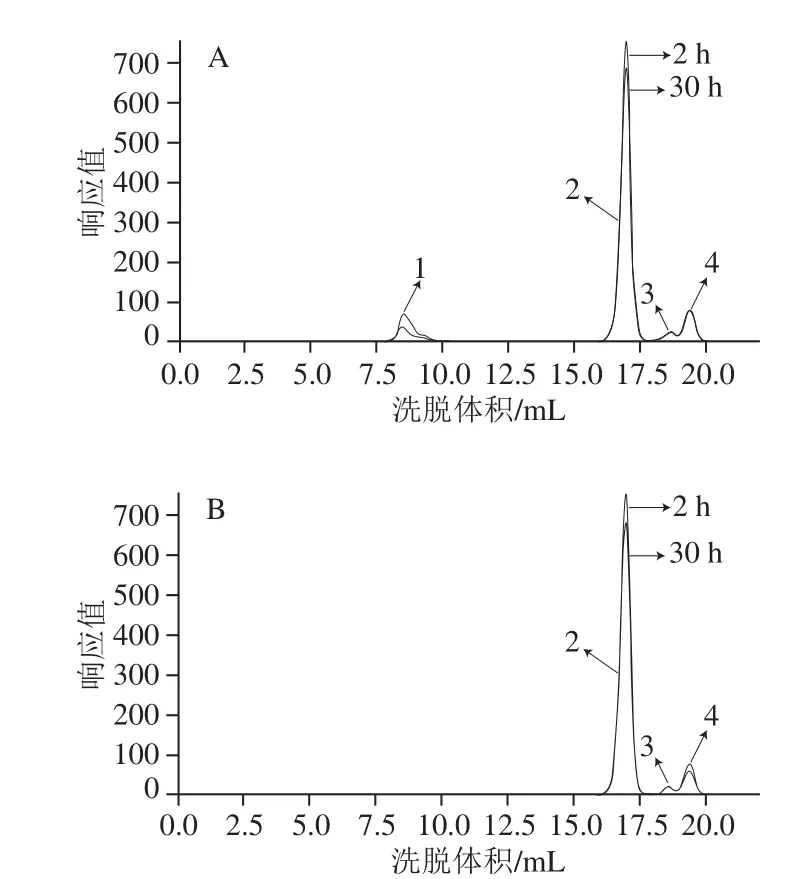
图9 0.1 U/mL、0.1 mol/L反应体系中反应起始样和终止样的叠加谱图Fig.9 Overlapping chromatograms of reaction products at 2 and 30 h from 0.1 U/mL dextransucrase and 0.1 mol/L surocse
结合一级膜料液桶中反应的起点和终点,以0.1 U/mL和0.1 mol/L反应体系为代表,得到一级膜料液桶和二级膜料液桶中起始样和终止样的色谱叠加对比图如图9所示。同一取样时间点,一级膜料液桶样品色谱叠加图中出现大分子质量右旋糖酐,而二级膜料液桶样品色谱叠加图中只有蔗糖、葡萄糖、果糖小分子糖类,未有目标产物右旋糖酐。这与2.7.2节的研究结果相一致,右旋糖酐的聚合应该是在酶活性上葡萄糖基不断聚合,直至右旋糖酐链达到一定分子质量才脱落的过程,且分子质量水平几乎都处于百万级别以上(mw>106Da)。另外,相比于同一右旋糖酐蔗糖酶添加量反应体系的其他系列,0.1 U/mL系列右旋糖酐蔗糖酶添加量较少,目标产物右旋糖酐的产量也较低,相应的溶液黏度也比较稀,但是也并未在二级膜中检测到与一级膜标记截留量有出入的右旋糖酐分子,这说明超滤膜对此反应体系具有很好的截留性。从图9也可以看出,随着反应的进行,一级膜料液桶和二级膜料液桶样品中蔗糖底物被逐渐消耗,葡萄糖由于被用于聚合右旋糖酐,其峰值明显小于果糖峰。
3 结 论
通过分别采用单柱KS-801、KS-805及双柱串联对不同分子质量的右旋糖酐标准品和催化反应混合液进行检测发现,KS-805+KS-801双柱串联使用可以很好地实现对样品中不同分子质量的右旋糖酐、蔗糖、葡萄糖和果糖的有效检测;在初步建立双柱串联检测方法的基础上,绘制得到的右旋糖酐分子质量校正曲线、蔗糖、葡萄糖和果糖标准曲线的相关性较高,表明此法可以对样品中右旋糖酐分子质量实现精确的测定,且可以定量跟踪检测催化反应混合液中蔗糖、葡萄糖和果糖的浓度变化。最后通过对不同浓度蔗糖溶液的定量检测,3次峰面积均值的相对标准偏差都小于1%且出峰情况稳定,表明该检测方法和系统具有较高的精密性和可靠性。
此外,在检测方法得到建立的基础上,通过构建右旋糖酐蔗糖酶耦合两级膜探究了右旋糖酐的聚合过程。通过跟踪检测不同蔗糖浓度和右旋糖酐蔗糖酶添加量条件下,一级膜和二级膜料液桶中右旋糖酐分子质量的变化,间接证实了右旋糖酐的聚合机理是右旋糖酐分子链在右旋糖酐蔗糖酶活性位点上不断聚合葡萄糖基,直至达到一定的分子质量(mw>106Da)才脱落,而不是一个从小到大、慢慢聚合、不断脱落的过程。
[1] PU Y, ZOU Q, HOU D, et al. Molecular weight kinetics and chain scission models for dextran polymers during ultrasonic degradation[J].Carbohydrate Polymers, 2017, 156: 71-76. DOI:10.1016/j.carbpol.2016.09.017.
[2] KO J A, NAM S H, PARK J Y, et al. Synthesis and characterization of glucosyl stevioside using Leuconostoc dextransucrase[J]. Food Chemistry,2016, 211: 577-582. DOI:10.1016/j.foodchem.2016.05.046.
[3] ZOU Q, PU Y, HAN Z, et al. Ultrasonic degradation of aqueous dextran: effect of initial molecular weight and concentration[J].Carbohydrate Polymers, 2012, 90(1): 447-451. DOI:10.1016/j.carbpol.2012.05.064.
[4] PU Y, ZOU Q, LIU L, et al. Clinical dextran purified by fractional ultraf i ltration coupled with water washing[J]. Carbohydrate Polymers,2012, 87(2): 1257-1260. DOI:10.1016/j.carbpol.2011.09.006.
[5] PERSIN Z, STANA-KLEINSCHECK K, FOSTER T J, et al.Challenges and opportunities in polysaccharides research and technology: the EPNOE views for the next decade in the areas of materials, food and health care[J]. Carbohydrate Polymers, 2011,84(1): 22-32. DOI:10.1016/j.carbpol.2010.11.044.
[6] CHAUDHARY R, JAIN S, MURALIDHAR K, et al. Purif i cation of bubaline luteinizing hormone by gel fi ltration chromatography in the presence of blue dextran[J]. Process Biochemistry, 2006, 41(3): 562-566. DOI:10.1016/j.procbio.2005.10.003.
[7] BEJAR W, GABRIEL V, AMARI M, et al. Characterization of glucansucrase and dextran from Weissella sp. TN610 with potential as safe food additives[J]. International Journal of Biological Macromolecules, 2013, 52∶ 125-132. DOI∶10.1016/j.ijbiomac.2012.09.014.
[8] ZHU F, HEDITKE S, KURTZBERG J, et al. Hydroxyethyl starch as a substitute for dextran 40 for thawing peripheral blood progenitor cell products[J]. Cytotherapy, 2015, 17(12)∶ 1813-1819. DOI∶10.1016/j.jcyt.2015.08.007.
[9] LEE W M D, SAMUEL S M D, MARISA G M D, et al. Safety and eff i cacy of rapid (1 000 mg in one hour) intravenous iron dextran for treatment of maternal iron deficient anemia[J]. American Journal of Hematology, 2016, 91(6)∶ 590-593. DOI∶10.1002/ajh.24361.
[10] CAKIĆ M, GLIŠIĆ S, NIKOLIĆ G, et al. Synthesis, characterization and antimicrobial activity of dextran sulphate stabilized silver nanoparticles[J]. Journal of Molecular Structure, 2016, 1110∶ 156-161.DOI∶10.1016/j.molstruc.2016.01.040.
[11] 吴东儒. 糖类的生物化学[M]. 北京∶ 高等教育出版社, 2006∶525-527.
[12] KUMAR N, AZZAM T, DOMB A J. Molecular mass distribution of polycations and dextrans by high performance size exclusion chromatography[J]. Polymers for Advanced Technologies, 2002,13(10/11/12)∶ 1071-1077. DOI∶10.1002/pat.245.
[13] KARMARKAR S, GARBER R, KLUZA J, et al. Gel permeation chromatography of dextrans in parenteral solutions∶ calibration procedure development and method validation[J]. Journal of Pharmaceutical & Biomedical Analysis, 2006, 41(4)∶ 1260-1267.DOI∶10.1016/j.jpba.2006.03.028.
[14] SONG G, DU Q. Structure characterization and antitumor activity of an α β-glucan polysaccharide from Auricularia polytricha[J].Food Research International, 2012, 45(1)∶ 381-387. DOI∶10.1016/j.foodres.2011.10.035.
[15] MIYAGAWA Y, SETO H, OHTO K, et al. Giant dextran particles formed by dextransucrase immobilized on a tube surface in a laminar flow[J]. Biochemical Engineering Journal, 2012, 64(19)∶ 17-21.DOI∶10.1016/j.bej.2012.02.008.
[16] STEPANOV N A, SENKO O V, EFREMENKO E N. Biocatalytic production of extracellular exopolysaccharide dextran synthesized by cells of Leuconostoc mesenteroides[J]. Catalysis in Industry, 2017,9(4)∶ 339-343. DOI∶10.1134/S2070050417040109.
[17] SANTOS M, RODRIGUES A, TEIXEIRA J A. Production of dextran and fructose from carob pod extract and cheese whey by Leuconostoc mesenteroides, NRRL B512(f)[J]. Biochemical Engineering Journal,2005, 25(1)∶ 1-6. DOI∶10.1016/j.bej.2005.01.022.
[18] 邹青松. 右旋糖酐分子量定向控制过程及其机理研究[D]. 南宁∶ 广西大学, 2013.
[19] NAESSENS M, CERDOBBEL A, SOETAERT W, et al. Leuconostoc dextransucrase and dextran∶ production, properties and applications[J].Journal of Chemical Technology and Biotechnology, 2005, 80(8)∶ 845-860. DOI∶10.1002/jctb.1322.
[20] 张义平. 固定化双酶法定向合成右旋糖酐及其调控机理研究[D]. 南宁∶ 广西大学, 2015. DOI∶10.7666/d.Y288795.
[21] ROBYT J F, EKLUND S H. Relative, quantitative effects of acceptors in the reaction of Leuconostoc mesenteroides B-512F dextransucrase[J].Carbohydrate Research, 1983, 121∶ 279-286. DOI∶10.1016/0008-6215(83)84024-5.
[22] ROBYT J F, YOON S H, MUKERJEA R. Dextransucrase and the mechanism for dextran biosynthesis[J]. Carbohydrate Research, 2008,343(18)∶ 3039-3048. DOI∶10.1016/j.carres.2008.09.012.
[23] KOTHARI D, GOYAL A. Enzyme-resistant isomalto-oligosaccharides produced from Leuconostoc mesenteroides NRRL B-1426 dextran hydrolysis for functional food application[J]. Biotechnology & Applied Biochemistry, 2016, 63(4)∶ 581-589. DOI∶10.1002/bab.1391.
[24] JAKOVETIĆ S, LUKOVIĆ N, JUGOVIĆ B, et al. Production of antioxidant egg white hydrolysates in a continuous stirred tank enzyme reactor coupled with membrane separation unit[J]. Food & Bioprocess Technology, 2014, 8(2)∶ 287-300. DOI∶10.1007/s11947-014-1402-y.
[25] 刘玫. 右旋糖酐蔗糖酶分离纯化方法的研究[D]. 南宁∶ 广西大学,2014.
[26] VETTORI M H P B, MUKERJEA R, ROBYT J F. Comparative study of the eff i cacies of nine assay methods for the dextransucrase synthesis of dextran[J]. Carbohydrate Research, 2011, 346(9)∶ 1077-1082.DOI∶10.1016/j.carres.2011.02.015.
[27] KIM D, ROBYT J F, LEE S Y, et al. Dextran molecular size and degree of branching as a function of sucrose concentration, pH, and temperature of reaction of Leuconostoc mesenteroides B-512FMCM dextransucrase[J]. Carbohydrate Research, 2003, 338(11)∶ 1183-1189.DOI∶10.1016/S0008-6215(03)00148-4.
[28] HEINCKE K, DEMUTH B, JÖRDENING H J, et al. Kinetics of the dextransucrase acceptor reaction with maltose-experimental results and modeling[J]. Enzyme & Microbial Technology, 1999, 24(8/9)∶523-534. DOI∶10.1016/S0141-0229(98)00150-1.
[29] ROBYT J F. Mechanisms in the glucansucrase synthesis of polysaccharides and oligosaccharides from sucrose[J]. Advances in Carbohydrate Chemistry & Biochemistry, 1996, 27(14)∶ 133-168.DOI∶10.1016/S0065-2318(08)60193-6.
[30] FALCONER D J, MUKERJEA R, ROBYT J F. Biosynthesis of dextrans with different molecular weights by selecting the concentration of Leuconostoc mesenteroides B-512FMC dextransucrase, the sucrose concentration, and the temperature[J]. Carbohydrate Research, 2011,346(2)∶ 280-284. DOI∶10.1016/j.carres.2010.10.024.

