拮抗砀山梨炭疽菌的内生菌筛选及抑菌效果分析
郭志华,段腾飞,江翠翠,王 芳
(宿州学院生物与食品工程学院,安徽 宿州 234000)
植物内生菌是指在其生活史的一定阶段或全部阶段,生活于健康植物各种组织和器官的细胞间隙或细胞内,不引起植物组织明显症状改变的微生物[1-3]。2008年,砀山酥梨产区暴发梨炭疽病,病果率达到70%以上,仅安徽省砀山县梨农直接经济损失超过7亿 元[4]。炭疽菌主要侵害果实和叶片,导致果实整体腐烂,果皮变黑色[5]。现在对炭疽菌的有效防治主要是化学农药[6],长期使用化学农药易使病菌产生耐药性,并且化学农药污染环境,可通过环境食物链进入人体,严重危害人体健康[7]。内生细菌存在于植物体内,生存环境稳定,可经受住植物自身的防卫反应,与病菌直接相互作用[8]。
国内外科研人员已经分离筛选一些重要的生防微生物。柳凤等[9]从红树林体内分离的内生菌AiL3,对芒果炭疽菌抑菌效果较好。李春玲等[10]从芒果表皮分离得到29株内生细菌,对峙培养法发现菌株B2-1对芒果炭疽菌菌丝的生长具有较强抑制作用。石晶盈等[11]从番木瓜果皮内筛选具有较强拮抗活性的内生细菌防治番木瓜采后炭疽病和疫霉病,以减少果实采后病害带来的损失。袁红旭等[12]从不同品种柑橘果实中分离出16 株内生细菌,研究筛选出4 株对柑橘炭疽病有较好防治作用、具有应用前景的拮抗内生细菌。具有较好拮抗植物病原微生物的内生细菌种类中芽孢杆菌较多,芽孢杆菌能产生强效抑菌物质,具有培养要求简单、繁殖速度快等优点[13]。美国迄今已有3 株枯草芽孢杆菌和1 株解淀粉芽孢杆菌获得商品化生产许可[14]。关于芽孢杆菌生防机制主要包括营养和空间位点竞争、分泌抗菌物质、溶菌作用,诱导植物抗病性等方面[15-16],其中分泌抗菌物质研究的较多,芽孢杆菌分泌的抗菌物质包括抗菌蛋白和抗菌脂肽类物质[17-18]。
本研究以安徽特产砀山梨为研究对象,从健康砀山梨中分离筛选拮抗砀山梨炭疽菌的内生菌,通过形态特征观察、理化性质测试和16S rDNA鉴定菌株。检测发酵液抑菌性,研究发酵蛋白粗提液性质和内生菌对感染炭疽菌的砀山梨果实防御酶活性的影响,初步研究砀山梨内生菌拮抗炭疽菌的机制。
1 材料与方法
1.1 材料与试剂
砀山梨采自宿州砀山良梨镇果园;砀山梨胶孢炭疽菌(Colletotrichum gloeosporioides)为实验室保存。
PDA培养基(培养真菌):马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水 1 000 mL、自然pH值。牛肉膏蛋白胨培养基(培养细菌):牛肉膏5.0 g 、蛋白胨10.0 g、NaCl 5 g、琼脂15~20 g、蒸馏水1 000 mL、pH 7.2~7.4。
DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、胶回收试剂盒、蛋白酶K美国Sigma公司;其余均为国产分析纯。
1.2 仪器与设备
AL204分析天平 上海天平仪器技术公司;BBS-SDC-A超净工作台 博科生物公司;MyCycler PCR扩增仪 美国Bio-Rad公司;SHP-250型生化培养箱上海精宏公司。
1.3 方法
1.3.1 砀山梨内生菌的分离
从砀山果园采收无病虫害、成熟度较好的砀山梨。取约0.5 g果肉放到牛肉膏蛋白胨液体培养基中,37 ℃振荡培养18~24 h;取200 μL培养液涂布在牛肉膏蛋白胨固体培养基,37 ℃静置培养18~24 h;用无菌牙签蘸取单菌落转接入牛肉膏蛋白胨液体培养基中37 ℃振荡培养18~24 h,平板划线纯化后保存。
1.3.2 内生菌对砀山梨胶孢炭疽菌菌丝生长的抑制作用
将砀山梨胶孢炭疽菌在PDA平板上活化待用;将内生菌分别置于牛肉膏蛋白胨液体培养基中,37 ℃振荡培养18~24 h,使菌液浓度为104~105CFU/mL待用。
平板对峙培养法:用打孔器(d=6 mm)在活化好的砀山梨胶孢炭疽菌的菌落边缘打取菌丝块,将菌丝块挑入PDA平板中心,培养48 h后,在培养皿的上下左右距离菌丝块2 cm处各放置1 片无菌滤纸圆片,在每个滤纸片上注入20 μL的内生菌菌液。接种后的培养皿置于28 ℃培养,每个处理重复3 次,以滤纸片上注入无菌水作为对照。5 d后对平板抑制情况进行拍照处理并按下式计算菌丝生长抑制率[18-19]。

1.3.3 内生菌DSL-9的鉴定
观察DSL-9单菌落形状、颜色、表面等培养特征;革兰氏染色,显微镜观察菌体形状、排列方式等形态特征。DSL-9菌株进行甲基红、接触酶、明胶液化、淀粉水解、产吲哚、硝酸盐还原、糖发酵等实验[20-21]。以细菌16S rDNA通用引物为上下游引物,染色体DNA为模板扩增DSL-9菌株的16S rDNA[22]。PCR产物由上海生物工程有限公司测序,所得16S rDNA序列通过NCBI网站BLAST进行核酸数据比对。
1.3.4 DSL-9发酵液对砀山梨胶孢炭疽菌拮抗作用
内生菌DSL-9培养至菌液浓度为105~106CFU/mL,制备待测液分别为:发酵菌液离心后取上清液,用滤膜过滤得无菌体滤液;发酵液经121 ℃、15 min处理;无菌水。待测液均匀涂布在牛肉膏蛋白胨培养基,将砀山梨胶孢炭疽菌菌丝块置于平板中央。
1.3.5 内生菌DSL-9蛋白粗提物制备
内生菌DSL-9培养液离心后取无菌上清液,上清液用(NH4)2SO4饱和溶液盐析,4 ℃沉淀过夜,离心30 min,弃去上清液,以pH 7.2磷酸缓冲液溶解沉淀,4 ℃透析过夜,透析液12 000 r/min离心20 min,上清液0.22 μm滤膜过滤,为蛋白粗提液,4 ℃保存备用[14]。
蛋白粗提液分别置于20、30、40、50、60、70、80 ℃水浴锅中水浴1 h,90、100、110、120 ℃油浴1 h且冷凝回流,按1.3.2节方法计算抑菌率。
用1 mol/L HCl溶液和1 mol/L NaOH溶液调蛋白粗提液pH值为4、5、6、7、8、9、10七个梯度,同时保证蛋白浓度不发生改变, 4 ℃过夜,按1.3.2节方法计算抑菌率。
将蛋白粗提液置于25 W紫外灯下10 cm处照射2、4、6、8、10 h,按1.3.2节方法计算抑菌率。
蛋白粗提液中加入胃蛋白酶、胰蛋白酶、中性蛋白酶和蛋白酶K,终质量浓度为1 mg/mL,37 ℃水浴1 h,80 ℃水浴处理30 min使蛋白酶变性,按1.3.2节方法计算抑菌率。
1.3.7 内生菌DSL-9对染病果实生理生化的影响
主成分分析图可以直观地反映出各样品的相对位置及与感官特征的相关关系,样品之间、样品与感官特征之间的相对位置越近,表明它们在风味特征上,关系越密切[27],16种怪味胡豆样品与风味特征在F1/F2坐标中的分布,见图1。
选取健康砀山梨果实,75%乙醇溶液表面消毒,表面喷炭疽菌培养液,以果实表面布满为准,果面晾干后再喷内生菌培养液,以果实表面布满为准,25 ℃恒温培养箱中培养。接种后1、2、3、4、5、6、7 d分别测量可溶性蛋白含量和多酚氧化酶(polyphenol oxidase,PPO)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)活性[15]。
1.4 数据分析
所有的实验均做3 次平行,实验数据采用Excel软件进行数据统计分析。
2 结果与分析
2.1 砀山梨内生菌的分离
从砀山梨中共分离纯化15 株内生菌,分别命名为DSL-1、DSL-2、DSL-3、DSL-4……DSL-15。其中经革兰氏染色6 株为革兰氏阴性菌,9 株为革兰氏阳性菌。
2.2 拮抗砀山梨炭疽菌的内生菌的筛选
15 株内生菌对砀山梨胶孢炭疽菌抑菌率分别为34%、25%、2%、3%、0%、18%、10%、30%、56%、12%、21%、16%、0%、11%、20%。其中内生菌DSL-9的抑菌率为56%,抑菌效果最好。从图1A可知,未转接内生菌DSL-9的平板中,砀山梨胶孢炭疽菌菌丝生长正常,菌落呈圆形扩展。图1B中接种内生菌DSL-9,内生菌DSL-9对炭疽菌的菌丝生长产生明显的抑制作用,形成十字形,这可能是因为DSL-9分泌的代谢物对炭疽菌的菌丝生长产生抑制作用。
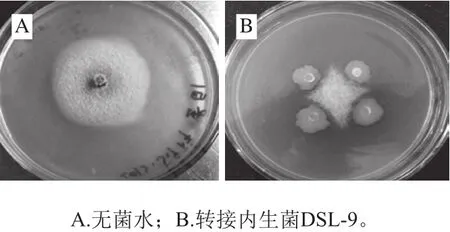
图1 内生菌DSL-9抑制砀山梨炭疽菌菌丝生长的菌落图Fig.1 DSL-9 inhibited the mycelial growth of C. gloeosporioides
2.3 内生菌DSL-9的鉴定
2.3.1 形态特征观察
DSL-9革兰氏染色为阳性,显微镜观察DSL-9菌体为杆状,菌体中央有椭圆状芽孢,平板观察菌落微黄色,表面干燥粗糙。
2.3.2 生理生化特征鉴定
DSL-9菌株甲基红实验阳性、硝酸盐还原实验阳性、葡萄糖培养产酸不产气、不发酵乳糖、可液化明胶、水解淀粉、不产吲哚。
2.3.3 16S rDNA 的扩增和序列分析
以DSL-9菌株的DNA为模板,PCR扩增得大小约为1.5 kb的基因片段。采用BLAST与GenBank中已登录的基因序列进行比对,结果发现DSL-9的16S rDNA与枯草芽孢杆菌同源性为98%。根据形态特征观察、生理生化特征鉴定和16S rDNA的序列分析,DSL-9初步鉴定为枯草芽孢杆菌(Bacillus subtilis)[20-21]。
2.4 DSL-9发酵液对砀山梨胶孢炭疽菌拮抗作用
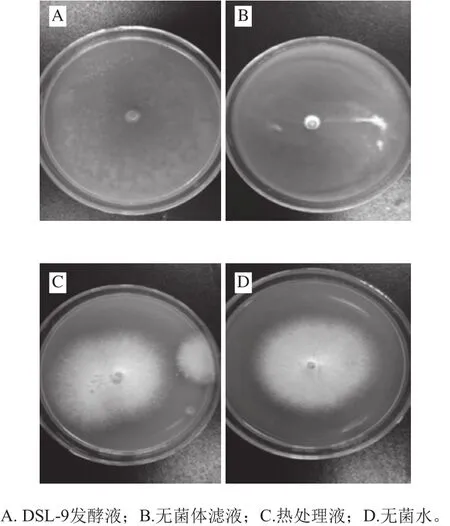
图2 不同处理DSL-9培养液对砀山梨胶孢炭疽菌拮抗作用Fig.2 Effect of different treatments on inhibitory activity of the culture broth of DSL-9 against C. gloeosporioides
如图2所示,发酵液经3 种方式处理后,内生菌DSL-9发酵液和离心后上清液经过滤后的无菌体发酵液几乎抑制炭疽菌的生长,说明内生菌DSL-9对炭疽菌生长有较强的抑菌效果,抑菌物质可能是DSL-9菌株分泌到胞外的代谢产物;图2C和图2D可观察到完整的炭疽菌菌落,菌丝生长正常,说明经121 ℃、20 min处理后的发酵液和无菌水均无抑菌活性,121 ℃高温可使发酵液中抑菌物质失活。
2.5 内生菌DSL-9蛋白粗提液性质分析
2.5.1 温度对DSL-9蛋白粗提液抑菌活性的影响
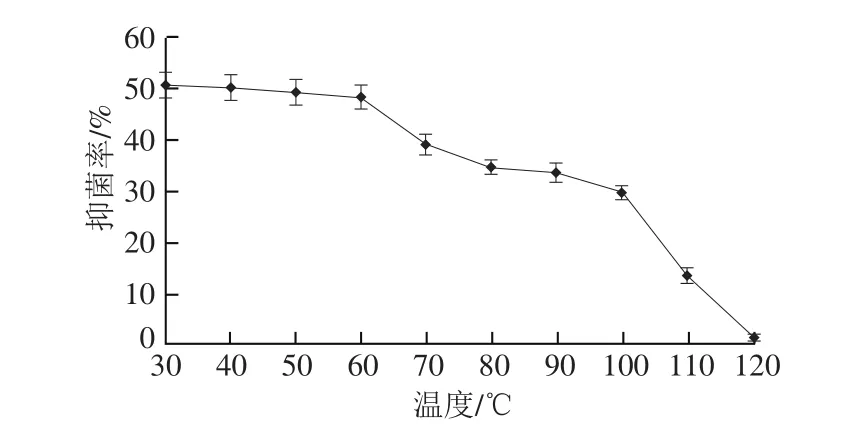
图3 温度对DSL-9蛋白粗提液抑菌活性的影响Fig.3 Effect of temperature on inhibitory activity of the antifungal substance from strain DSL-9
内生菌DSL-9蛋白粗提液具有较好的热稳定性,如图3所示,30~60 ℃水浴1 h抑菌率变化不大。随着处理温度逐渐升高,抑菌率逐渐下降。100 ℃热处理1 h,抑菌率是30 ℃的60%左右,在120 ℃热处理1 h,抑菌活性几乎丧失。
2.5.2 pH值对DSL-9蛋白粗提液抑菌活性的影响
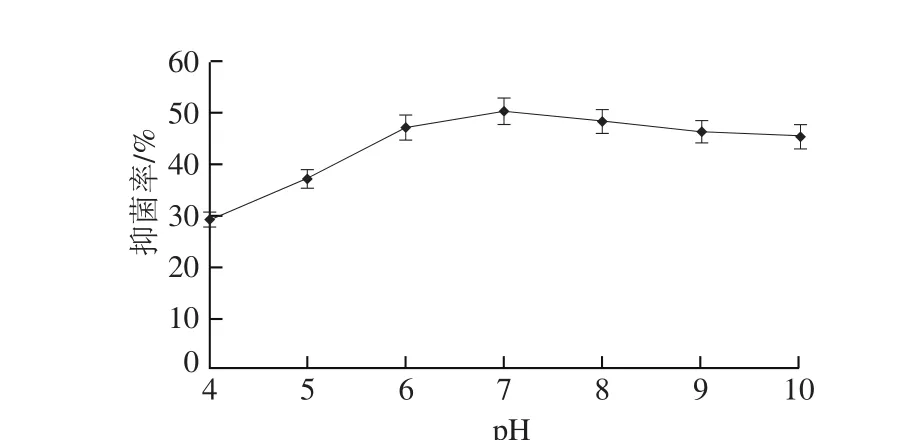
图4 pH值对DSL-9蛋白粗提液抑菌活性的影响Fig.4 Effect of pH on inhibitory activity of the antifungal substance from strain DSL-9
从图4可看出,蛋白粗提液在pH值在4~5区间抑菌率较低,在pH值为4时只有pH值为7时抑菌活性的58%。pH值为7时抑菌活性最高,pH值在7~10区间抑菌活性无明显变化,抑菌物质在碱性环境有活性。
2.5.3 紫外线对DSL-9蛋白粗提液活性的影响
DSL-9蛋白粗提液经25 W紫外灯照射后,抑菌率如图5所示,基本无变化,表明DSL-9抗菌物质对紫外线不敏感,具有一定的抗紫外线功能。
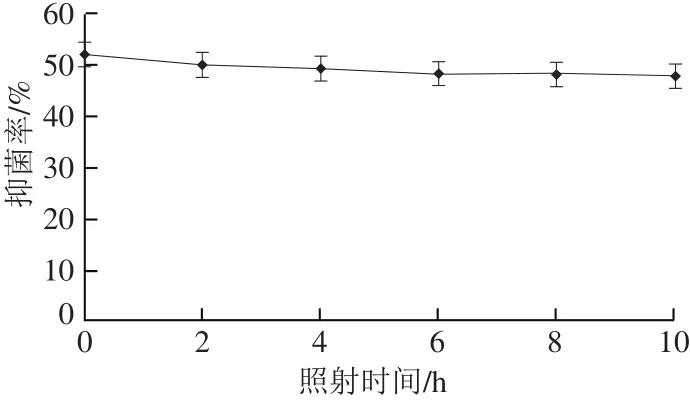
图5 紫外线对DSL-9蛋白粗提液抑菌活性的影响Fig.5 Effect of UV light on inhibitory activity of the antifungal substance from strain DSL-9
2.5.4 蛋白酶对DSL-9蛋白粗提液抑菌活性的影响
在用不同的蛋白酶对内生菌进行处理后,抑菌率的变化如图6所示,经不同蛋白酶处理后,抑菌率下降幅度较大(P<0.01),仍有部分抑菌率,说明DSL-9抑菌物质可能部分是蛋白质,部分是其他物质。
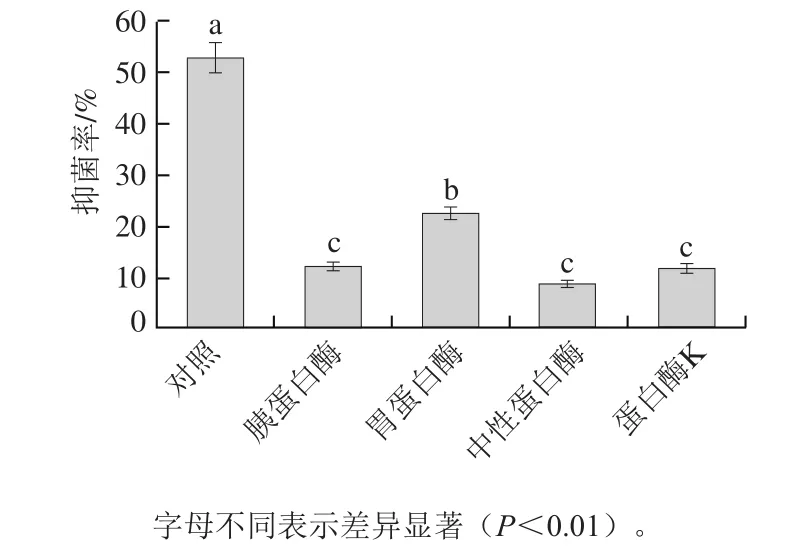
图6 蛋白酶对DSL-9蛋白粗提液抑菌活性的影响Fig.6 Effect of proteases on inhibitory activity of the antifungal substance from strain DSL-9
2.6 内生菌DSL-9对感染炭疽菌砀山梨的防御酶的影响
2.6.1 内生菌DSL-9对感染炭疽菌砀山梨PPO的影响
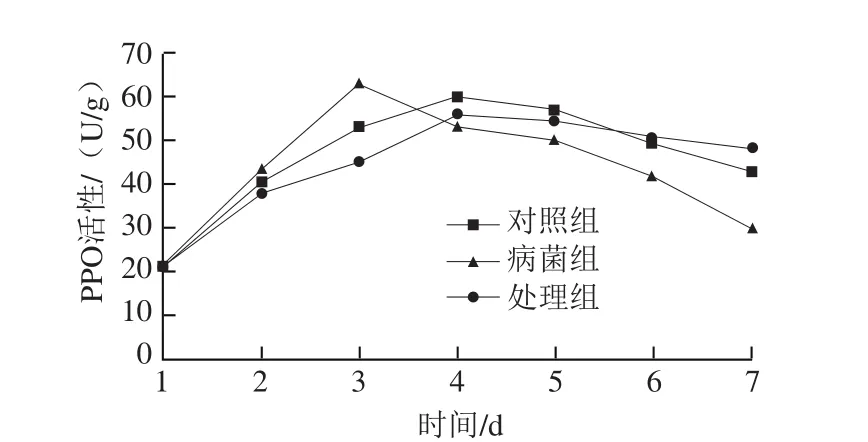
图7 内生菌DSL-9对感染炭疽菌砀山梨PPO的影响Fig.7 Effect of DSL-9 on PPO of Dangshan pear infected with anthrax
由图7可看出,腐败菌对砀山梨的侵染短时间内PPO活性是增高的,但随着侵染时间的延长,3 d后活性显著降低。可能是因为炭疽菌对果实侵染后,PPO迅速感应,活性显著升高,对植物组织起到一定的保护作用,但随着侵染时间的延长,PPO活性下降。处理组的PPO活性高峰出现在第4天,比病菌组推迟,且PPO最大活性低于病菌组。
2.6.2 内生菌DSL-9对感染炭疽菌砀山梨SOD的影响

图8 内生菌DSL-9对感染炭疽菌砀山梨SOD的影响Fig.8 Effect of DSL-9 on SOD of Dangshan pear infected with anthrax
从图8可看出,病菌组的SOD活性在第3天达到最大值,病菌的侵染属于生理性胁迫,可导致果肉组织产生大量活性氧和自由基,SOD的产生可保护植物细胞免受损伤。处理组的SOD活性变化和对照组的趋势一致,先上升后下降,这说明内生菌DSL-9能减轻病菌对梨果实的侵染。
2.6.3 内生菌DSL-9对感染炭疽菌砀山梨POD影响
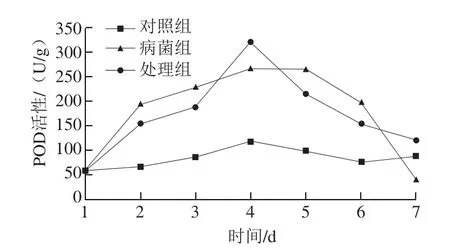
图9 内生菌DSL-9对感染炭疽菌砀山梨POD的影响Fig.9 Effect of DSL-9 on POD of Dangshan pear infected with anthrax
由图9可看出,病菌组和处理组POD活性变化趋势一致,先上升后下降,在第4天达到活性高峰,但是处理组的POD活性高峰大于病菌组,说明内生菌可能有诱导POD活性升高的作用。
2.6.4 内生菌DSL-9对感染炭疽菌砀山梨CAT的影响
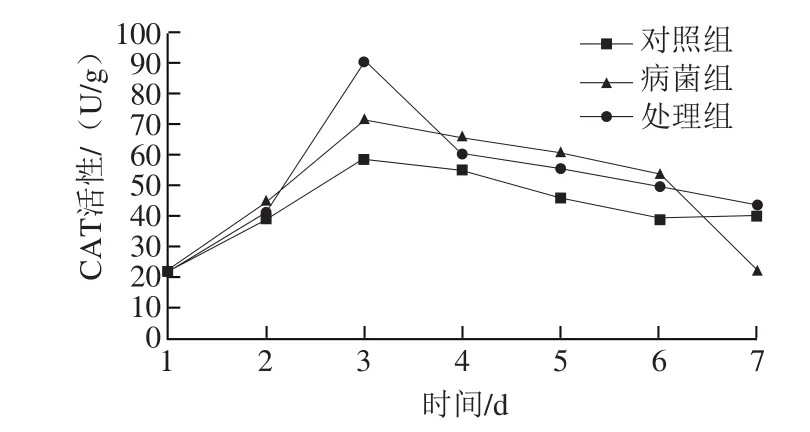
图10 内生菌DSL-9对感染炭疽菌砀山梨CAT的影响Fig.10 Effect of DSL-9 on CAT of Dangshan pear infected with anthrax
由图10可看出,内生菌DSL-9对感染炭疽菌砀山梨CAT的影响的趋势和其他防御酶相似,都是先上升后下降,CAT活性高峰出现在第3天,处理组CAT活性高于病菌组,说明内生菌可诱导CAT活性,提高砀山梨的抗性。
3 讨 论
近几年,砀山梨感染炭疽菌,导致产量急剧下降,使用化学农药作为杀菌剂易污染环境,危害人体健康。内生菌可作为生物防治菌,本实验从健康砀山梨中分离出15 株内生菌,采用平板对峙培养法筛选出1 株对砀山梨胶孢炭疽菌抑菌活性较高的菌株,命名为DSL-9,采用形态特征和16S rDNA,初步鉴定为枯草芽孢杆菌。据文献报道,枯草芽孢杆菌能够拮抗超过30 种的植物病原菌,是目前生物防治和水果保鲜中研究最多的一种有益微生物[23]。DSL-9发酵液经处理后发现无菌体发酵液具有较好抑菌活性,说明DSL-9菌株对炭疽菌的抑制作用主要是通过胞外分泌物作用的结果,这与先前报道一致[24]。
采用硫酸铵沉淀法获得DSL-9的粗蛋白提取液,蛋白提取液在30~60 ℃抑菌率无明显变化,高于60 ℃抑菌率下降,说明抑菌物质热稳定性较好。在pH 7~10区间抑菌活性较高,且无明显变化,说明抑菌物质在碱性环境具有较好的抑菌活性。紫外线对抑菌物质无明显影响。蛋白提取液经蛋白酶处理后,抑菌活性下降,但仍有部分抑菌活性,说明抑菌物质含有蛋白质,还可能含有其他物质,现已报道的枯草芽孢杆菌能产生的抗菌物质有肽类、环脂肽类、多烯类等[21]。枯草芽孢杆菌产生的脂肽类抗菌物质对蛋白酶具有稳定性;蛋白类抗菌物质热稳定性较差,易被蛋白酶分解[25-29],DSL-9产生的抗菌物质既有脂肽类抗菌物质也有蛋白抗菌物质。
PPO、POD、SOD和CAT共同组成了生物体内活性氧防御系统,在清除超氧阴离子自由基、H2O2和过氧化物以及组织或减少羟自由基形成等方面发挥重要作用。接种病原菌后果实中的防御酶活性均显著高于对照,且在观察期内出现活性高峰,说明果实在逆境条件下能最大限度的被激发产生防御酶活性,暂时减轻病害侵染造成的伤害,处理组的活性高峰低于病菌组,说明处理组的病害比病菌组要轻。侵染后期这些酶的活性均受到抑制作用,细胞内活性氧积累过多,造成膜脂过氧化,破坏质膜通透性,损坏细胞。病菌组在后期防御酶活性均低于对照组和处理组。
综上可知内生菌DSL-9可以抑制炭疽菌的生长并可能诱导果实产生抗性,内生菌DSL-9拮抗炭疽菌具体机制有待于进一步研究。
[1] 林玲, 乔勇升, 顾本康, 等. 植物内生细菌及其生物防治植物病害的研究进展[J]. 江苏农业学报, 2008, 24(6)∶ 969-974. DOI∶10.3969/j.issn.1000-4440.2008.06.049.
[2] 张祺玲, 杨宇红, 谭周进, 等. 植物内生菌的功能研究进展[J].生物技术通报, 2010(7)∶ 28-34. DOI∶10.13560/j.cnki.biotech.bull.1985.2010.07.016.
[3] 石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展[J]. 生态学报, 2006, 26(7)∶ 2395-2400. DOI∶10.3321/j.issn∶1000-0933.2006.07.044.
[4] 吴良庆, 朱立武, 衡伟, 等. 砀山梨炭疽病病原鉴定及其抑菌药剂筛选[J]. 中国农业科学, 2010, 43(18)∶ 3750-3758. DOI∶10.3864/j.issn.0578-1752.2010.18.008 .
[5] 高正辉, 张金云, 伊兴凯, 等. 砀山酥梨炭疽病发生特征与防治技术[J]. 安徽农业科学, 2010, 38(19)∶ 10445-10446. DOI∶10.3969/j.issn.0517-6611.2010.19.184.
[6] 于晓丽, 亓超, 王培松, 等. 果树真菌病害拮抗细菌的筛选、鉴定及拮抗机制初探[J]. 果树学报, 2016, 33(6)∶ 734-743. DOI∶10.1395/j.cnki.gsxb.0150483.
[7] 史凤玉, 朱英波, 吉志新, 等. 枯草芽孢杆菌QDH-1-1对采后苹果青霉病的抑制效果[J]. 中国食品学报, 2007, 7(4)∶ 80-82. DOI∶10.3969/j.issn.1009-7848.2007.04.016 .
[8] 刘起丽, 张建新, 徐瑞富, 等. 柑橘皮内生细菌分离及柑橘青霉病菌拮抗菌筛选研究[J]. 中国农学通报, 2011, 27(28)∶ 235-239.
[9] 柳凤, 何红, 詹儒林, 等. 拮抗芒果炭疽病菌的红树内生细菌筛选及AiL3菌株抗菌物质研究[J]. 中国生物防治, 2010, 26(3)∶ 293-299.
[10] 李春玲, 王庆国, 胥丽娜, 等. 一株芒果炭疽病拮抗菌抑菌活性的研究及其鉴定[J]. 食品工业科技, 2012, 33(11)∶ 110-115.
[11] 石晶盈, 刘爱媛, 李雪萍, 等. 番木瓜果实内生细菌MGP3菌株的鉴定及拮抗作用[J]. 微生物学报, 2011, 51(9)∶ 1240-1247.
[12] 袁红旭, 陈勇明, 何财能, 等. 拮抗炭疽病的柑橘内生细菌的分离与筛选[J]. 果树学报, 2005, 22(5)∶ 510-514. DOI∶10.3969/j.issn.1009-9980.2005.05.017.
[13] 刘锦霞, 李娜, 李晶, 等. 生防菌株SW11在番茄植株上的定殖能力及其对番茄灰霉病的防控效[J]. 中国生物防治学报, 2015, 31(3)∶353-360. DOI∶10.16409/j.cnki.2095-039x.2015.03.010.
[14] 郑雪芳, 刘波, 朱育菁, 等. 番茄青枯病生防芽胞杆菌的筛选与鉴定[J]. 中国生物防治学报, 2016, 32(5)∶ 657-665. DOI∶10.16409/j.cnki.2095-039x.2016.05.016.
[15] 陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报, 2015, 31(5)∶ 723-732. DOI∶10.16409/j.cnki.2095-039x.2015.05.012.
[16] 雍道敬, 彩霞, 李桂舫, 等. 内生放线菌A-1对苹果果实轮纹病的防效及防御性酶活性的影响[J]. 植物保护学报, 2014, 41(3)∶ 336-340.
[17] 黄海婵, 裘娟萍. 枯草芽孢杆菌防治植物病害的研究进展[J]. 浙江农业科学, 2005(3)∶ 213-215. DOI∶10.3969/j.issn.0528-9017.2005.03.022.
[18] 邢介帅, 李然, 赵蕾, 等. 生防芽孢杆菌T2胞外蛋白酶的纯化及其抗真菌作用[J]. 植物病理学报, 2008, 38(4)∶ 377-381. DOI∶10.3321/j.issn∶0412-0914.2008.04.007.
[19] 魏彩燕, 毛雪琴, 柴荣耀, 等. 草莓炭疽病生防菌株MT-06的鉴定及生物学特性[J]. 菌物学报, 2010, 29(4)∶ 481-487.
[20] HOLT G J, KRIEG N R, SNEATH P H A, et al. Bergey’ smanual of determinative bacteriology[M]. 9th ed. Baltimore: Williams &Wilkins, 1994: 260-274.
[21] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京∶ 科学出版社,2001∶ 108-110.
[22] 郭志华, 杨洪. 分离自藏灵菇的乳酸菌的益生特性[J]. 食品与发酵工业, 2013, 39(1)∶ 151-154.
[23] 黄曦, 张荣灿, 王何健, 等. 枯草芽孢杆菌ON-6菌株抑制荔枝炭疽菌活性物质的初步研究[J]. 中国农学通报, 2011, 27(13)∶ 188-193.
[24] 汪远, 詹儒林, 何红, 等. 红树内生细菌菌株Kc-38的抗菌物质及对采后芒果炭疽病的防效[J]. 中国生物防治学, 2011, 27(1)∶ 82- 87.
[25] OHNO A, ANO T, SHODA M. Effect of temperature change and aeration on the production of antifungal peptide antibiotic iturin by Bacillus subtilis NB22 in liquid cultivation[J]. Journal of Fermentations and Bioengineering, 1993, 75(6)∶ 463-465.DOI∶10.1016/0922-338x(93)90098-s.
[26] AKPA E, JACQUES P, WATHELET B. Influence of culture conditions on lipopeptide production by Bacillus subtilis[J]. Applied Biochemistry and Biotechnology, 2001, 93(9): 551-561. DOI:10.1385/ABAB:91-93:1-9:551.
[27] KENJI T, TAKAHASHI A, MAKOTO S. Isolation of a gene essential for biosynthesis of the lipopeptide anti bioticsplipastatin B1 and surfactinin Bacillus subtilis YB8[J]. Archives of Microbiology, 1996,165: 243-251. DOI:10.1007/s002030050322.
[28] STOVER A G, DRIKS A. Secretion, localization, and antibacterial activity of TasA, a Bacillus subtilis pore-associated protein[J]. Journal of Bacteriology, 1999, 181(5)∶ 1664-1672.
[29] 王祺, 张一名, 赵君, 等. 枯草芽孢杆菌S-16抑菌活性物质的理化性质及培养条件的研究[J]. 中国生物防治学报, 2015, 31(3)∶ 439-444.DOI∶10.16409/j.cnki.2095-039x.2015.03.022.

