新采收玉米籽粒中水分状态对淀粉热特性的影响
曹 勇,许秀颖,赵城彬,张 浩,闫美茹,刘景圣*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
玉米是世界重要粮食作物之一,根据国家统计局和美国农学会统计,在2014年和2015年,中国已经超过美国,成为全球玉米种植面积最多的国家,并且是玉米第二大生产国。玉米淀粉约占世界淀粉总产量80%以上,是人类主要食物来源和重要工业原料[1]。东北地区是我国玉米主产区之一,是世界玉米黄金带之一,年总产量约占全国玉米总产量的40%。东北地区玉米多属于秋粮晚熟品种,玉米收获入庭院时水分普遍在28%~35%之间,自然晾晒干燥是当地玉米主要干燥方式。收购入库时会进一步依靠机械烘干方式将玉米水分降到14%以下,以达到安全储藏要求。
新收获玉米采后干燥条件对玉米食用品质具有重要影响。对新采收玉米人工干燥时,直链淀粉含量上升[2],新采收玉米中抗性淀粉含量最高,自然储藏一段时间含量逐渐降低[3]。新收获玉米饲料消化能低[4],淀粉提取率低[5],随着热风干燥温度的升高,玉米淀粉糊化温度升高,凝胶焓值下降[6],干燥温度改变玉米淀粉结构,导致了淀粉功能特性发生变化[7-8]。对玉米长期储藏过程中玉米淀粉、蛋白质、脂肪含量及品质变化研究较多[9-10],对新采收玉米淀粉理化特性变化机理并不明确,导致东北地区新采收玉米利用受到限制。我国对新采收玉米品质的基础研究还很薄弱,在干燥条件如何影响玉米食用、加工和储藏品质等基础理论研究方面与发达国家相比差距甚远[7]。因此,研究新采收玉米籽粒水分分布和迁移规律淀粉变化机制,对提高玉米食用品质、优化玉米淀粉特性、提高淀粉转化率、降低采后损失具有科技战略意义。
基于玉米籽粒自然脱水速率的不同,本研究以中国东北地区2 个主栽玉米品种郑单958(Zd958)和先玉335(Xy335)为研究对象,新采收后立即储藏在恒定温湿度条件下,运用低场强核磁共振(low fi eld-nuclear magnetic resonance,LF-NMR)技术和差示扫描量热(differential scanning calorimeter,DSC)技术,对其2 个月内籽粒水分状态和淀粉热特性进行研究,以期得到新玉米采后水分分布和迁移信息,及其对淀粉结构影响机制,为进一步开展玉米淀粉精深加工和高效利用提供基础数据。
1 材料与方法
1.1 材料与试剂
中国东北地区普通玉米Zd958和Xy335,产自中国辽源金洲(43°03’N、125°17’E)。2014年和2015年种植和田间管理条件相同,成熟度一致,水分质量分数为(35±3)%时收获。储藏条件为(20±2)℃,相对湿度(55±5)%,确保储藏过程中无昆虫和霉菌侵害,定期取样。
亚硫酸氢钠(分析纯) 北京化工厂;实验用水为去离子水。
1.2 仪器与设备
HWS外循环恒温恒湿培养箱 宁波东南仪器有限公司;Infratec™近红外谷物分析仪 丹麦福斯分析仪器有限公司;LF-NMR仪 上海纽迈电子科技有限公司;Q2000 DSC仪 美国TA公司。
1.3 方法
1.3.1 玉米淀粉提取
参考Lin Lingshang等[11]方法。将采后不同时间玉米籽粒浸泡于20 ℃的0.25%亚硫酸氢钠溶液中48 h,剥去种皮与胚,料水比1∶2(g/mL)湿磨。保留100、200 目浆液,去离子水多次洗涤,3 000 r/min离心10 min,去除上层黄色,重复离心5 次,40 ℃干燥24 h,干燥器里室温保存。
1.3.2 玉米籽粒中水分含量及迁移
采用近红外谷物分析仪测定玉米籽粒总水分含量。水分状态采用LF-NMR测定。分别取采后储藏不同时间约3 g玉米籽粒放入到15 mm直径核磁管中。采用Carr-Purcell-Meiboom-Gill(CPMG)程序测定玉米籽粒中横向弛豫时间T2[12],重复采样16 次,回波个数3 000。
1.3.3 玉米淀粉热特性测定
采用Q 2 0 0 0 D S C测定淀粉热力学性质。将(5.00±0.02)mg淀粉置于铝坩埚中,加(15.00±0.02)mg蒸馏水,搅拌均匀,密封,室温平衡2 h。起始温度为20 ℃,以5 ℃/min的速率升到120 ℃[13]。记录糊化过程的DSC曲线和起始温度(T0)、峰值温度(TP)、转变温度范围(R)和糊化焓值(ΔH)。以空坩埚为参比,N2流速为50 mL/min。采用TA Universal Analysis 2000软件分析。
1.4 数据统计分析
采用SPSS软件进行数据统计分析,差异显著性(P<0.05)分析使用Tukey HSD程序,使用Pearson相关系数进行相关性分析。采用Origin 8.5软件作图。
2 结果与分析
2.1 籽粒水分含量分析
水分含量影响和改变玉米淀粉的结构和理化特性[14-15]。玉米安全储藏要求籽粒的水分质量分数下降到14%,水分活度达到0.70[16]。在这一水分条件下,可以保障粮食的储藏安全,维持粮食新鲜度和食用及营养品质。在干燥过程中,淀粉性质改变归因于淀粉颗粒周围可利用的水分子[17]。新收获玉米籽粒在恒定条件下储藏,水分呈现显著下降趋势(P<0.05),如图1所示。Zd958新收获的水分质量分数为38.85%,Xy335新收获的水分质量分数36.55%,2种玉米相同采收期水分含量差异主要由于品种不同造成。2种玉米在恒温恒湿相同条件下水分下降速度不同,Xy335失水率高于Zd958。Xy335水分质量分数在储藏40 d时下降到10%,相同时间Zd958下降到14.33%。由于水分子在玉米各组织中分布和迁移的不同,总的水分含量不能充分说明水分在籽粒各组织中存在状态,对水分子迁移和水分子与生物大分子之间关系的深入理解和研究仍然缺乏,还需进一步深入研究。
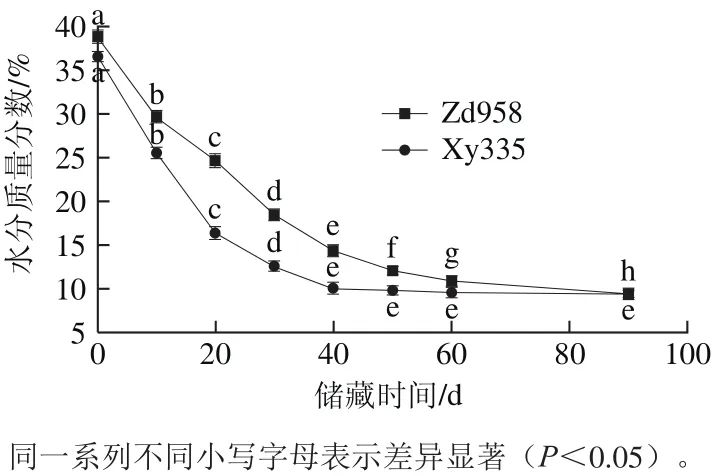
图1 新采收玉米籽粒水分含量变化Fig.1 Variations in moisture content of postharvest maize
2.2 水分迁移及分布
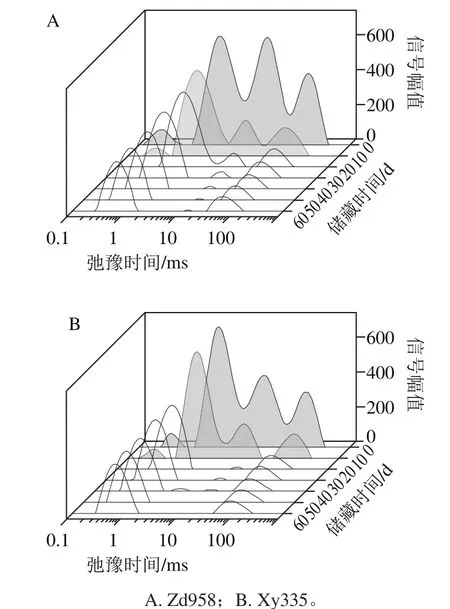
图2 新采收玉米LF-NMR T2弛豫时间分布曲线Fig.2 LF-NMR T2 relaxation time distribution curves of postharvest maize grains
传统测量水分质量分数方法破坏样本的完整性,操作复杂,费时费力,并且无法给出水分在籽粒内部分布和运动的信息,LF-NMR技术可以快速、准确、无损地检测干燥过程食品水分质量分布和迁移[18-20],在研究食品加工及储藏过程中大分子变化机理方面具有明显优势。复杂体系中质子T2弛豫时间的归属及解释已被详细研究[21-22]。研究表明,通过NMR技术所测定的淀粉体系中质子信号可以变现出几种不同状态,NMR技术是淀粉大分子微观结构研究的有力工具[21-23]。LF-NMR技术可以利用氢质子在磁场中的自旋-弛豫特性,微观地分析其中的水分状态及与淀粉、蛋白质等大分子结合作用[24]。本研究运用LF-NMR技术研究2 种玉米籽粒新收获后水分迁移和分布情况,如图2所示,玉米籽粒在采后10 d内,籽粒中质子T2弛豫时间分布曲线中出现4 个部分,T2b和T21是质子弛豫发生最快的部分,弛豫时间范围在0.1~5.0 ms之间,T22是中间部分,弛豫时间范围在5~50 ms,T23是质子弛豫发生最慢的部分,弛豫时间范围为50~200 ms。T2b和T21为与淀粉和蛋白等大分子结合最紧密的“结合水”,也可能是大分子的组成部分。T22为颗粒内部可缓慢交换的“准结合水”[24]。T23为存在颗粒外部可移动的自由水。玉米籽粒在储藏10 d之后,随着时间的延长水分的迁移,T2弛豫时间分布曲线中质子为3种状态,T21逐渐减小,T2b消失。同时,胚芽油中质子信号也处于这个范围。通过测定真空干燥后玉米胚芽的T2谱图可以确定,在50~200 ms处出现为玉米胚芽油中质子信号。
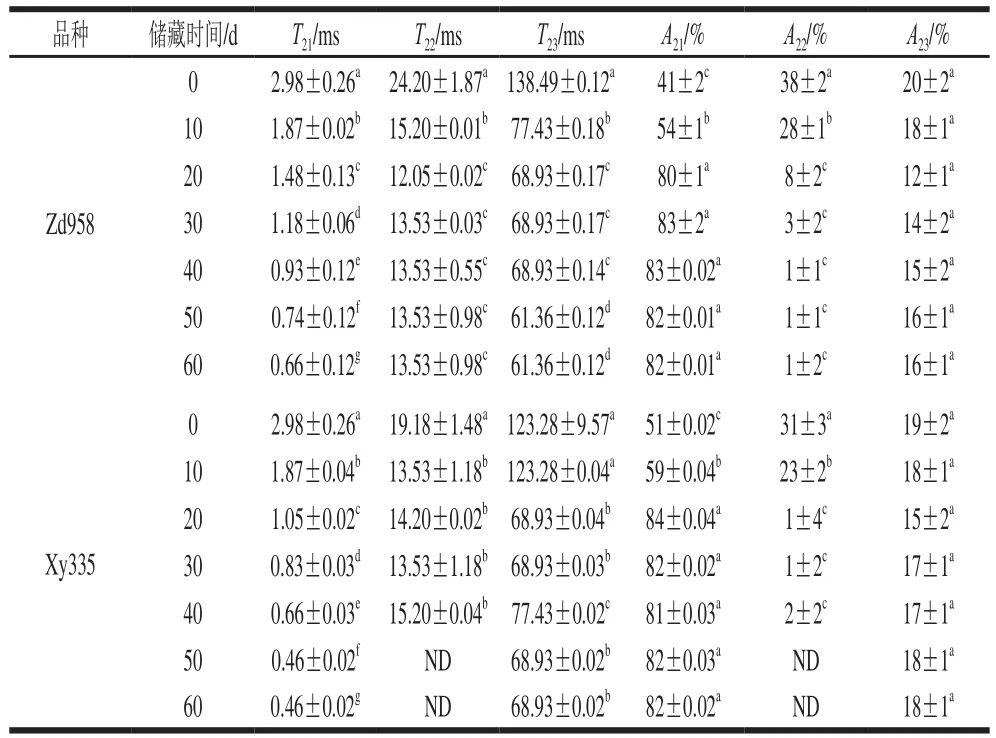
表1 新采收玉米LF-NMR T2参数变化(n=10)Table1 Changes in T2 parameters of postharvest maize (n= 10)
通过峰面积相对含量得出采后LF-NMR T2参数变化,结果如表1所示。新采收玉米采后T2弛豫时间和比例呈显著变化(P<0.05),表明采后自然干燥时间对水分的迁移和分布具有显著影响。T2面积呈显著下降趋势(P<0.05),表明新收获后籽粒中水分含量逐渐下降,这是由于水分不断挥发至空气中。在10 d内发现,T21结合水呈现2 个部分,这是基于水分子同大分子结合键的力量大小[21],分别为紧密的结合水和松散结合水(图2)。随着采后时间延长,这2 种结合水合并为一个峰,Zd958中T21弛豫时间从2.98 ms逐渐降低到0.66 ms。Xy335的T21弛豫时间从2.98 ms逐渐降低到0.46 ms。说明期间籽粒内的氢质子自由度和水分流动性在逐渐降低,与大分子结合力逐渐增强。Zd958玉米中T22从24.20 ms下降到13.53 ms。Xy335玉米中T22从19.18 ms逐渐降低到13.53 ms。T2三部分的面积呈显著下降(P<0.05),表明储藏过程中各状态的水分含量逐渐下降,A21、A22和A23分别代表3 种状态水所占面积百分比,2 种玉米A21面积比例采后初期呈显著上升(P<0.05),A22准结合水和A23自由水在储藏初期下降很快,Zd958的A22在储藏40 d后降至1%,并保持不变。Xy335中A22在50 d时未检出。A23的面积在20 d后不在变化,说明籽粒的自由水在20 d即挥发完全。Hills等[25]研究表明,质子弛豫时间的测量主要反映的是生物大分子结构状态,而不仅是水分子的状态。T21随储藏时间逐渐延长显著降低(P<0.05),表明了水与大分子,主要是水分子和淀粉分子,水分子同蛋白分子间的结合力逐渐增强。
2.3 淀粉热特性分析
2 种玉米淀粉在采后储藏不同时间的DSC热力学特性参数变化见表2。Zd958和Xy335采后不同时期间玉米淀粉在60~80 ℃之间出现窄而明显吸热峰,此峰为淀粉热吸收特征峰,为支链淀粉双螺旋结构打开所需要的能量[26-27]。糊化温度和热焓值变化反映了淀粉的微晶结构以及结晶程度,糊化温度越高,表明晶体结构越完整,淀粉颗粒内部微晶部分排列和结晶度增加。热焓值主要反映糊化时破坏淀粉双螺旋结构所需能量,衡量淀粉糊化之前淀粉颗粒内部分子链段有序性,反映淀粉颗粒结晶度的重要参数,淀粉颗粒有序结果破坏会导致糊化焓值下降。淀粉热力学特性表现为淀粉颗粒加热过程中双螺旋晶体相转变温度和吸热焓的变化等,是影响食品加工过程重要性质之一[28]。研究表明淀粉颗粒表面形貌、粒度分布、结晶结构、分子质量、直链淀粉含量、支链中链长分布等因素均影响淀粉的凝胶热特性,凝胶温度与支链中短链和支链中长链比率正相关[29],直链淀粉含量高,糊化温度升高[30]。采后随着自然干燥过程的进行,引起了玉米淀粉热特性的变化。2 种玉米起始温度T0变化范围分别为60.89~61.91 ℃(Zd958)和59.11~61.98 ℃(Xy335),峰值温度TP变化范围分别为66.90~67.52 ℃(Zd958)和65.68~67.92 ℃(Xy335),转变温度R变化范围分别在7.08~7.70 ℃(Zd958)和7.60~8.30 ℃(Xy335),与Wrigley等[1]报道相一致,变化不明显。2 种玉米淀粉新采收0 d时糊化吸收焓值最小,Zd958玉米淀粉焓值为3.24 J/g,Xy335玉米淀粉焓值为4.06 J/g,说明新采收的玉米淀粉支链双螺旋结构还没有完全形成,这可能是由于新采收时淀粉分子链之间存在大量水分子,影响了支链淀粉分子之间双螺旋结晶结构的形成。随着储藏时间的延长,玉米籽粒中水分逐渐降低。当采后储藏40 d时,2 种玉米淀粉糊化吸收焓值逐渐显著升高(P<0.05)达到最大值,Zd958为18.54 J/g,Xy335为15.06 J/g,之后趋于稳定。吸热焓值升高说明新玉米采收后,淀粉分子中支链双螺旋结构发生了变化,在采收后40 d内支链分子之间缔合得更加紧密。
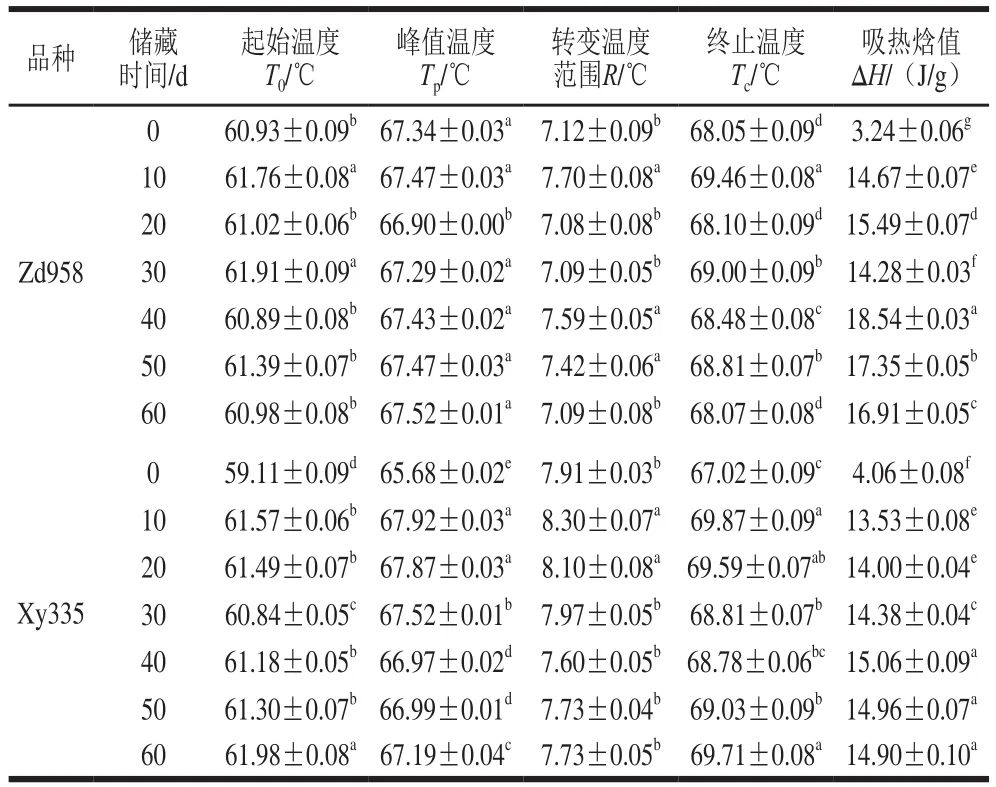
表2 新采收玉米淀粉热特性变化(n=3)Table2 Changes in thermal properties of starches of postharvest maize (n= 3)

表3 水分含量、T2和糊化焓值相关性分析Table3 Correlation coeff i cients between moisture content, T2 and gelatinization enthalpy
如表3所示,根据对水分含量,T2分布及迁移和吸热焓值Pearson相关性分析结果表明,2 种新采收玉米具有相同的变化规律表现为,质子横向弛豫中T21与T23呈极显著相关(P<0.01),T21与A21呈极显著负相关(P<0.01),T21与A22呈极显著正相关(P<0.01)。T21与籽粒水分含量呈极显著相关(P<0.01),与凝胶吸热焓值(ΔH)呈极显著负相关(P<0.01),T21减小说明籽粒内的氢质子自由度和水分流动性在逐渐降低,水分子与淀粉结合力逐渐增强。淀粉分子在缓慢干燥过程中晶体区结构变得更加有序,或者结晶区比例增加,导致淀粉糊化解开支链淀粉双螺旋结构能量相应增加。2 种玉米中A21和A22相关性很大,呈极显著负相关(P<0.01),A21与吸热焓值呈显著相关(P<0.05)。A21与籽粒水分含量极显著相关(P<0.01),特别是当2 种玉米籽粒总的水分含量降低至安全水含量14%时,A21值均为83%。而达到准结合水和自由水全部散失时,不同品种需要时间不同,Zd958需要多于60 d,而Xy335需要40 d,此时,2 种玉米籽粒A21占总面积的82%和81%。表明在干燥过程中当A21值为81%~82%时,此时玉米籽粒中准结合水和自由水含量极低,达到干燥标准,这一判定值要比14%安全水更准确。结果表明,可以利用LF-NMR技术研究籽粒中水分状态情况,并且可以精确判断新玉米采后干燥进程,是进一步了解籽粒中大分子结构特性变化有利工具。
3 结 论
东北地区新采收玉米籽粒内部结合水、准结合水和自由水迁移的分布呈显著变化(P<0.05)。随着总水分的逐渐降低,各状态水分子T2弛豫时间逐渐减小。2 种淀粉凝胶焓值在40 d达到最大分别为18.54 J/g和15.06 J/g,玉米籽粒中结合水T21与籽粒水分含量极显著正相关(P<0.01),A21与籽粒水分含量极显著负相关(P<0.01),A21与淀粉凝胶吸热焓值显著相关(P<0.05),这说明采后大分子结构受到水分迁移和分布的影响。利用LF-NMR技术可以有效研究水分状态对大分子结构的影响,其结合水A21为83%即代表籽粒水分含量处在安全水范围,为玉米籽粒的后续加工及储藏提供理论依据。
[1] WRIGLEY C W, CORKE H, SEETHARAMAN K, et al.Encyclopedia of food grains[M]. 2nd ed. USA: Academic Press, 2016:194-200. DOI:10.1016/B978-0-12-394437-5.00241-2.
[2] COWIESON A J. Factors that affect the nutritional value of maize for broilers[J]. Animal Feed Science and Technology, 2005, 119: 293-305.DOI:10.1016/j.anifeedsci.2004.12.017.
[3] 袁建敏, 王茂飞, 卞晓毅, 等. 玉米的化学成分含量及影响因素研究进展[J]. 中国畜牧杂志, 2016, 52(11): 69-72. DOI:10.3969/j.issn.0258-7033.2016.11.015.
[4] MARKS B P, STROSHINE R L. Effects of previous storage history,hybrid, and drying method on the storability of maize grain (corn)[J].Journal of Stored Products Research, 1995, 31(4): 343-354.DOI:10.1016/0022-474X(95)00020-8.
[5] CHEN M H, DIEN B S, VINCENT M L, et al. Effect of harvest maturity on carbohydrates for ethanol production from sugar enhanced temperate × tropical maize hybrid[J]. Industrial Crops and Products,2014, 60: 266-272. DOI:10.1016/j.indcrop.2014.06.015.
[6] HAROS M, TOLABA M P, SUAREZ C. Inf l uence of corn drying on its quality for the wet-milling process[J]. Journal of Food Engineering,2003, 60: 177-184. DOI:10.1016/S0260-8774(03)00038-4.
[7] MALUMBA P, MASSAUX C, DEROANNE C, et al. Influence of drying temperature on functional properties of wet-milled starch granules[J]. Carbohydrate Polymers, 2009, 75(2): 299-306.DOI:10.1016/j.carbpol.2008.07.027.
[8] GIORNI P, DALL'ASTA C, GREGORI R, et al. Starch and thermal treatment, important factors in changing detectable fumonisins in maize post-harvest[J]. Journal of Cereal Science, 2015, 61: 78-85.DOI:10.1016/j.jcs.2014.10.006.
[9] KETTHAISONG D, SURIHARN B, TANGWONGCHAI R, et al.Changes in physicochemical properties of waxy corn starches after harvest, and in mechanical properties of fresh cooked kernels during storage[J]. Food Chemistry, 2014, 151: 561-567. DOI:10.1016/j.foodchem.2013.11.104.
[10] PARAGINSKI R T, VANIER N L, BERRIOS J, et al.Physicochemical and pasting properties of maize as affected by storage temperature[J]. Journal of Stored Products Research, 2014, 59: 209-214. DOI:10.1016/j.jspr.2014.02.010.
[11] LIN L S, GUO D, ZHAO L, et al. Comparative structure of starches from high-amylose maize inbred lines and their hybrids[J]. Food Hydrocolloids, 2016, 52: 19-28. DOI:10.1016/j.foodhyd.2015.06.008.
[12] 成昕, 张锦胜, 钱菲, 等. 核磁共振技术研究普通玉米淀粉与玉米抗性淀粉对肉糜持水性的影响[J]. 食品科学, 2011, 32(7): 21-24.
[13] 李文浩, 谭斌, 刘宏, 等. 我国9 个品种绿豆淀粉的理化特性研究[J]. 中国食品学报, 2013, 13(4): 58-64. DOI:10.16429/j.1009-7848.2013.04.022.
[14] ALTAY F, GUNASEKARAN S. Influence of drying temperature,water content, and heating rate on gelatinization of maize starches[J].Journal of Agricultural and Food Chemistry, 2006, 54(12): 4235-4245.DOI:10.1021/jf0527089.
[15] MAIORANOA A, FANCHINI D, DONATELLI M M. Moisture,a process-based model of moisture content in developing maize kernels[J]. European Journal of Agronomy, 2014, 59: 86-95.DOI:10.1016/j.eja.2014.05.011.
[16] BATTILANI P, FORMENTI S, RAMPONI C, et al. Dynamic of water activity in maize hybrids is crucial for fumonisin contamination in kernels[J]. Journal of Cereal Science, 2011, 54(3): 467-472.DOI:10.1016/j.jcs.2011.08.014.
[17] MALUMBA P, JANAS S, ROISEUX O, et al. Comparative study of the effect of drying temperatures and heat-moisture treatment on the physicochemical and functional properties of maize starch[J].Carbohydrate Polymers, 2010, 79(3): 633-641. DOI:10.1016/j.carbpol.2009.09.013.
[18] 张绪坤, 祝树森, 黄俭花, 等. 用低场核磁分析胡萝卜切片干燥过程的内部水分变化[J]. 农业工程学报, 2012, 28(22): 282-286.DOI:10.3969/j.issn.1002-6819.2012.22.039.
[19] 任广跃, 曾凡莲, 段续, 等. 利用低场核磁分析玉米干燥过程中内部水分变化[J]. 中国粮油学报, 2016, 31(8): 95-99. DOI:10.3969/j.issn.1003-0174.2016.08.017.
[20] 郭希娟, 王瑞琦, 杨铭铎. 油炸挂糊肉片在贮藏过程中水分的动态变化[J]. 食品科学, 2016, 37(20): 268-273. DOI:10.7506/spkx1002-6630-201620045.
[21] LI T, TU C H, RUI X, et al. Study of water dynamics in the soaking,steaming, and solid-state fermentation of glutinous rice by LF-NMR:a novel monitoring approach[J]. Journal of Agricultural and Food Chemistry, 2015, 63(12): 3261-3269. DOI:10.1021/acs.jafc.5b00769.
[22] 肖东, 周文化, 陈帅, 等. 亲水多糖对鲜湿面货架期内水分迁移及老化进程的影响[J]. 食品科学, 2016, 37(18): 298-303. DOI:10.7506/spkx1002-6630-201618047.
[23] 邵小龙, 汪楠, 时小转, 等. 水稻生长过程中籽粒水分状态和横向弛豫特性分析[J]. 中国农业科学, 2017, 50(2): 240-249. DOI:10.3864/j.issn.0578-1752.2017.02.004.
[24] MARCONE M F, WANG S, ALBABISH W, et al. Diverse food-based applications of nuclear magnetic resonance (NMR) technology[J].Food Research International, 2013, 51(2): 729-747. DOI:10.1016/j.foodres.2012.12.046.
[25] HILLS B P, TAKACS S F, BELTON P. A new interpretation of proton NMR relaxation time measurements of water in food[J].Food Chemistry, 1990, 37(2): 95-111. DOI:10.1016/0308-8146(90)90084-H.
[26] CARRERA Y, UTRILLA-COELLO R, BELLO-PEREZ A, et al.In vitro digestibility, crystallinity, rheological, thermal, particle size and morphological characteristics of pinole, a traditional energy food obtained from toasted ground maize[J]. Carbohydrate Polymers, 2015,123: 246-255. DOI:10.1016/j.carbpol.2015.01.044.
[27] TENG A, WITT T, WANG K, et al. Molecular rearrangement of waxy and normal maize starch granules during in vitro digestion[J]. Carbohydrate Polymers, 2016, 139: 10-19. DOI:10.1016/j.carbpol.2015.11.062.
[28] COOKE D, GIDLEY M J. Loss of crystalline and molecular order during starch gelatinization: origin of the enthalpic transition[J].Carbohydrate Research, 1992, 227: 103-112. DOI:10.1016/0008-6215(92)85063-6.
[29] PATINDOL J, GU X, WANG Y J. Chemometric analysis of the gelatinization and pasting properties of long-grain rice starches in relation to fine structure[J]. Starch, 2009, 61: 3-11. DOI:10.1002/star.200800022.
[30] MAACHE-REZZOUG Z, ZARGUILI I, LOISEL C, et al. Structural modifications and thermal transitions of standard maize starch after DIC hydrothermal treatment[J]. Carbohydrate Polymers, 2008, 74:802-812. DOI:10.1016/j.carbpol.2008.04.047.

