生物解离大豆过程中形成的乳状液结构
王立敏,马文君,孙红波,寻崇荣,张 丽,江连洲,隋晓楠,李 杨*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
生物解离(又称为水酶法)是近几年来新兴的一种经济、安全、绿色环保的提油方法,但是生物解离提油过程中大部分油脂被包裹在乳状液中,限制了油脂提取率[1]。生物解离乳状液是生物解离提油过程中由于双亲性的大豆蛋白和磷脂吸附在乳状液油水界面而形成的一种稳定、复杂水包油(O/W)非均相体系[2]。乳状液的破除是大豆生物解离技术目前最大的瓶颈之一[3],因此,探究乳状液的稳定特性从而选择合适的破除技术提高油脂提取率是普及该技术的重要途径之一。
影响生物解离乳状液稳定性的因素有多种,乳状液的稳定性与乳状液组成、界面性质(表面张力和表面疏水性)、界面蛋白组成、结构特征及组分间的分子相互作用等紧密相关[4]。而现今文献对生物解离乳状液大多数集中在对乳状液的组分分析及界面性质研究,De Moura Bell等[5]发现乳状液中磷脂主要是磷脂酸且具有较好的乳化性质,水苏糖和蔗糖是乳状液中主要的碳水化合物,约占总碳水化合物的55%,另外乳状液中71%的多肽分子质量小于20 kDa;Li Pengfei等[6]发现用两种酶(Protex 50FP、木瓜蛋白酶)处理乳状液时,乳状液的界面张力和表面疏水性都降低乳状液越发不稳定,分析酶解过程产生中的小分子肽竞争吸附在油水界面,界面蛋白被小分子肽替代,削弱了蛋白质的相互作用界面张力减弱,同时酶解成的分子肽亲水性较好,导致表面疏水性降低;也有学者对乳状液中分子间相互作用进行了一定的研究。郑力军等[7]研究了原油乳状液中表面活性剂与小分子等的相互作用,发现一些小分子可以与表活剂产生协同作用,进而高效地富集表面活性剂于油水界面,降低界面张力。Li Jinjiang等[8]研究发现乳状液中油脂与蛋白的亲和力取决于油脂与蛋白之间的相互作用及吸附蛋白分子的活性,吸附蛋白的电荷静电斥力也会阻止油滴表面分子间的相互作用。然而,鲜有关于对生物解离乳状液的结构特征及分子间相互作用研究,但透彻解析乳状液结构特征及分子间相互作用是揭示乳状液稳定机制的重要途径。
Li Yang等[9]研究指出生物解离提油工艺中酶解3 h,酶添加量2%时酶解程度已达到最大、提油率最高,因此本实验以不同酶解时间(1、2、3 h)、酶添加量(1%、2%)生物解离大豆乳状液为研究对象。从乳状液中蛋白水解度、显微观察、Zeta电位、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及乳状液与对应酶解条件下大豆分离蛋白(soy protein isolate,SPI)之间内源性荧光变化对乳状液结构及分子间相互作用进行探究,明确生物解离大豆乳状液结构与稳定性之间的构效关系,以期开发新型高效破乳技术,创新升级大豆生物解离技术提供理论依据及应用指导。
1 材料与方法
1.1 材料与试剂
大豆由东北农业大学大豆研究所提供;挤压膨化大豆粉(挤压膨化的大豆粕经研磨、过60 目筛;成分(质量分数):蛋白40%、脂肪17%、纤维7%) 山东高唐蓝山股份有限公司;碱性蛋白酶Protex 6L(8 900 U/mL)诺维信生物技术有限公司;氢氧化钠、正己烷、盐酸均为国产分析纯。
1.2 仪器与设备
UIS2奥林巴斯显微镜 上海维翰光电科技有限公司;Zetasizer Nanozs 90电位仪 英国马尔文公司;F-4500荧光分光光度计 日本Hitachi公司;Allegra64R台式高速冷冻离心机 美国贝克曼公司;磁力搅拌器 广州仪科实验仪器有限公司;HH-4电热恒温水浴锅 余姚市东方电工仪器厂。
1.3 方法
1.3.1 生物解离大豆乳状液制备
参考Li Yang等[9]的方法,并适当的修改。称取一定量的挤压膨化大豆粉,加入质量百分数1%、2% Protex6L酶制剂,按照料液比1∶6(g/mL)加入水,玻璃棒搅拌均匀后放于55 ℃水浴锅中,用1 mol/L NaOH溶液调节pH值保持在9.0,边搅拌边酶解,酶解1、2、3 h后,取出并用2 mol/L HCl溶液调节水溶液pH值至7,之后在100 ℃沸水中灭酶5 min。将酶解完后的溶液在6 000 r/min、15 min条件下离心操作,离心完后收集乳状液。
1.3.2 SPI及其酶解物的制备
参考Petruccelli等[10]的方法。大豆经去皮、粉碎过60 目筛,然后用正己烷以1∶6的比例混合脱脂3 次得到脱脂豆粕,将脱脂豆粕按1∶10的质量比与水混合,用2 mol/L NaOH溶液调节pH值至8.5,45 ℃搅拌2 h后,将其悬浮液在4 ℃条件下10 000×g离心20 min,取上清液再用2 mol/L HCl溶液调节pH值至4.5。静置后在4 ℃条件下6 000×g离心20 min,得蛋白沉淀水洗2 次,最后取沉淀分散于水中并用2 mol/L NaOH溶液调节pH值至7.0。再在4 ℃条件下10 000×g离心30 min,除去少量的不溶物,将此蛋白溶液冷冻干燥后研磨即得粉末状SPI。将得到的SPI在与制备乳状液相同的条件下加入1%、2%的酶制剂酶解1、2、3 h得到酶解物。
1.3.3 乳状液中蛋白水解度的测定
参考Nielsen等[11]的方法略作修改,采用0.05 mol/L pH 7.0的磷酸盐缓冲稀释乳状液蛋白质质量浓度为15 mg/mL,取10 μL稀释后的乳状液,加入含有1.5 mL邻苯二甲醛试剂的石英管中,混合3 s,避光反应2 min,340 nm波长处测定吸光度。实验重复3 次取平均值,水解度计算公式如下:

式中:DH为水解度/%;h为水解的肽键数;htot为总肽键数。
1.3.4 乳状液Zeta电位的测定
采用Zetasizer Nanozs 90电位仪测定样品的Zeta电位,采用0.05 mol/L pH 7.0的磷酸盐缓冲稀释样品中蛋白质质量浓度为2 mg/mL,上样体积为1 mL,测定温度为25 ℃,温度平衡时间为2 min[12]。计算3 次重复得到的平均值为测定值。
1.3.5 乳状液光学显微镜观察
取1 滴新鲜乳状液样品置于显微镜载物台上,用载玻片固定,100 倍光学显微镜观察。用CCD照相机获取照片,照片从连接到电脑的数字图像处理软件获得。
1.3.6 荧光光谱分析
采用F-4500荧光分光光度计测定乳状液及对应SPI酶解物的内源性荧光光谱(色氨酸荧光光谱)。将待测样品用0.01 mol/L磷酸缓冲液(pH 7.0)配制成质量浓度为0.15 mg/mL的溶液。荧光发散光谱分析:以蛋白质分子内部的色氨酸荧光基团为探针,荧光光谱激发波长为290 nm,发散光谱扫描范围为300~500 nm,激发狭缝和发射狭缝宽均为5 nm,重复扫描3 次。
1.3.7 SDS-PAGE测定
乳状液的处理方法参照Chabrand等[13]方法,向乳状液中按照1∶6体积比加入正己烷,混合后在-20 ℃静止2 h,静止后4 ℃、12 000×g离心15 min,洗脱后的乳状液放在空气中待正己烷蒸发。该过程重复3 次。将处理后的乳状液稀释8 倍,参考Campbell等[14]PAGE的测定方法,分离胶质量浓度12 g/100 mL,浓缩胶质量浓度5 g/100 mL,上样质量浓度1 mg/mL,与上样缓冲液在95 ℃加热5 min后上样量为10 μL。电泳过程恒压先设定为80 V,跑至分离胶时为120 V,结束后先染色再脱色。
1.4 数据统计
每个实验均重复3 次,采用ANOVA进行误差分析,并用Origin 7.5和Excel统计分析数据并作图,P小于0.05为显著性差异。
2 结果与分析
2.1 乳状液中蛋白质水解度分析

表1 不同酶解条件下乳状液水解度Table1 Effect of enzyme concentration on degree of hydrolysis of proteins in emulsion
水解度是衡量蛋白质水解程度的指标,指蛋白质分子中由于水解而断裂的肽键占蛋白质分子中总肽键的比例[15]。水解可以改变蛋白质的一些功能性质从而影响乳状液的稳定性。由表1可知,乳状液中蛋白水解度在7%左右,这与豆康宁等[16]测得的大豆蛋白水解度结果差别较大,原因可能是乳状液混合体系黏度较大,降低了底物与酶结合的机率,同时乳状液非蛋白成分含量较高,阻止了蛋白与酶的结合效率[17]。由表1可以发现,两个酶添加量条件下前30 min蛋白质水解度显著升高,这时经酶处理降解后的短肽由于肽键的暴露更易为酶作用,反应体系中含有较少的短肽和较多大分子蛋白质,而这部分蛋白质依然有一定的乳化能力,因此如图1a、b所示的乳状液表现较为稳定。水解度在60 min以后增加趋缓,这种现象符合酶解过程的一般规律,随着时间延长,酶解反应速率逐渐变小,这时乳状液中蛋白质经水解后分子质量显著变小,某些极小的多肽分子不足以提供双亲集团,降低了界面吸附蛋白的活性导致油脂与蛋白之间的亲和力降低,被蛋白包裹的乳滴出现聚集[8]如图1e、f所示。

图1 不同酶解条件得到乳状液显微结构图片Fig.1 Microscopic picture of emulsions under different hydrolysis conditions
2.2 乳状液显微结构观察结果
乳状液微观结构的观察是最为直观表征乳状液稳定性的方法。由图1可知,图1a、b乳滴数量多而小分布密集,乳状液的稳定性较好,图1e、f乳滴粒径较大且分布不均匀,出现了不规则乳滴聚集。这是由于乳状液是一个动态体系,在生物解离过程中乳状液中的乳滴在频繁地相互碰撞,解离时间越长,界面膜更易破裂造成液滴聚并;另外,在一定范围内随着酶解时间的延长和酶添加量的增加,乳状液中水解度逐渐增加,使暴露的疏水基团重新通过疏水相互作用在蛋白结构内部形成更大的聚集体导致乳状液中蛋白质残基上疏水位点较少[18]。康立宁等[19]研究指出脂质与蛋白结合的多少,取决于蛋白质残基上疏水位点的多少,因此推测随着酶解的进行,吸附在乳状液界面上的蛋白质酶解为分子质量较小的肽段,其不足以提供双亲基团[20],减弱了这时界面与油脂的亲和力,导致出现乳滴聚集现象。
2.3 Zeta电位分析

图2 酶解条件对乳状液体系Zeta电位的影响Fig.2 Effect of different hydrolysis conditions on zeta potential of emulsion system
界面电势(Zeta电位)可以对乳滴聚结造成动力学障碍,使乳状液具有较好的稳定性[21]。Sorensend等[22]发现“水包油”(O/W)类型乳状液表面带有负电荷,且Zeta电位的绝对值较高,乳状液液滴表面的同种电荷含量较高,彼此间的静电斥力保证乳状液在贮存期间发生液滴扰动,由此稳定性较强;侯俊杰等[23]同样发现Zeta电位较高的体系,油滴间相互排斥力较大,不易发生聚沉,处于相对稳定状态而电位较低的体系,油滴间相互排斥力较小,容易发生聚沉。图2为pH值为7条件下,不同酶解处理得到乳状液的Zeta电位值,由图2可知,本实验生物解离得到的O/W型乳状液样品Zeta电位均表现为负值,与Sorensend等[22]研究相符。酶添加量一定的条件下,酶解时间越长Zeta电位绝对值越小,这主要由于随着酶解时间延长,包裹在油滴表面的蛋白膜被酶解成低分子质量肽段从油滴表面脱落,减少乳状液界面膜的电荷密度,降低了乳滴之间排斥力,导致乳滴的聚集。同时,陈林等[24]研究界面吸附蛋白电荷的静电斥力会影响油滴表面分子间的相互作用,而乳状液的稳定性与界面吸附蛋白有密切关系,因此推测乳状液的稳定性有可能与表面分子间的相互作用有关。
2.4 SDS-PAGE测定结果
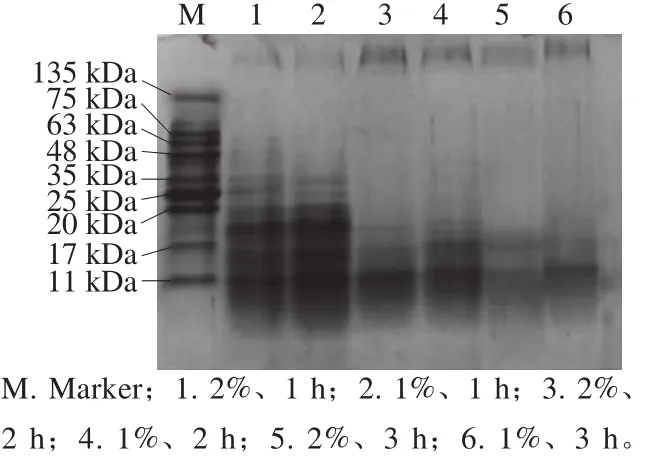
图3 不同酶解条件下乳状液的SDS-PAGE谱图Fig.3 SDS-PAGE prof i les of emulsions under different hydrolysis conditions
SDS-PAGE图显示出乳状液中大豆蛋白各亚基的条带。由图3可知,随着酶解时间延长,乳状液中蛋白亚基的条带越来越浅,说明蛋白被酶解成分子质量较小的肽段,尤其酶解2、3 h时乳状液中肽段的分子质量小于20 kDa,这些结果与De Moura Bell等[5]研究结果一致。由于分子质量较小的肽段缺乏大豆蛋白完整的二级、三级结构,不足以提供空间阻碍和稳定界面膜的作用,导致乳状液的聚结,这与显微观察的结果一致。此外,从图3观察到各条带上方出现了大分子质量的蛋白,推测这些蛋白聚集体可能是由二硫键引起的。参与蛋白聚集的小分子质量肽段多埋藏于蛋白内部的疏水区域,他们通过二硫键的疏水相互作用引起蛋白交联聚集[6],这与上述显微观察解释结果一致,乳状液中蛋白聚集体的形成使乳状液中蛋白质残基上疏水位点较少,导致脂质与蛋白结合的程度降低,乳滴出现聚集[19]。
2.5 荧光光谱分析
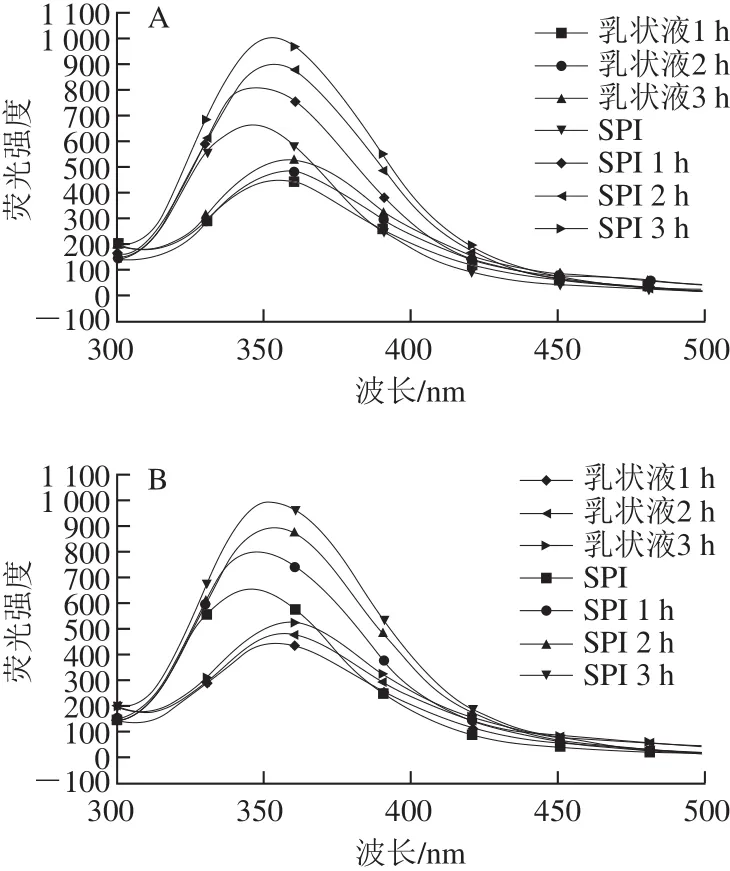
图4 酶添加量1%(A)和2%(B)条件下获得的乳状液及对应酶解时间下SPI的荧光光谱分析Fig.4 Fluorescence spectral analysis of emulsions obtained at 1% (A)and 2% (B) enzyme dosages and SPI at corresponding hydrolysis times
荧光光谱是通过检测蛋白质的内源性荧光,可有效测试蛋白质微环境体系的变化,在大豆蛋白中,两种芳香族氨基酸(酪氨酸和色氨酸)会表现出荧光性,尤其色氨酸对微观环境的变化很敏感,因此可利用内源荧光来测定蛋白质中色氨酸周围环境的极性状况[25]。因此本实验中乳状液及对应的SPI的荧光为色氨酸残基的荧光峰。如图4所示,分别为使用内源荧光扫描测定酶添加量1%、2%得到的乳状液及对应酶解时间下SPI的荧光光谱及最大吸收波长图谱。可以看出不同酶添加量下色氨酸残基的荧光强度及最大吸收波长没有太明显的变化。从图4A可知,SPI随着酶解时间延长,λmax发生红移,荧光强度逐渐增强,这是酶解处理使蛋白球形结构变得松散伸展,深埋在球状结构内部的色氨酸残基暴露导致[26]。另外发现,相对于对应酶解时间下SPI,乳状液中蛋白色氨酸残基荧光强度明显减弱,在乳液中色氨酸残基可能与疏水性油相接触,导致色氨酸残基的微环境发生变化,也暗示着乳状液中蛋白质分子构象发生改变[27]。有学者研究磷脂对大豆蛋白具有荧光猝灭作用[28];同时,Rampon等[29]研究表明乳液中蛋白-油脂之间相互作用及蛋白聚集体可减少荧光强度,蛋白与油脂相互作用通过屏蔽分子内部的疏水性基团,掩盖发色团导致蛋白荧光减弱。因此推测本实验中乳状液荧光减弱现象是由于磷脂的存在、蛋白质-油脂之间的相互作用及蛋白聚集体导致。另外,相对于SPI,乳状液中蛋白λmax发生了轻微的红移现象,这很有可能是亲水性较强的磷脂存在使乳状液中蛋白所处的微环境发生变化导致[30]。
3 结 论
本实验在前人对生物解离提油工艺参数研究基础上,选用不同酶解时间(1、2、3 h)、酶添加量(1%、2%)条件下得到的生物解离大豆乳状液体系,从宏观到微观逐步探究了乳状液的结构特征及分子间相互作用,得到主要结论如下:1)本实验得出生物解离乳状液中蛋白水解度在7%左右;随着酶解的进行,吸附在乳状液界面上的蛋白质被酶解为分子质量较小的肽段,降低了界面吸附蛋白的活性导致油脂与蛋白之间的亲和力降低,被蛋白包裹的油脂滴出现絮凝;另外随着乳状液中水解度逐渐增加,暴露的疏水基团通过疏水相互作用重新形成更大的聚集体导致乳液中蛋白质残基上疏水位点较少,影响了乳液中油脂与蛋白结合,也促使乳滴出现聚集;同时由于分子质量较小的肽从油滴表面脱落,导致界面膜的电荷密度减少,Zeta电位绝对值减小。2)SDS-PAGE观察到条带上方出现了大分子质量的蛋白,这些蛋白聚集体可能是由二硫键引起的,二硫键引起的蛋白聚集体验证了荧光分析中乳状液中色氨酸的荧光强度减弱现象。同时乳液中蛋白聚集体的形成使乳液中蛋白质残基上疏水位点较少,导致脂质与蛋白结合的程度降低,乳滴出现聚集这也与上述显微观察解释结果一致。3)荧光光谱结果发现:SPI随着酶解时间延长,λmax发生红移,荧光强度逐渐增强;相对于对应酶解时间下SPI,乳状液中蛋白色氨酸残基荧光强度明显减弱,推测出现此现象是磷脂的存在、蛋白-油脂之间的相互作用及蛋白质聚集体导致。
本实验从分子间相互作用方面探讨了生物解离大豆乳状液结构特征,尤其是油脂与蛋白亲和力、蛋白与蛋白之间形成的聚集体等分子间相互作用对乳状液结构及稳定性的影响。乳状液中磷脂、多糖等小分子间相互作用对乳状液稳定性影响机制尚未清楚。由于乳状液中这些小分子含量较少直接分析较为困难,因此从合成乳状液方面探讨乳状液中磷脂、多糖等小分子间相互作用对乳状液稳定性影响机制有待下一步研究。
[1] YUSOFF M M, GORDON M H, NIRANJAN K. Aqueous enzyme assisted oil extraction from oilseeds andemulsion de-emulsifying methods: a review[J]. Trends in Food Science & Technology, 2015,41(1): 60-82. DOI:10.1016/j.tifs.2014.09.003.
[2] JMLN D M, CAMPBELL K, DE ALMEIDA N M, et al. Protein extraction and membrane recovery in enzyme-assisted aqueous extraction processing of soybeans[J]. Journal of the American Oil Chemists’ Society,2011, 88(6): 877-889. DOI:10.1007/s11746-010-1737-0.
[3] 江连洲. 大豆生物解离制取油脂技术研究进展[J]. 食品科学技术学报, 2016, 34(3): 1-7. DOI:10.3969/j.issn.2095-6002.2016.03.001.
[4] YI J P. Optimization of ultrasonic-assisted extraction of oil from Paeonia suffruticosa Andr. seeds and its GC-MS analysis[J]. Science and Technology of Food Industry, 2009, 30(8): 198-201.
[5] DE MOURA BELL J M L N, MAURER D, YAO L, et al.Characteristics of oil and skim in enzyme-assisted aqueous extraction of soybeans[J]. Journal of the American Oil Chemists’ Society, 2013,90(7): 1079-1088. DOI:10.1007/s11746-013-2248-6.
[6] LI P F, GASMALLA M A A, LIU J J, et al. Characterization and demusification of cream emulsion from aqueous extraction of peanut[J]. Journal of Food Engineering, 2016, 185: 62-71.DOI:10.1016/j.jfoodeng.2016.04.003.
[7] 郑力军, 杨海恩, 黎晓茸. 双子表面活性剂与原油组分相互作用研究[J]. 科学技术与工程, 2013, 13(26): 7812-7815.
[8] LI J J, PINNAMANENI S, QUAN Y, et al. Mechanistic understanding of protein-silicone oil interactions[J]. Pharmaceutical Research, 2012,29(6): 1689-1697. DOI:10.1007/s11095-012-0696-6.
[9] LI Y, SUI X N, QI B K, et al. Optimization of ethanol-ultrasoundassisted destabilization of a cream recovered from enzymatic extraction of soybean oil[J]. Journal of the American Oil Chemists’Society, 2014, 91(1): 159-168. DOI:10.1007/s11746-013-2352-7.
[10] PETRUCCELLI S, ANON M C. Relationship between the method of obtention and the structural and functional properties of soyproteins isolates. 1. Structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2161-2169.
[11] ADLER-NISSEN J. Enzymic hydrolysis of food proteins[M]. London and New York: Elsevier Applied Science Publishers, 1986: 427.
[12] 袁德保. 大豆蛋白热聚集行为及其机理研究[D]. 广州: 华南理工大学, 2010: 25-26.
[13] CHABRAND R M, GLATZ C E. Destabilization of the emulsion formed during the enzyme-assisted aqueous extraction of oil from soybean fl our[J]. Enzyme & Microbial Technology, 2009, 45(1): 28-35. DOI:10.1016/j.enzmictec.2009.03.008.
[14] CAMPBELL K A, GLATZ C E. Mechanisms of aqueous extraction of soybean oil[J]. Journal of Agricultural and Food Chemistry, 2009,57(22): 10904-10912. DOI:10.1021/jf902298a.
[15] CALDERÓN DE LA BARCA A M, RUIZ-SALAZAR R A, JARAMARINI M E. Enzymatic hydrolysis and synthesis of soy protein to improve its amino acid composition and functional properties[J].Journal of Food Science, 2010, 65(2): 246-253. DOI:10.1111/j.1365-2621.2000.tb15988.x.
[16] 豆康宁, 石晓, 王飞. 大豆蛋白水解度与大豆肽抗氧化力关系研究[J].中国油脂, 2013, 38(10): 20-22.
[17] DE MOURA BELL J M L N, CAMPBELL K, MAHFUZ A, et al.Enzyme-assisted aqueous extraction of oil and protein from soybeans and cream de-emulsif i cation[J]. Journal of the American Oil Chemists’Society, 2008, 85(10): 985-995. DOI:10.1007/s11746-008-1282-2.
[18] DAY L, ZHAI J L, XU M, et al. Conformational changes of globular protein adsorbed at oil-in-water emulsion interfaces examined by synchrotron radiation circular dichroism[J]. Food Hydrocollodis, 2014,34(1): 78-87. DOI:10.1016/j.foodhyd.2012.12.015.
[19] 康立宁, 刘香英, 田志刚, 等. 大豆蛋白挤压组织化过程中生物大分子之间的相互作用[J]. 大豆科技, 2009(5): 54-57.
[20] MCCLEMENTS D J. Critical review of techniques and methodologies for characterization of emulsion stability[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(7): 611-649.DOI:10.1080/10408390701289292.
[21] 方洪波. 聚合物驱采出液破乳机理研究[D]. 东营: 东营胜利油田博士后科研工作站, 2004.
[22] SORENSEN A M, BARON C P, LET M B, et al. Homogenization conditions affect the oxidative stability of fish oil enriched milk emulsions: oxidation linked to changes inprotein composition at the oil-water interface[J]. Journal of Agricultural and Food Chemistry,2007, 55(5): 1781-1789. DOI:10.1021/jf0623900.
[23] 侯俊杰, 严江殷, 杨晓泉. 谷氨酰胺内肽酶限制性水解对大豆伴球蛋白乳化性的影响[J]. 现代食品科技, 2015(4): 51-57.DOI:10.13982/j.mfst.1673-9078.2015.4.009.
[24] 陈林, 吴克刚, 柴向华, 等. 微射流均质预处理提高大豆分离蛋白酶解效率及酶解产物乳化性能[J]. 农业工程学报, 2015, 31(5): 331-338.
[25] 王瑞, 李杨, 王中江, 等. 体外模拟消化过程中大豆蛋白的荧光光谱分析及热处理的影响[J]. 食品工业科技, 2016, 37(6): 128-132.
[26] PALLARÈS I, VENDRELL J, AVILÉS F X, et al. Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331.DOI:10.1016/j.jmb.2004.06.089.
[27] RAMPON V, GENOT C, RIAUBLANC A, et al. Front-face fluorescence spectroscopy study of globular proteins in emulsions:displacement of BSA by a nonionic surfactant[J]. Journal of Agricultural & Food Chemistry, 2003, 51(9): 2482-2489.DOI:10.1021/jf026168g.
[28] ZHANG H X, HUANG X, MEI P, et al. Studies ori the interaction of tricyclazole with β-cycloclextrin and human serum albumin by spectroscopy[J]. Journal of Fluorescence, 2006, 16(3): 287-294.
[29] RAMPON V, LETHUAUT L, MOUHOUS-RIOU N, et al. Interface characterization and aging of bovine serum albumin stabilized oilin-water emulsions as revealed by front-surface fluorescence[J].Journal of Agricultural and Food Chemistry, 2001, 49(8): 4046-4051.DOI:10.1021/jf001170y.
[30] 李秋慧, 隋晓楠, 王中江, 等. 酰基转移现象对大豆蛋白-磷脂酶解物相互作用及乳化特性的影响[J]. 食品科学, 2017, 38(1): 1-6.DOI:10.7506/spkx1002-6630-201701001.

