水溶性辅酶Q10对鱼藤酮致PC12细胞凋亡的保护作用及其机制
江毓敏,李海宁,林邵青,陈燕燕,安 静,马春换,宦楠楠,成 江
(1. 宁夏医科大学临床医学院,宁夏银川 750004;2. 宁夏医科大学总医院神经内科,宁夏银川 750003)
帕金森病(Parkinson’s disease, PD),又名震颤麻痹(paralysis agitans),是一种常见于老年人的神经系统变性疾病,临床上以静止性震颤、运动迟缓、肌强直和姿势平衡障碍为主要特征。遗传与环境的共同作用在PD的发病中起了重要作用,其主要病理改变是黑质多巴胺能神经元变性。尽管其具体发病机制至今尚未明确,但一系列的研究显示,PD的发病主要与细胞凋亡途径被激活、氧化应激及线粒体功能障碍等有关[1-2]。辅酶Q10(Coenzyme Q10, CoQ10)在线粒体呼吸链中作为移动电子转运和辅助因子的解偶联蛋白,是人体内强大的抗氧化剂,能够防止自由基的氧化损伤,包括线粒体膜内脂质的氧化。有学者认为PD的发生可能与CoQ10的减少有关[3-4]。但传统的CoQ10为脂溶性,生物利用度较低,难以被人体吸收利用,新近研发出的水溶性CoQ10细胞摄取度和线粒体摄取度分别是传统CoQ10的60倍和20倍[5]。鱼藤酮(rotenone, Rot)是生活中常见的杀虫剂,其作用方式与亲帕金森毒素1-甲基-4-苯基吡啶(MPP+)相同,可特异性抑制细胞呼吸链的NADH脱氢酶(线粒体复合物I,complex I)[6]。大鼠肾上腺嗜铬细胞瘤细胞(pheochromocytoma cell, PC12)株的性质及细胞内含有的酶类、合成的递质等都与中脑多巴胺神经元相似[7-8],因此,本课题组以PC12细胞作为多巴胺能神经元的细胞模型,研究水溶性CoQ10对神经元凋亡的抑制作用,为临床应用提供实验依据。
1 材料与方法
1.1主要试剂DMEM高糖培养基、胎牛血清(fetal bovine serum)、PBS磷酸盐缓冲液购于Hyclone公司;青链霉素、胰蛋白酶(trypsin)购于索莱宝公司;Rot、高纯度(>98%)CoQ10、聚氧乙基-α-生育酚癸二酸酯(polyoxyethanyl-α-tocopheryl sebacate, PTS)购于Sigma公司;活性氧(reactive oxygen species, ROS)检测试剂盒购于南京建成生物工程研究所;凋亡诱导因子(anti-apoptosis-inducing factor antibody, anti-AIF antibody)、anti-active Caspase3 antibody、anti-Caspase9 antibody、anti-beta actin antibody(anti-β-actin antibody)、Anti-Lamin B1 antibody、Goat Anti-rabbit antibody购于美国Abcam公司;浆蛋白核蛋白提取试剂盒购于凯基生物技术有限公司。
1.2细胞株大鼠肾上腺嗜铬细胞瘤PC12细胞(已经由神经生长因子诱导分化),购于上海生命科学院。
1.3主要仪器二氧化碳(CO2)培养箱(美国Forma Scientific公司);普通倒置显微镜(Olympus CKX41,日本Olympus公司);带摄像功能荧光显微镜(Nikon eclipse,日本Nikon公司);荧光分光光度计(Olympus,日本Olympus公司);流式细胞仪(日本Olympus公司);多波长酶标仪(美国Thermo公司)。
1.4方法
1.4.1试剂准备 将Rot溶解于DMSO中,制成储存液,备用;将PTS与CoQ10按照2∶1摩尔比例在50 ℃下混匀,制成水溶性CoQ10[9]。
1.4.2细胞培养 将PC12细胞置于含100 mL/L胎牛血清、1%青链霉素的DMEM高糖培养基,50 mL/L CO2、37 ℃饱和湿度的培养箱中孵育,24 h换液,待细胞融合至80%左右时用于以下实验。
1.4.3Rot建立PD模型 将对数生长期细胞接种到96孔板,于37 ℃孵育箱过夜,用不同浓度Rot(0.25、0.5、1.0、2.0 μmol/L)作用24 h,同时设置空白对照(control)组、溶剂对照(vehicle)组(1 mL/L DMSO),使用CCK8检测细胞存活率,并在倒置显微镜下观察细胞形态,选择细胞存活率50%左右的Rot浓度建立PD模型,进行以下实验。
1.4.4水溶性CoQ10对正常细胞以及PD模型细胞存活率的影响 将对数生长期细胞接种到96孔板,于37 ℃孵育箱过夜,用不同浓度水溶性CoQ10(25、50、100 μmol/L)对细胞预处理3 h后加入鱼藤酮处理24 h,CCK8检测细胞存活率,并在倒置显微镜下观察细胞形态。
1.4.5实验分组 将细胞分为vehicle组(加入1 mL/L的DMSO)、Rot组(1 μmol/L Rot)、CoQ10组(50 μmol/L CoQ10)、CoQ10治疗组(1 μmol/L Rot+50 μmol/L CoQ10)。
1.4.6细胞内ROS检测 使用南京建成ROS检测试剂盒进行检测。收集vehicle组、Rot组、CoQ10组、CoQ10治疗组和阳性对照组(Rosup,50 mg/L,试剂盒提供)的细胞各1×106个,重悬于含10 μmol/L 2′,7′-二氢二氯荧光黄双乙酸钠(DCFH-DA)的PBS中,CO2孵箱内孵育30 min,PBS洗涤3次,用PBS重悬细胞,调整细胞密度,使各组细胞浓度一致。阳性对照组按照试剂盒要求,使用终质量浓度50 mg/L的Rosup,作用时间30 min,荧光分光光度计检测荧光强度,激发光波长为488 nm,发射波长为525 nm,以各处理组/对照组的比值作为ROS的数值。
1.4.7Western blot检测CoQ10对凋亡信号蛋白AIF、Bcl-2、Bax、Caspase-9及active Caspase-3表达的影响 收集处理好的细胞,按照试剂盒要求提取浆蛋白与核蛋白(凯基核蛋白浆蛋白提取试剂盒),Bradford法测定蛋白含量,SDS-PAGE电泳分离并将蛋白转移到PVDF膜,TBST洗膜3次,每次10 min,50 g/L 脱脂奶粉室温封闭1 h。以LaminB1作为AIF的内参,β-actin作为Bcl-2、Bax、Caspase-9、active Casepase-3的内参,4 ℃孵育(AIF、Bcl-2、Bax、Caspase-9、active Casepase-3、β-actin及LaminB1的稀释浓度均为1∶2 000)过夜,TBST洗膜3次,每次10 min,二抗(均使用Goat Anti-rabbit antibody)室温孵育2 h,显影,凝胶成像仪照相并分析蛋白条带灰度值。

2 结 果
2.1不同浓度Rot对PC12细胞存活率的影响本实验采用梯度浓度Rot处理细胞24 h,细胞存活率如图1。单因素方差分析显示,不同浓度Rot细胞存活率具有统计学差异(P<0.01),且细胞存活率与Rot浓度呈负相关,Rot浓度越高,细胞存活率越低。倒置显微镜下观察细胞形态,正常对照组和溶剂对照组细胞突起明显、呈梭形,给予不同浓度的Rot处理后,细胞大部分胞体皱缩,突起缩短甚至消失,细胞呈类似圆形,且数量减少。在Rot浓度为1 μmol/L时,细胞存活率约为50%,后续实验将采用1 μmol/L的Rot建立细胞模型。control组与vehicle组差异无统计学意义(P>0.05),可忽略DMSO对细胞的影响。

图1 不同浓度Rot对PC12细胞存活率的影响Fig.1 Effects of Rot of different concentration on survival rate of PC12 cells
2.2水溶性CoQ10对Rot致PC12细胞形态及存活率的影响选用25、50、100 μmol/L CoQ10对模型组PC12细胞进行治疗,结果显示,与Rot组比,50、100 μmol/L CoQ10均可提高Rot组细胞存活率(P<0.05),但是50 μmol/L与100 μmol/L的CoQ10对PC12细胞存活率改变无明显差异(图2)。因此,后续实验将选择50 μmol/L CoQ10作为治疗浓度。
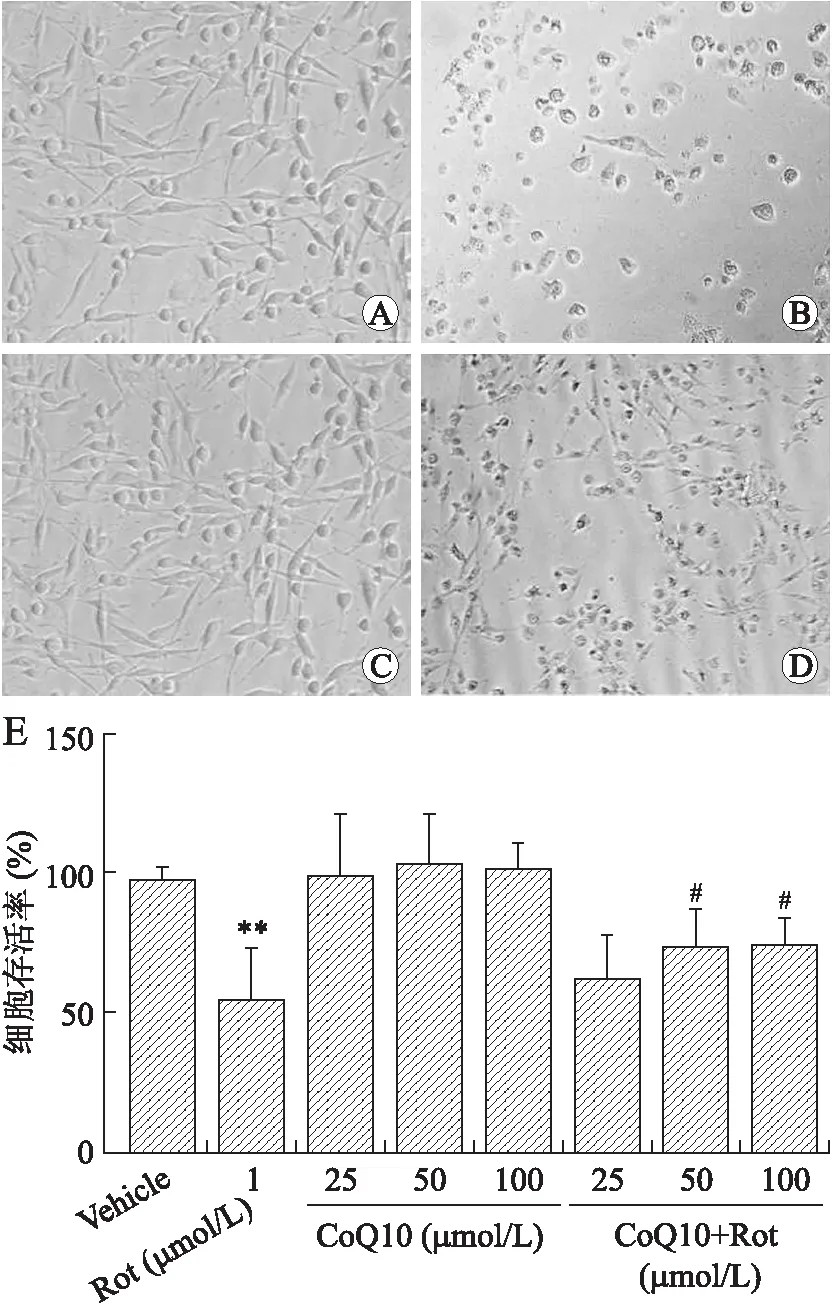
图2 CoQ10对Rot致PC12细胞形态及存活率的影响Fig.2 Effects of CoQ10 on morphology and survival rate of PC12 cells
2.3细胞内ROS水平检测如图3所示,模型组Rot处理细胞24 h后荧光强度明显增强,提示细胞内ROS水平升高;治疗组CoQ10预处理3 h后荧光强度减弱,提示细胞内ROS水平降低(P<0.01),CoQ10组荧光强度与vehicle组相比稍有降低,但差异无统计学意义(P>0.05)。
2.4水溶性CoQ10对凋亡诱导蛋白AIF及凋亡信号蛋白Bcl-2、Bax、Caspase-9、active-Caspase-3表达的影响Rot处理24 h,PC12细胞核内AIF表达升高显著,凋亡信号蛋白的表达也发生明显改变,主要表现为Bcl-2表达降低(P<0.01),Bax、Caspase-9表达增多(P<0.01),active-Caspase-3表达也显著增多(P<0.05)。水溶性CoQ10可逆转上述凋亡信号蛋白的表达(图4)。
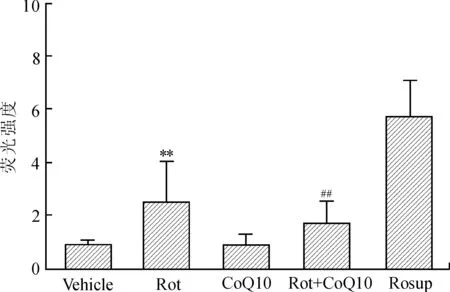
图3 细胞内活性氧水平的测定Fig.3 Determination of active oxygen level in cells
3 讨 论
PD的发病机制目前仍存在争议,线粒体功能障碍、氧化应激及细胞凋亡都是引起PD的重要原因[10-11]。线粒体是细胞内能量产生的重要细胞器,在能量代谢及细胞凋亡的调控中发挥关键作用,其能量的产生依赖于由5个酶复合体(复合体Ⅰ~Ⅴ)组成的线粒体呼吸链的电子传递,线粒体呼吸链不仅能够产生能量,还是体内自由基产生的主要场所,其任何部位受到损伤都会导致自由基生成增多。复合体Ⅰ(NADH-CoQ还原酶)是最大的一个,也是最易受损伤的一个。CoQ10是复合体Ⅰ的重要组成部分,是Ⅰ/Ⅱ的电子受体,同时还是重要的天然抗氧化剂,能够清除自由基,促进线粒体生成ATP。Rot作为生活中常见的杀虫剂,是线粒体复合体Ⅰ的选择性抑制剂,可抑制线粒体呼吸链生成ATP,从而导致氧化应激。氧化应激是黑质多巴胺能神经元选择性损伤的重要因素,它能启动环境因素诱发PD,同时可在细胞其他因素参与下得以不断加强。本研究观察到PC12细胞经过Rot处理24 h后细胞内ROS含量显著增多,给予CoQ10治疗后细胞内ROS水平降低,提示CoQ10可以降低Rot诱导的ROS水平升高,表明CoQ10可通过清除胞质中过多的氧自由基发挥神经保护作用。

图4 CoQ10对AIF、Bcl-2、Bax、Caspase-9及active Caspase-3表达的影响Fig.4 Effects of CoQ10 on AIF,Bcl-2,Bax,Caspase-9 and active Caspase-3 expressions
本研究发现,Rot对PC12细胞具有明显的细胞毒性,随着Rot浓度升高,细胞损伤越明显,突触明显缩短甚至消失,细胞存活率也降低,CoQ10可以改善Rot导致的PC12细胞损伤和凋亡。PD是病理性细胞凋亡所导致的一系列病理过程,内源性及外源性途径均能诱发细胞凋亡,现在发现至少有3条通路参与细胞调亡的发生,即线粒体通路、死亡受体通路和内质网通路,其中以线粒体通路最为经典[12-13]。位于线粒体膜上的Bcl-2蛋白家族在调节细胞凋亡中发挥至关重要的作用,Bcl-2蛋白家族分为抗凋亡蛋白和促凋亡蛋白,前者包括Bcl-2、Bcl-xl等,后者包括Bax、Bad等。有研究表明,Bcl-2可通过抵抗细胞内ROS的毒性阻止神经细胞凋亡[14]。Bcl-2/Bax表达比率的升高可使细胞免于凋亡。Caspase-3是细胞凋亡的执行蛋白,包括无活性的前体procaspase-3和活化的active Caspase-3,在正常细胞中含量很低。生理状态下,AIF存在于线粒体内外膜之间,是线粒体氧化还原酶,当受到凋亡刺激后,将会在通过核定位序列转移到细胞核内,引起染色体的凝集和DNA的损伤,启动不依赖于Caspase的细胞凋亡[15-16]。本实验发现,Rot处理后的PC12细胞Bcl-2/Bax的表达比率下调,原本低表达的active Caspase-3也大量表达。CoQ10可使Bcl-2/Bax的表达比率升高,即上调Bcl-2,下调Bax,同时降低active Caspase-3的表达。
综上所述,水溶性CoQ10对Rot致PC12细胞凋亡具有保护作用,其机制可能是通过清除细胞内氧自由基改善细胞氧化应激状态,以及上调Bcl-2、下调Bax,同时降低active Caspase-3及Caspase-9的表达来实现的。
参考文献:
[1] SUBEDI L, KWON OW, PAK C, et al. N,N-disubstituted azines attenuate LPS-mediated neuroinflammation in microglia and neuronal apoptosis via inhibiting MAPK signaling pathways[J]. BMC Neurosci, 2017, 18(1):82.
[2] ARAWAKA S, FUKUSHIMA S, SATO H, et al. Zonisamide attenuates α-synuclein neurotoxicity by an aggregation-independent mechanism in a rat model of familial Parkinson's disease[J]. PLoS One, 2014, 9(2):e89076.
[3] BERGAMINI C, MORUZZI N, SBLENDIDO A, et al. A water soluble CoQ10 formulation improves intracellular distribution and promotes mitochondrial respiration in cultured cells[J]. PLoS One,2012;7(3):e33712.
[4] STORCH A, JOST WH, VIEREGGE P, et al. Randomized, double-blind, placebo-controlled trial on symptomatic effects of coenzyme Q(10) in Parkinson disease[J]. Arch Neurol, 2007, 64(7):938-944.
[5] MA D, STOKES K, MAHNGAR K, et al. Inhibition of stress induced premature senescence in presenilin-1 mutated cells with water soluble Coenzyme Q10[J]. Mitochondrion, 2014, 17:106-115.
[6] SANDERS LH, GREENAMYRE JT. Oxidative damage to macromolecules in human Parkinson disease and the rotenone model[J]. Free Radic Biol Med, 2013, 9(62):111-120.
[7] VOSHAVAR C, SHAH M, XU L, et al. Assessment of protective role of multifunctional dopamine agonist D-512 against oxidative stress produced by depletion of glutathione in PC12 cells: Implication in neuroprotective therapy for Parkinson's disease[J]. Neurotox Res, 2015, 8(4):302-318.
[8] ZHAO XE, ZHU S, YANG H, et al. Simultaneous determination of amino acid and monoamine neurotransmitters in PC12 cells and rats models of Parkinson's disease using a sensitizing derivatization reagent by UHPLC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 995(996):15-23.
[9] SIKORSKA M, BOROWY-BOROWSKI H, ZURAKOWSKI B, et al. Derivatised alpha-tocopherol as a CoQ10 carrier in a novel water-soluble formulation[J]. Biofactors, 2003, 18(1-4):173-83.
[10] BUCHMAN AS, WILSON RS, SHULMAN JM, et,al. Parkinsonism in older adults and its association with adverse health outcomes and neuropathology[J]. J Gerontol A Biol Sci Med Sci, 2016, 71(4):549-556.
[11] VERMA AK, RAJ J, SHARMA V, et, al. Plasma prolidase activity and oxidative stress in patients with Parkinson’s disease[J]. Parkinsons Dis, 2015, (2015):598028.
[12] SHI WY, CAO C, LIU L. Interferon α induces the apoptosis of cervical cancer HeLa cells by activating both the intrinsic mitochondrial pathway and endoplasmic reticulum stress-induced pathway[J]. Int J Mol Sci, 2016, 17(11):e1832.
[13] KIM SM, PARK YJ, SHIN MS, et al. Acacetin inhibits neuronal cell death induced by 6-hydroxydopamine in cellular Parkinson's disease model[J]. Bioorg Med Chem Lett, 2017, 27(23):5207-5212.
[14] MEI JM, NIU CS. Effects of CDNF on 6-OHDA-induced apoptosis in PC12 cells via modulation of Bcl-2/Bax and Caspase-3 activation[J]. Neurol Sci, 2014, 35(8):1275-1280.
[15] YANG R, CUI HJ, WANG H, et al. N-stearoyltyrosine protects against glutamate-induced oxidative toxicity by an apoptosis-inducing factor (AIF)-mediated Caspase-independent cell death pathway[J]. J Pharmacol Sci, 2014, 124(2):169-179.
[16] LI H, CHEN G, MA W, et al. Water-soluble coenzyme q10 inhibits nuclear translocation of apoptosis inducing factor and cell death caused by mitochondrial complex I inhibition[J]. Int J Mol Sci, 2014, 15(8):13388-13400.

