晚期非小细胞肺癌患者化疗前后淋巴细胞亚群的变化
吴云波,张维强,魏智民,张国庆,刘哲峰,焦顺昌
(1.中国人民解放军总医院肿瘤科,北京 100853;2.中央军事委员会联合参谋部警卫局保健处)
·临床研究·
晚期非小细胞肺癌患者化疗前后淋巴细胞亚群的变化
吴云波1,张维强2,魏智民2,张国庆1,刘哲峰1,焦顺昌1
(1.中国人民解放军总医院肿瘤科,北京 100853;2.中央军事委员会联合参谋部警卫局保健处)
[摘要]目的分析125例晚期非小细胞肺癌(NSCLC)患者2周期一线化疗前后21项淋巴细胞亚群变化情况。方法用三标荧光抗体对125例NSCLC患者接受紫杉+铂类、培美曲塞+铂类或其他方案2周期一线化疗前后外周血21项淋巴细胞亚型进行标记,流式细胞仪检测并分析结果,用SPSS 17.0软件统计分析化疗前后淋巴细胞亚群的变化,并分析不同化疗方案对淋巴细胞亚群的影响是否存在差异。结果晚期NSCLC患者化疗后CD3+、CD3+CD4+、CD3+CD8+、CD4+CD29+、CD3+HLA-DR+、45RO+、CD4+CD45RA+、CD4+CD45RO+、CD28+、CD8+CD28-细胞在外周血淋巴细胞中的百分比例较化疗前明显升高,自然杀伤细胞(CD3-CD16+或56+)、CD19+细胞百分比则明显降低(P<0.05)。亚组分析结果显示接受不同化疗方案化疗后患者CD19+、CD25+、Treg这三种淋巴细胞亚群在外周血中的百分比存差异有统计学意义(P<0.05);紫杉+铂类组CD19+细胞百分比最低,培美+铂类组则最高;培美+铂类组CD25+和Treg细胞的百分比最低,其他化疗方案组则最高;除上述三种淋巴细胞亚群外,其余亚群在外周血中的百分比在不同化疗方案组患者之间差异无统计学意义(P>0.05)。结论2个周期一线化疗使得晚期NSCLC患者体液免疫功能下降,但患者的细胞免疫功能处于增强状态;紫杉+铂类方案对患者的体液免疫功能的减低作用相对明显,而培美曲塞+铂类方案对机体的免疫抑制作用要低于紫杉+铂类方案以及其他化疗方案。
[关键词]癌,非小细胞肺;抗肿瘤联合化疗方案;淋巴细胞亚群;免疫系统现象
既往众多研究表明,CD3+细胞代表总T淋巴细胞,CD3+CD4+细胞代表辅助/诱导性T细胞(Th),CD3+CD8+细胞则代表记忆/效应性T细胞(Tc)。这三种细胞在T淋巴细胞亚群分析中占有非常重要的地位,既往有很多研究通过分析这三种细胞在外周血中的变化来评价患者的免疫功能。但是外周血中这三种细胞表面同样存在很多不同的CD分子,说明它们都不是单一的细胞群,而是由许多特征和功能各异的亚群所组成的[1-3]。随着免疫学研究的发展,更多的淋巴细胞亚群,比如CD45RA、CD45RO、CD28、HLA-DR、Treg(CD4+CD25+)细胞等陆续被研究者发现,这些细胞在机体免疫功能调节方面同样起着非常重要的作用。同时,越来越多的学者也逐渐意识到,仅分析CD3+、CD4+和CD8+T细胞的变化并不能客观、准确和全面地反映机体免疫功能变化情况。因此,本研究对125例晚期NSCLC患者化疗前后外周血21项淋巴细胞亚群的表型进行了检测和分析,以期发现化疗对患者免疫功能的影响。
化疗是包括非小细胞肺癌(NSCLC)在内的诸多恶性实体肿瘤的综合治疗过程中非常重要的一种抗肿瘤治疗方法。化疗药物的细胞毒作用由于缺乏选择性,使得这些药物在杀伤肿瘤细胞的同时,对机体正常的细胞也有杀伤作用。有许多研究报道认为化疗可降低机体免疫功能[4-6],进而削弱机体抗肿瘤免疫应答的产生[7]。但是亦有学者认为化疗可通过调变肿瘤抗原、调整机体免疫格局而增强机体的抗肿瘤免疫功能[8-12]。为明确化疗对机体免疫功能的影响,本研究采用前瞻性队列研究的方式,对125例晚期NSCLC患者化疗前后外周血21项淋巴细胞亚群的表型进行了检测,以此分析晚期NSCLC患者免疫功能变化情况。
1 对象与方法
1.1 研究对象 选取2008年11月至2013年12月中国人民解放军总医院肿瘤科收治的均经组织病理学或细胞学检查诊断明确的125例晚期NSCLC患者。
1.2 纳入与排除标准 纳入标准:(1)疾病分期为ⅢB期或Ⅳ期,既往未行化疗;(2)有影像学可评估病灶,根据实体瘤疗效评估标准(RECIST 1.1),至少有一个单径可测量病灶,其最长径采用螺旋CT测量≥10 mm;对于任何接受过放疗的病灶均不能作为靶病灶;(3)年龄在18~75岁,预期生存时间大于12周;(4)ECOG状态评分为0~2分;(5)器官功能水平必须符合下列要求:中性粒细胞绝对计数(ANC) ≥1.5×109/L,血小板≥100×109/L,血红蛋白≥90 g/L;肝脏:血清胆红素≤1.5倍正常值上限。谷丙转氨酶(ALT)、谷草转氨酶(AST)≤2.5倍正常值上限;肾脏:血清肌酐≤1.5倍正常值上限;肌酐清除率≥50 mL/min;(6)签署知情同意书。
排除标准:(1)有影像学或是脑脊液病检证实的脊髓、脊膜或是脑膜的肿瘤转移(无症状的脑转移除外);(2)任何不稳定系统性疾病(包括活动性感染,控制不佳高血压,不稳定型心绞痛,充血性心力衰竭,肝、肾或代谢性疾病);(3)在5年内患有任何其他恶性肿瘤(完全治愈的宫颈原位癌或基底细胞或鳞状上皮细胞皮肤癌除外)。
研究对象按照NCCN指南中推荐的给药剂量给予多西他赛/紫杉醇+顺铂/卡铂、培美曲塞二钠+顺铂/卡铂和其他方案(包括吉西他滨+顺铂/卡铂、长春瑞滨+顺铂/卡铂、依托泊苷+顺铂/卡铂等)化疗。入组研究对象的年龄为(52.9±11.1)岁,其余临床特征见表1。该研究由中国人民解放军总医院医学伦理委员会批准进行。
1.3 材料 试验所用CD8-FITC/CD4-PE/CD3-PC5标记三色荧光素抗体及其同型阴性对照,CD3-FITC/CD56-PE/CD16-PC5标记三色荧光素抗体及其同型阴性对照,CD8-FITC、CD45RO-FITC、CD28-FITC、CD29-FITC、CD25-PE、CD45RA-PE、HLA-DR-PE、CD8-ECD、CD19-ECD、CD3-PC5、CD4-PC7标记单色荧光素抗体及FITC、PE、ECD、PC5、PC7单色同型阴性对照均购自美国Bechman-Coulter公司。Q-prep自动溶血仪、Cytometer FC 500 MPL 流式细胞仪亦购自美国Bechman-Coulter公司。
1.4 检测样本的制备 所有患者均于第1周期化疗前1天以及第2周期化疗后第20天清晨空腹取EDTA-Na2外周静脉抗凝血2~3 mL。T淋巴细胞亚群检测前取患者EDTA-Na2抗凝血100 μL,分别加入各表型相应的荧光标记抗体10 μL,振荡混匀后避光20 min,应用Q-prep自动溶血仪溶血,5 min后应用流式细胞仪进行检测。

表1 125例非小细胞肺癌患者的临床特征
1.5 流式细胞仪检测淋巴细胞表型 利用流式细胞仪分析功能软件进行双参数获得数据分析。激光光源为15 mW的氩离子激光,波长为488 nm。测定前用质控微球(直径5 μm,Immunothech)调校仪器,以保证其荧光检测的CV值<2%。计数10 000个细胞,每个标本用同型抗体作自身阴性对照,然后检测各细胞表型的阳性表达率。

2 结果
2.1 化疗前后T淋巴细胞亚群变化情况 经统计学分析,晚期NSCLC癌患者化疗后CD3+、CD3+CD4+、CD3+CD8+、CD4+CD29+、CD3+HLA-DR+、45RO+、CD4+CD45RA+、CD4+CD45RO+、CD28+、CD8+CD28-细胞在外周血淋巴细胞中的百分比例较化疗前明显升高,自然杀伤细胞(NK)(CD3-CD16+或56+)、CD19+细胞百分比则明显降低(P<0.05);而NKT(CD3+CD16+或56+)、CD29+、CD25+、Treg(CD4+CD25+)、HLA-DR+、CD3+HLADR-、45RA+、CD8+CD28+以及CD4+/CD8+比值在化疗前后的变化差异无统计学意义(P>0.05)。见表2。
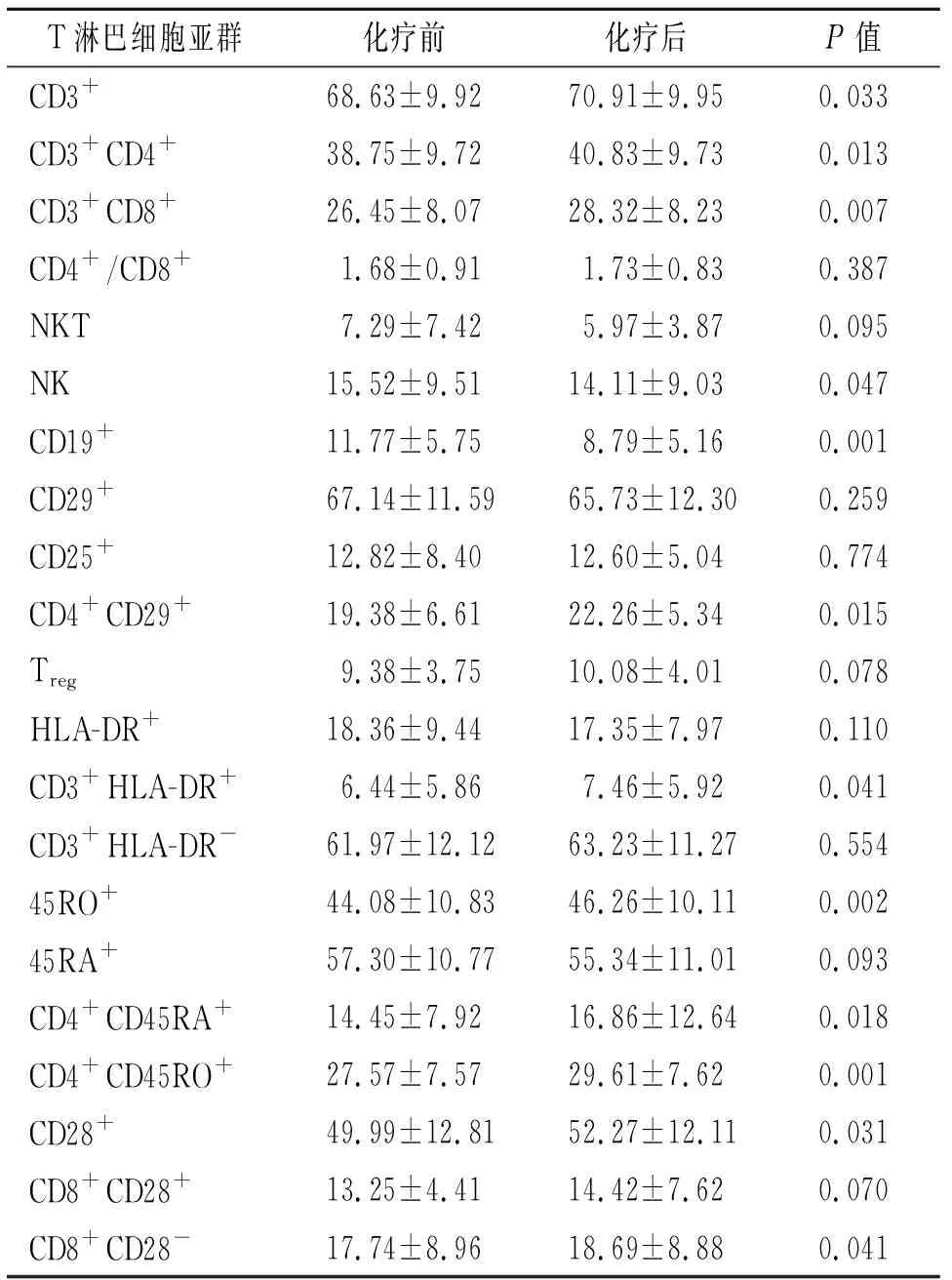
表2 125例非小细胞肺癌患者化疗前后淋巴细胞亚群在外周血中百分比例变化情况
2.2 亚组分析结果 在亚组分析中我们分析了不同化疗方案对研究对象T淋巴细胞亚群的影响。结果显示:接受不同化疗方案化疗后患者CD19+、CD25+、Treg这三种淋巴细胞亚群在外周血中的百分比差异有统计学意义(P<0.05);紫杉+铂类组CD19+细胞百分比最低,培美+铂类组则最高;培美+铂类组CD25+和Treg细胞的百分比最低,其他化疗方案组则最高;除上述三种淋巴细胞亚群外,其余亚群在外周血中的百分比在不同化疗方案组患者之间差异无统计学意义(P>0.05)。见表3。

表3 不同化疗方案对非小细胞肺癌患者淋巴细胞亚群在外周血中百分比例的影响
3 讨论
本研究的结果显示,经标准一线方案化疗后,晚期NSCLC患者外周静脉血中的CD3+、CD3+CD4+、CD3+CD8+、CD4+CD29+、CD3+HLA-DR+、45RO+、CD4+CD45RA+、CD4+CD45RO+、CD28+、CD8+CD28-细胞百分比较化疗前明显升高,CD19+和NK细胞百分比则明显降低(P<0.05)。其余9项淋巴细胞亚群指标,包括NKT(CD3+CD16+或56+)、CD29+、CD25+、Treg(CD4+CD25+)、HLA-DR+、CD3+HLADR-、45RA+、CD8+CD28+以及CD4+/CD8+比值化疗前后的变化则差异无统计学意义(P>0.05)。
从本研究的结果中可以发现:2个周期的一线化疗后,NSCLC患者的体液免疫功能有所下降,因为反映机体的体液免疫功能的CD19+细胞的百分比化疗后是明显降低的。但是2周期的化疗后患者不仅传统的CD3+、CD4+和CD8+T细胞的百分比经化疗后明显升高,其他多个反映机体细胞免疫功能的T淋巴细胞亚群(CD4+CD29+、CD3+HLA-DR+、45RO+、CD4+CD45RA+、CD4+CD45RO+和CD28+T细胞)的百分比亦明显升高。CD4+CD29+被认为是辅助诱导T细胞,有研究认为CD4+CD29high细胞与Th1细胞紧密相关。该类细胞在炎症部位经炎性物质或炎性因子的刺激可活化,进而通过分泌IFN-γ和TNF-α上调机体的免疫应答,增强患者免疫功能[13]。CD4+CD29+记忆性细胞是免疫功能缺陷是否会发生的的预测性指标之一,有学者认为该类细胞的消减是机体免疫功能降低的早期标志之一[14]。另外,CD45RO+T细胞被称为“记忆性”T细胞,CD45RO+T细胞的亚群CD4+CD45RO+T细胞又被称为辅助诱导细胞。当这群细胞再次接触相同的抗原后可被迅速活化、增殖,进而释放IL-2、IL-4、IFN-γ等Th1类细胞因子,可辅助B淋巴细胞快速合成和分泌IgG抗体,从而增强机体的体液和细胞免疫。亦有研究结果显示,肿瘤免疫微环境中CD45RO+T细胞富集患者的预后要明显优于CD45RO+T细胞缺乏的患者。而HLA-DR+细胞则在一定程度上反映了机体T淋巴细胞的活化程度,HLA-DR+细胞百分比越高提示淋巴细胞的活化程度越高[15-16]。CD4+CD29+、CD3+HLA-DR+、45RO+、CD4+CD45RO+和CD28+T细胞的升高表明机体细胞免疫功能处于增强状态。而CD4+CD25+Foxp3+T细胞则被认为是调节性T细胞,多项研究结果显示该类细胞可通过抑制机体的抗肿瘤免疫功能而与多种恶性肿瘤的进展和预后呈负相关[17-18]。本研究结果显示Treg细胞的百分比化疗前后并无明显变化,由此提示负性调节机体免疫功能的情况在2周期化疗后并未出现。
众所周知,不同的化疗药物其毒副作用不尽相同。那么不同的化疗方案对晚期NSCLC患者免疫功能的影响是否存在差异呢?为此本研究进行了亚组分析。亚组分析结果显示,接受不同化疗方案化疗后患者CD19+、CD25+、Treg这三种淋巴细胞亚群在外周血中的百分比差异有统计学意义(P<0.05),其余亚群在外周血中的百分比在不同化疗方案组患者之间差异无统计学意义(P>0.05)。这一结果提示不同的化疗方案对晚期NSCLC患者整体免疫功能的影响的差异并不显著。因为紫杉+铂类组CD19+细胞百分比最低,而培美曲塞+铂类组则最高,故紫杉+铂类方案可能对患者的体液免疫功能的减低作用相对明显,而培美曲塞+铂类方案降低体液免疫功能的影响相对较弱。而因培美+铂类组CD25+和Treg细胞的百分比最低,其他化疗方案组则最高,故可认为培美曲塞+铂类方案对机体的免疫抑制作用要低于紫杉+铂类方案以及其他化疗方案。
本研究显示,2个周期的一线标准方案的化疗并未降低晚期NSCLC患者的细胞免疫功能,相反患者经化疗后其整体免疫功能还处于增强状态;不同的化疗方案对晚期NSCLC患者整体免疫功能的影响差异不大;培美曲塞+铂类方案对机体的免疫抑制作用要低于紫杉+铂类方案以及其他化疗方案。
此外,据文献研究报道推论营养不良是免疫缺陷的原因[19],在肺癌患者中这可能导致抗肿瘤免疫细胞渗透差。因此,这可以解释低前清蛋白水平对长期生存率的强烈的负面影响。此外,炎症状态(先前存在或伴随)随着肺癌的增加,能量消耗增加可能导致营养不良。已经证明肿瘤内密度高的MDC和CD8+T淋巴细胞与改善预后相关[20-21]。营养状况也是肺癌患者生存的一个决定性因素[22-23],Alifamo等[24]研究结果表明患有全身性炎症和营养不良状况可能影响肿瘤内免疫组织和患者的生存率。肿瘤免疫微环境也已被证明是在原发性和转移性肿瘤[25]长期预后的重要因素:特别是在NSCLC,高水平的成熟树突状细胞和CD8+淋巴细胞被认为是强有力的预后因素[26-27]。本实验尚存在一些不足,忽略了营养状况对免疫状况的影响,存在营养风险或营养不足的肺癌患者,经过化疗后,免疫状况受到干扰,需要进一步分析营养状态。
[1] HAMANN D,BAARS P A,REP M H,et al.Phenotypic and functional separation of memory and effector human CD8+T cells[J].J Exp Med,1997,186(9):1407-1418.
[2] SALLUSTO F,LENIG D,FÖRSTER R,et al.Two subsets of memory T lymphocytes with distinct homing potentials and effector functions[J].Nature,1999,401(6754):708-712.
[3] RUFER N,ZIPPELIUS A,BATARD P,et al.Ex vivo characterization of human CD8+T subsets with distinct replicative history and partial effector functions[J].Blood,2003,102(5):1779-1787.
[4] 苏同义,朱铁年,高冬梅,等.不同化疗方案对晚期非小细胞肺癌患者骨髓抑制及免疫功能的影响[J].现代生物医学进展,2014,14(21):4067-4070.
[5] 王兴春.老年非小细胞肺癌患者化疗后细胞免疫功能的变化[J].中国老年学杂志,2014,34(7):1796-1797.
[6] 徐校成,吕颖颖,徐佳灵.晚期非小细胞肺癌患者化疗对免疫功能的影响[J].中华医院感染学杂志,2015,25(6):1312-1314.
[7] KEMPF R A,MITCHELL M S.Effects of chemotherapeutic agents on the immune response.Ⅰ [J].Cancer Invest,1984,2(6):459-466.
[8] STRENDER L E,BLOMGREN H,PETRINI B,et al.Immunologic monitoring in breast cancer patients receiving postoperative adjuvant chemotherapy[J].Cancer,1981,48(9):1996-2002.
[9] 冯正权,张祺箐,王莉.中药联合化疗对中晚期非小细胞肺癌免疫功能的影响[J].中国肿瘤,2014,23(5):417-420.
[10] 燕翔,赵晓,焦顺昌,等.晚期肺腺癌患者一线化疗后T淋巴细胞亚群变化及临床意义[J].中国肺癌杂志,2012,15(3):164-171.
[11] MCCOY M J,LAKE R A,VAN DER MOST R G,et al.Post-chemotherapy T-cell recovery is a marker of improved survival in patients with advanced thoracic malignancies[J].Br J Cancer,2012,107(7):1107-1115.
[12] GAMEIRO S R,CABALLERO J A,HIGGINS J P,et al.Exploitation of differential homeostatic proliferation of T-cell subsets following chemotherapy to enhance the efficacy of vaccine-mediated antitumor responses[J].Cancer Immunol Immun,2011,60(9):1227-1242.
[13] MATSUI M,ARAYA S,WANG H Y,et al.Circulating lymphocyte subsets linked to intracellular cytokine profiles in normal humans[J].Clin Exp Immunol,2003,134(2):225-231.
[14] DIAGBOUGA S,CHIRON J P,SANOU O,et al.Alteration in CD29(high) CD4+lymphocyte subset is a common feature of early HIV disease and of active tuberculosis[J].Scand J Immunol,2001,53(1):79-84.
[15] YACYSHYN M B,POPPEMA S,BERG A,et al.CD69+and HLA-DR+ activation antigens on peripheral blood lymphocyte populations in metastatic breast and ovarian cancer patients:correlations with survival following active specific immunotherapy[J].Int J Cancer,1995,61(4):470-474.
[16] CARUSO A,LICENZIATI S,CORULLI M,et al.Flow cytometric analysis of activation markers on stimulated T cells and their correlation with cell proliferation[J].Cytometry,1997,27(1):71-76.
[17] WOLF A M,WOLF D,STEURER M,et al.Increase of regulatory T cells in the peripheral blood of cancer patients[J].Clin Cancer Res,2003,9(2):606-612.
[18] CHEN C,CHEN Z,CHEN D,et al.Suppressive effects of gemcitabine plus cisplatin chemotherapy on regulatory T cells in nonsmall-cell lung cancer[J].J Int Med Res,2015,43(2):180-187.
[19] CHANDRA R K.Nutrtion and the immune system:an introduction[J].Am J Clin Nutr,1997,66(2):460S-463S.
[20] DIEU-NOSJEAN M C,ANTOINE M,DANEL C,et al.Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures[J].J Clin Oncol,2008,26(27):4410-4417.
[21] GOC J,GERMAIN C,VO-BOURGAIS T K,et al.Dendritic cells in tumor-associated tertiary lymphoid structures license the positive prognostic value of tumor-infiltrating CD8+T cells[J].Cancer Res,2014,74(3):705-715.
[22] ALIFANO M,FALCOZ P E,SEEGERS V,et al.Preresection serum C-reactive protein measurement and survival among patients with resectable non-small cell lung cancer[J].J Thorac Cardiovasc Surg,2011,142(5):1161-1167.
[23] TEWARI N,MARTIN-UCAR A E,BLACK E,et al.Nutritional status affects long term survival after lobectomy for lung cancer[J].Lung Cancer,2007,57(3):389-394.
[24] ALIFAMO M,MANSUET-LOPE A,LOCOCO F,et al.Systemic inflammation,nutritional status and tumor immune microenvironmen determine outcome of resected non-small cell lung cancer[J].PLOS One,2014,9(9):1-11.
[25] FRIDMAN W H,PAGES F,SAUTES-FRIDMAN C,et al.The immune contexture in human tumours:impact on clinical outcome[J].Nat Rev Cancer,2012,12(4):298-306,
[26] DIEU-NOSJEAN M C,ANTOINE M,DANEL C,et al.Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures[J].J Clin Oncol,2008,26(27):4410-4016.
[27] REMARK R,ALIFANO M,CREMER I,et al.Characteristics and clinical impacts of the immune environments in colorectal and renal cell carcinoma lung metastases:influence of tumor origin[J].Clin Cancer Res,2013,19(15):4079-4091.
Analysisonthechangesoflymphocytesubsetsamongcolorectalcarcinomapatientsbeforeandafterthechemotherapy
WuYunbo*,ZhangWeiqiang,WeiZhimin,ZhangGuoqing,LiuZhefeng,JiaoShunchang
(*DepartmentofClinicalOncology,GeneralHospitalofPLA,Beijing100853,China)
[Abstract]ObjectiveTo investigate the differences of 21 lymphocyte subsets before and after 2 cycles of chemotherapy in patients with advanced non-small cell lung cancer (NSCLC) patients.Methods21 peripheral blood lymphocyte subsets from 125 advanced non-small cell lung cancer patients before and after 2 cycles of first-line chemotherapy drugs of paclitaxel with cisplatin or carboplatin (TC/TP),pemetrexed with cisplatin or carboplatin (PC/PP) or other chemotherapy regimens were detected by three immune-fluorescence staining and the flow cytometry (FCM).The differences of these lymphocyte subsets percentage were analyzed statistically with SPSS 17.0 software.ResultsAfter chemotherapy,the percentage of CD3+,CD3+CD4+,CD3+CD8+,CD4+CD29+,CD3+HLA-DR+,45RO+,CD4+CD45RA+,CD4+CD45RO+,CD28+,CD8+CD28-cells in peripheral blood of advanced NSCLC patients were significantly increased,while the percentage of NK (CD3-CD16+or 56+) and CD19+cells was significantly decreased compared to that before chemotherapy (P<0.05).After chemotherapy,the percentage of CD19+cells was notably low in the TC/TP group compared with that in the PC/PP group and other chemotherapy groups,while it was notably high in the PC/PP group compared with that in TC/TP group and other chemotherapy groups (P<0.05).The percentage of CD25+and Tregcells was decreased significantly in PC/PP treatment group,and increased significantly in other chemotherapy groups(P<0.05).In addition,there were no significant differences in the percentage of other lymphocyte subsets in different chemotherapy groups.Conclusions2 cycles of first-line chemotherapy drugs lowered the humoral immune ability and enhanced the cellular immune ability of the advanced NSCLC patients.The suppression of TC/TP chemotherapy regimen on humoral immunity is more notable compared to PC/PP chemotherapy regimen.The immunosuppressive effect of PC/PP is weaker than TC/TP.
[Keywords]Carcinoma,non-small-cell Lung;Antineoplastic combined chemotherapy protocols;Lymphocyte subsets;Immune system phenomena
中图分类号:R734.2
A
10.3969/J.issn.1672-6790.2018.03.026
基金项目:中央保健委保健专项科研课题(14BJZ47)
作者简介:吴云波,主治医师,Email:332163033@qq.com
2018-03-22)

