Stretched-exponential model of DWI in differentiating malignant and benign breast lesions
, ZG , ZG ,
(Department of MRI, People's Hospital of Xinzhou, Xinzhou 034000, China)
动态对比增强MRI(dynamic contrast enhancement MRI, DCE-MRI)检查乳腺病变的价值已得到临床普遍认可,其诊断敏感度很高,能早期发现病灶,但特异度波动较大,可能造成误诊[1-3]。DWI可通过探测水分子微观运动反映病变情况,能有效配合乳腺动态增强扫描[4]。然而,体内水分子扩散运动受细胞密度和组织微观结构的影响,且取决于体素内微循环灌注和扩散异质性,传统单指数模型DWI不能完全真实反映组织扩散的生物学特征。有学者[5-6]提出应用拉伸指数模型DWI测得的体素内扩散率更接近活体组织水分子的扩散异质性和多区间性,可反映水分子运动在微环境区间内连续分布的扩散情况。本研究探讨拉伸指数模型DWI诊断良恶性乳腺病变的价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年3月—2015年3月于我院接受乳腺MR检查且经手术病理证实的58例乳腺疾病患者的资料,患者均为女性,年龄27~68岁,平均(46.8±8.7)岁;共63个病灶,其中恶性病灶30个(包括浸润性导管癌27个、导管原位癌3个),良性病灶33个(包括纤维腺瘤20个、炎症6个、导管内乳头状瘤4个、腺病3个)。所有患者MR检查前均无手术或放化疗治疗史。
1.2 仪器与方法 采用GE Signa HDxt 3.0T超导型MR扫描仪,乳腺相控阵表面线圈,头先进,嘱患者俯卧,充分暴露双侧乳腺,使之自然下垂,双臂置于头两侧。MR扫描序列包括T1W、脂肪抑制T2W、常规DWI、拉伸指数模型多b值DWI及DCE-MRI。多b值DWI参数:选择0、10、20、30、50、100、200、400、600、800、1 000和1 200 s/mm2共12个b值,扩散敏感梯度场施加方向为3个,TR 2 500 ms,TE 27.5ms,FOV 32 cm×32 cm,矩阵128×128,层厚4 mm,层间距1 mm。DCE-MRI采用Vibrant-Flex技术,共扫描10期(1期增强前蒙片和9期增强扫描),TR 4.4 ms,TE 1.8 ms,FA 10°,FOV 32 cm×32 cm,矩阵320×320,层厚2 mm,对比剂使用钆喷酸葡胺,剂量为 0.2 mmol/kg体质量。
1.3 图像后处理 将原始数据传至GE AW 4.4工作站,通过Functool工具包后处理得到ADC、扩散分布指数(distributed diffusion coefficient, DDC)和扩散异质性指数(α)伪彩图。在DWI原始图上选取最大病灶层面手动勾画ROI,避开囊变坏死区,测量3次,取平均值。相应地,在动态增强图像中绘制病变区ROI的时间—信号强度曲线(time-intensity curve, TIC),分为Ⅰ型(上升型)、Ⅱ型(速升平台型)或Ⅲ型(流出型)[7]。
1.4 统计学方法 采用SPSS 19.0统计分析软件。计量资料以±s表示,计数资料用百分比表示。乳腺良恶性病变间计量资料比较采用两独立样本t检验,计数资料比较采用χ2检验或Fisher精确检验。绘制各参数ROC曲线,计算AUC,并确定各参数诊断乳腺良恶性病变的临界值。P<0.05为差异有统计学意义。
2 结果
2.1 各模型DWI参数及TIC曲线类型的比较 乳腺恶性病变的DDC、α、ADC值均低于良性病变(P均<0.01)。恶性病变以Ⅲ型曲线多见,良性病变以Ⅰ型曲线多见(表1,图1~3)。
2.2 鉴别乳腺良恶性病变的效能 以ADC值1.20×10-3mm2/s、DDC值1.22×10-3mm2/s、α值0.830、TIC Ⅱ型和Ⅲ型曲线为临界值诊断乳腺恶性病变的敏感度、特异度及AUC见表2、图4。
3 讨论
DWI和DCE-MRI均为临床MR乳腺检查广泛应用的技术[8-9]。由于乳腺恶性肿瘤的新生肿瘤血管及动静脉畸形,使对比剂快速流入并流出,故其TIC多为Ⅲ型流出曲线,也有部分病灶为Ⅱ型速升平台曲线;而良性病变内纤维间隔较多,对比剂进入病灶较慢,常表现为病灶持续强化,即Ⅰ型上升曲线。BI-BADS分类中将流出型和速升平台型曲线视为提示恶性的指标[10-11]。本研究以此标准诊断乳腺病变,敏感度高而特异度略低,与部分良性病灶血供较丰富有关——炎症或腺病也可表现为Ⅱ型曲线。研究[7,12-13]表明,乳腺良恶性病变在Ⅱ型曲线有所重叠,故用DCE-MRI诊断乳腺癌时应慎重,必要时应结合DWI参数对病灶进行定量分析。
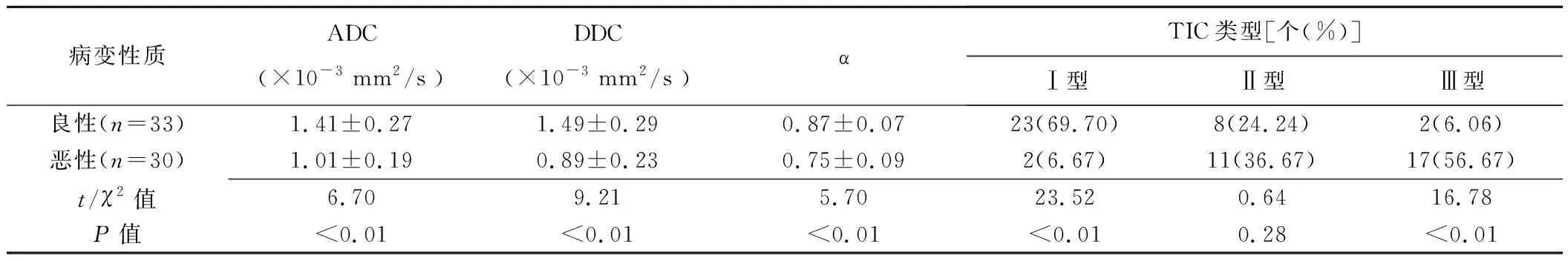
表1 乳腺良恶性病变各模型DWI参数及TIC类型比较

表2 各模型DWI参数及TIC诊断乳腺良恶性病变的效能
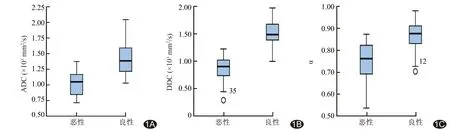
图1 DWI各参数在乳腺良恶性病变中分布的箱式图 A.ADC值; B.DDC值; C.α值

图2 患者女,42岁,乳腺浸润性导管癌 A.增强图像示右乳内侧近胸壁不规则环形强化; B.TIC曲线为Ⅲ型; C.在DWI原始图像勾画ROI; D.ADC值伪彩图,ADC值为0.881×10-3 mm2/s; E.DDC值伪彩图,DDC值为0.793×10-3 mm2/s; F.α值伪彩图,α值为0.747

图3 患者女,37岁,乳腺纤维腺瘤 A.增强图像示右乳内下象限类圆形强化; B.TIC曲线为Ⅰ型; C.在DWI原始图像勾画ROI; D.ADC值伪彩图,ADC值为1.80×10-3 mm2/s; E.DDC值伪彩图,DDC值为1.84×10-3 mm2/s; E.α值伪彩图,α值为0.935

图4 各模型参数及TIC诊断乳腺良恶性病变的ROC曲线图
常规DWI使用单指数模型来描述水分子扩散运动中的信号衰减,可以得出每个体素区的ADC值。与良性病变相比,恶性肿瘤的细胞密度更大,限制了水分子扩散,使ADC值有所降低[14-15],本研究结果与之相符。然而,组织内信号衰减不仅由于水分子扩散运动,还受体素内微循环血流灌注和扩散不均匀性的影响。在细胞层面微观结构的影响下,水分子扩散运动更加复杂,尤其肿瘤组织的细胞异型性和新生血管不规则纡曲走行,导致微观结构更加复杂,使单指数模型无法准确描述水分子扩散的信号衰减,需要采用其他模型来描述水分子扩散运动的复杂性。
Le Bihan等[16]提出了体素内不相干运动(intravoxel incoherent motion, IVIM)模型。假设活体组织内存在血管内、外两种扩散成分,可计算反映扩散和灌注的相应参数,其局限性在于其人为将体素内扩散分为快速和慢速两种,且两者不交换。为克服IVIM模型的局限性,Bennett等[5]引入了拉伸指数模型定量计算扩散系数,拉伸指数模型数学公式为:S(b)/S0=exp{-(b×DDC)α},其中DDC为分布扩散系数,代表体素内平均扩散率,可认为是多指数衰减成分组成的1个ADC值分布的加权和,能更准确地在目前的多参数模型中描述组织扩散;α是拉伸指数模型引入的一种全新参数,可反映体素内异质性,范围为0~1,当α=1时DDC实际等于ADC,表明体素内扩散均匀,相当于单指数信号衰减,α越趋近于0,表明体素内扩散异质性越高,代表复杂的多指数信号衰减。
目前仅有将拉伸指数模型DWI应用于胶质瘤分级诊断的研究报道[6]。本研究将拉伸指数模型DWI技术应用于乳腺病变,发现乳腺良恶性病变之间DDC和α有显著差异;以DDC≤1.22×10-3mm2/s诊断乳腺癌,敏感度为96.67%,特异度为81.82%。类似于ADC,DDC也与细胞密度呈负相关[6]。恶性病变α值同样低于良性病变,以α≤0.830诊断乳腺癌,其敏感度为83.33%,特异度为75.76%。这反映出乳腺癌体素内扩散异质性比高于良性病变大,主要是由于恶性肿瘤组织内有大量纡曲的新生血管,较小囊变和坏死出现,体素内具有不同质子池的成分增多,使α减低[17]。利用ROC曲线评估ADC、DDC和α以及TIC曲线类型的诊断效能,DDC的诊断效能高于ADC、α以及TIC。将DDC与α联合诊断,AUC可提高至0.971;联合使用TIC与DDC,诊断能力更高,AUC达0.976,敏感度和特异度分别为93.33%和93.94%。
总之,拉伸指数模型参数DDC、α能区分乳腺良恶性病变,分布扩散系数DDC值较传统ADC值诊断效能更强;DDC与DCE-MRI联合,可弥补DCE-MRI特异度不足的缺陷。
[参考文献]
[1] Pinker K, Bickel H, Helbich TH, et al. Combined contrast-enhanced magnetic resonance and diffusion-weighted imaging reading adapted to the "Breast Imaging Reporting and Data System" for multiparametric 3-T imaging of breast lesions. Eur Radiol, 2013,23(7):1791-1802.
[2] Partridge SC, Stone KM, Strigel RM, et al. Breast DCE-MRI: Influence of post contrast timing on automated lesion kinetics assessments and discrimination of benign and malignant lesions. Acad Radiol, 2014,21(9):1195-1203.
[3] Pickles MD, Lowry M, Manton DJ, et al. Prognostic value of DCE-MRI in breast cancer patients undergoing neoadjuvant chemotherapy: A comparison with traditional survival indicators. Eur Radiol, 2015,25(4):1097-1106.
[4] Brandao AC, Lehman CD, Partridge SC. Breast magnetic resonance imaging:Diffusion-weighted imaging. Magn Reson Imaging Clin N Am, 2013,21(2):321-336.
[5] Bennett KM, Schmainda KM, Bennett RT, et al.Characterization of continuously distributed cortical water diffusion rates with a stretched-exponential model. Magn Reson Med, 2003,50(4):727-734.
[6] Kwee TC, Galban CJ, Tsien C, et al. Comparison of apparent diffusion coefficients and distributed diffusion coefficients in high-grade gliomas. J Magn Reson Imaging, 2010,31(3):531-537.
[7] American College of Radiology. Breast imaging reporting and data system, breast imaging atlas. Reston:American College of Radiology, 2013.
[8] Yi A, Cho N, Im SA, et al.Survival outcomes of breast cancer patients who receive neoadjuvant chemotherapy: Association with dynamic contrast-enhanced MR imaging with computer-aided evaluation. Radiology, 2013,268(3):662-672.
[9] Ho JS, Rahmat K, Alli K, et al. Primary breast osteosarcoma: Dynamic contrast-enhanced magnetic resonance imaging, proton spectroscopy and diffusion weighted imaging findings. Ann Acad Med Singapore, 2012,41(10):473-475.
[10] Kuhl CK, Mielcareck P, Klaschik S, et al. Dynamic breast MR imaging: Are signal intensity time course data useful for differential diagnosis of enhancing lesions? Radiology, 1999,211(1):101-110.
[11] Heller SL, Moy L, Lavianlivi S, et al. Differentiation of malignant and benign breast lesions using magnetization transfer imaging and dynamic contrast-enhanced MRI. J Magn Reson Imaging, 2013,37(1):138-145.
[12] 赵金丽,管海涛,李敏达,等.MR动态增强扫描结合T2WI*首过灌注成像诊断乳腺肿瘤的价值.磁共振成像,2014,4(1):54-59.
[13] 周纯武,赵莉芸,李静.磁共振成像在乳腺疾病的应用及进展.磁共振成像,2014,5(增刊):56-61.
[14] Costantini M, Belli P, Rinaldi P, et al. Diffusion-weighted imaging in breast cancer: Relationship between apparent diffusion coefficient and tumour aggressiveness. Clin Radiol, 2010,65(12):1005-1012.
[15] 贺延莉,靳二虎,马大庆,等.ADC值测量对不同病理类型乳腺癌的诊断价值.临床放射学杂志,2009,28(8):1082-1085.
[16] Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: Application to diffusion and perfusion in neurologic disorders. Radiology, 1986,161(2):401-407.
[17] Bennett KM, Hyde JS, Rand SD, et al. Intravoxel distribution of DWI decay rates reveals C6 glioma invasion in rat brain. Magn Reson Med, 2004,52(5):994-1004.
- 中国医学影像技术的其它文章
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- Quantitative analysis of dynamic contrast-enhanced MRI in distinguishing different grades of prostate cancer
- Gynecologic imaging reporting and data system combined with three-dimensional contrast-enhanced ultrasonography for differential diagnosis of benign and malignant ovarian masses
- Gd-EOB-DTPA enhanced MRI in assessing whole liver and segmental liver function
- Consistency of different physicians in diagnosis of malignant breast lesions with breast CEUS predictive model: A multicenter study
- Contrast-enhanced MRA in differential diagnosis of spinal cord vascular malformation and secondary vascular tortuosity caused by non vascular malformations on spinal cord

