CYP2C19基因多态性检测指导下的伏立康唑治疗侵袭性真菌感染患者效果的评价
牛丙寅 王 冠 陈世才 翁以炳
(首都医科大学附属北京潞河医院急救医学部, 北京 101100)
侵袭性真菌感染是重症医学科较为常见的情况,治疗耗时长、效果参差不齐。近年来的研究[1]表明,人体内的代谢酶CYP2C19是影响抗真菌治疗的一个主要因素。CYP2C19主要对伏立康唑产生作用,该药是新型的第二代三唑类抗真菌药物,作用机制是抑制真菌中由细胞色素P450介导的14-α醇去甲基化,从而抑制麦角醇的生物合成、发挥抗真菌活性。CYP2C19具有明显的遗传多态性,存在多个多态性位点[2]。其中,CYP2C19*2、CYP2C19*3和CYP2C19*17为该基因的主要突变体,也是导致伏立康唑药代动力学特征存在较大个体间差异的主要原因之一。目前,已经有一些CYP2C19对伏立康唑血药动力学研究的报道[3-9]。但就全身侵袭性真菌感染而言,CYP2C19基因多态性对伏立康唑治疗效果存在哪些影响仍鲜有报道,本研究拟就此做一分析、并评价伏立康唑标准治疗剂量对其效果、费用及合并症的影响等情况,为临床此类患者的个体化治疗方案的设计提供指导。
1 对象与方法
1.1 研究对象
本研究采用非随机对照研究方法,设为试验组(对确诊为侵袭性真菌感染的患者进行基因多态性分析后决定伏立康唑的使用剂量)和对照组(确诊后不做基因分型,按标准剂量给予治疗)。
纳入对象为2015年12月至2017年5月收住首都医科大学附属北京潞河医院急救医学部重症医学科、急诊监护病房的40例患者。纳入标准:诊断为侵袭性真菌感染[10-11],可以使用伏立康唑治疗,并同意评价及随访伏立康治疗效果的患者。排除标准:中、重度肾功能损害患者(肌酐清除率<50 mL/min);重度肝功能异常患者(丙氨酸氨基转移酶或门冬氨酸氨基转移酶)>正常3倍,或Child-Pugh分级C级;联合应用了可影响伏立康唑疗效的药物。采集所有患者的一般资料(性别、年龄、体质量指数)、治疗药物及其剂量以及合并用药等[12]。对照组为2013年12月至2015年11月于本科采用标准化侵袭性真菌感染治疗的40例患者。
1.2 DNA提取
采集患者抗凝全血5 mL,送本院临床药学室按照血液基因组提取试剂盒(购自北京华夏时代基因科技发展有限公司)的流程提取基因组DNA,并运用PCR-RFLP方法对患者CYP2C19*2、CYP2C19*3、CYP2C19*17位点进行基因型分析,并出具其对伏立康唑代谢型的报告。
1.3 出具报告
通过DNA检测试剂盒对CYP2C19基因分析扩增至O1CYP2C19*2(G>A);O2CYP2C19*3(G>A);60CYP2C19*17(C>T),并经凝胶电泳、硝酸银染色并拍照出具报告。
1.4 治疗方法
依据患者个体化基因检测结果提示高代谢型(extensive metabolizer,EM)的681GG-636GG、中等代谢型(intermediate metabolizer,lM)的681GA-636GG和681GG-636GA以及低代谢型(poor metabolizer,PM),将入组患者分为3组,分别应用标准化抗侵袭性真菌感染治疗方案,伏立康唑给药方案为[7]:入组患者均静脉首剂负荷400 mg,随后维持剂量为EM组给予静脉滴注400 mg;IM组给予200 mg;PM组给予200 mg,3组均为每12 h 1次。
1.5 统计学方法
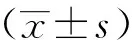
2 结果
2.1 一般资料
符合入选标准、并纳入本研究的样本量80例,男性与女性比例约为1.35∶1,年龄为(34~91)岁,平均年龄(71.15±14.33)岁,体质量指数 (body mass index,BMI)为0~25 kg/m2,平均(21.11±4.58) kg/m2,住院天数为7~133 d,平均(17±93.23)d,伏立康唑使用总费用1 330~5 600元,平均费用(用2 219.18±890.42)元。80例样本中,重症肺炎患者43例,存在慢性阻塞性肺疾病患者39例,合并慢性肺心病患者7例,免疫抑制患者2例。此外,纳入研究的80例样本中均有真菌感染的临床证据,其中65例患者的微生物检验结果为阳性。患者的一般资料详见表1。
2.2 基因型
对CYP2C19位点进行基因型分析,因样本量及DNA试剂盒限制,笔者发现了其中5种双位点基因型,如表2所示,5种双位点基因型例数中,10例(25%)为EM,18例(45%)为IM,12例(30%)为PM。详见表2。
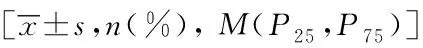
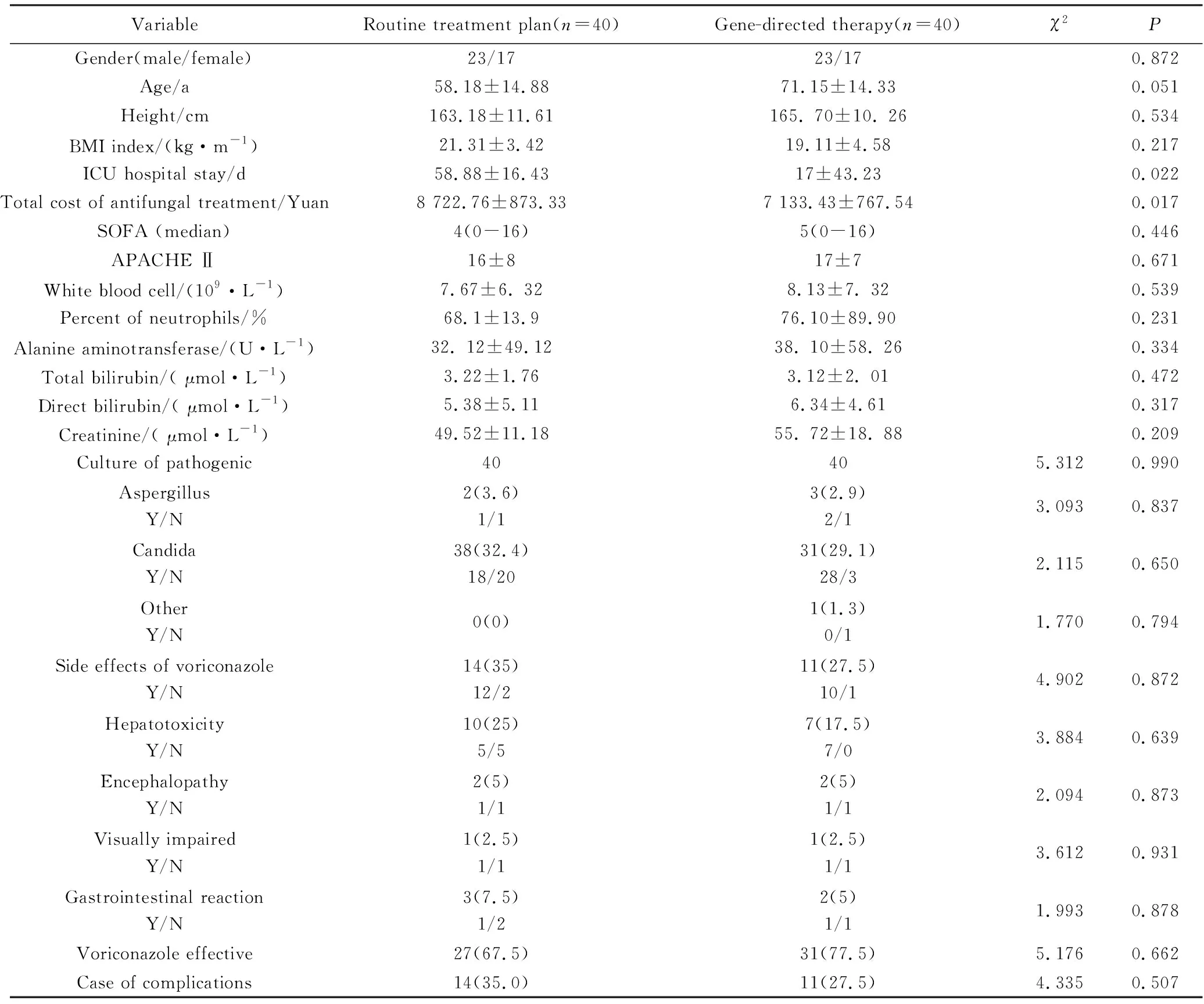
VariableRoutine treatment plan(n=40)Gene-directed therapy(n=40)χ2P Gender(male/female)23/1723/170.872Age/a58.18±14.8871.15±14.330.051Height/cm163.18±11.61165. 70±10. 260.534BMI index/(kg·m-1)21.31±3.4219.11±4.580.217ICU hospital stay/d58.88±16.4317±43.230.022Total cost of antifungal treatment/Yuan8 722.76±873.337 133.43±767.540.017SOFA (median)4(0-16)5(0-16)0.446APACHE Ⅱ 16±817±70.671White blood cell/(109·L-1) 7.67±6. 328.13±7. 320.539Percent of neutrophils/%68.1±13.976.10±89.900.231Alanine aminotransferase/(U·L-1)32. 12±49.1238. 10±58. 260.334Total bilirubin/( μmol·L-1)3.22±1.763.12±2. 010.472Direct bilirubin/( μmol·L-1) 5.38±5.116.34±4.610.317Creatinine/( μmol·L-1) 49.52±11.1855. 72±18. 880.209Culture of pathogenic40405.3120.990AspergillusY/N 2(3.6)1/13(2.9)2/13.0930.837CandidaY/N 38(32.4)18/2031(29.1)28/32.1150.650OtherY/N 0(0)1(1.3)0/11.7700.794Side effects of voriconazoleY/N14(35)12/211(27.5)10/14.9020.872HepatotoxicityY/N10(25)5/57(17.5)7/03.8840.639EncephalopathyY/N2(5)1/12(5)1/12.0940.873Visually impairedY/N 1(2.5)1/11(2.5)1/13.6120.931Gastrointestinal reactionY/N3(7.5)1/22(5)1/11.9930.878Voriconazole effective27(67.5)31(77.5)5.1760.662Case of complications14(35.0)11(27.5)4.3350.507
Y: voriconazole effective;N: voriconazole invalid;BMI:body mass index;ICU:intensive care unit;SOFA:sepsis-related organ failure assessment;APACHEⅡ:Acute Physical and Chronic Health Evaluation Ⅱ.
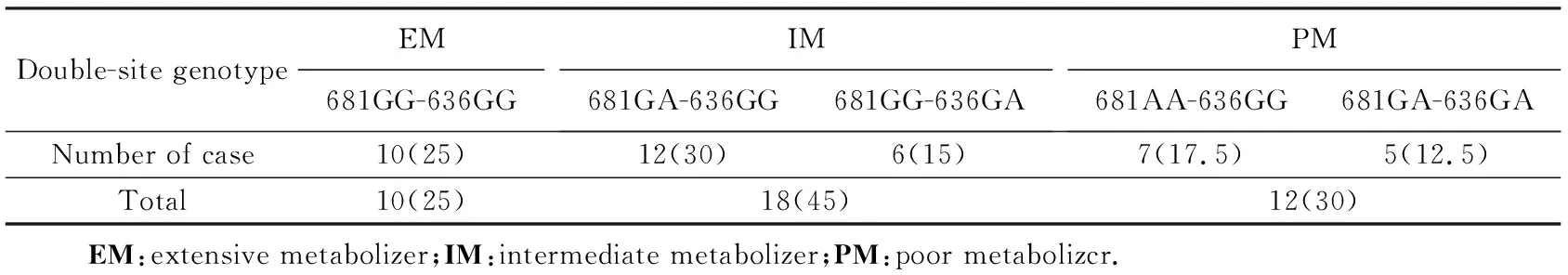
表2 CYP2C19基因型频率Tab.2 Frequency of genotypes of CYP2C19 double sites n(%)
将CYP2C19基因型指导下的伏立康唑治疗方案与患者住院天数、伏立康唑使用费用、药物疗效、不良反应进行相关性分析:由基因分型指导的标准化伏立康唑治疗的住院天数、药物费用、疗效、不良反应等指标明显低于对照组,治疗效果、费效比和不良反应方面,EM组、IM组和PM组中差异有统计学意义(P<0.05),且PM组高于IM组,IM组高于EM组(P<0.05),详见表3。
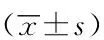
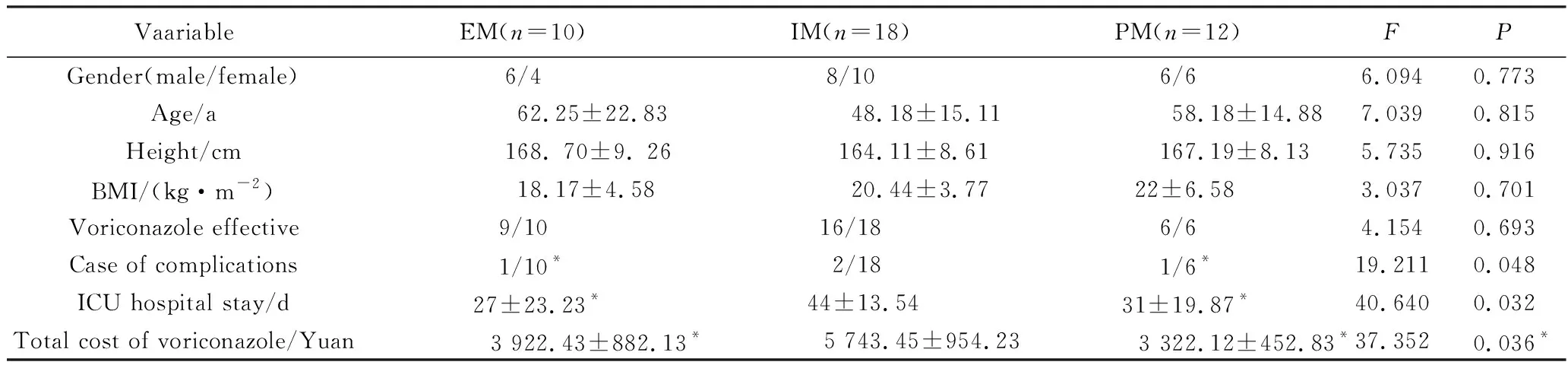
VaariableEM(n=10)IM(n=18)PM(n=12)FPGender(male/female) 6/48/106/66.0940.773Age/a62.25±22.8348.18±15.1158.18±14.887.0390.815Height/cm168. 70±9. 26164.11±8.61167.19±8.135.7350.916BMI/(kg·m-2)18.17±4.5820.44±3.7722±6.583.0370.701Voriconazole effective9/1016/186/64.1540.693Case of complications1/10*2/181/6*19.2110.048ICU hospital stay/d27±23.23*44±13.5431±19.87*40.6400.032Total cost of voriconazole/Yuan3 922.43±882.13*5 743.45±954.233 322.12±452.83*37.3520.036*
*P<0.05vsIM;EM:extensive metabolizer;IM:intermediate metabolizer;PM:poor metabolizcr;BMI:body mass index;ICU:intensive care unit.
3 讨论
伏立康唑主要通过肝脏细胞色素P450同工酶CYP2C19、CYP3114和CYP2C9代谢[1]。CYP2C19则是主要的代谢途径,根据CYP2C19基因型的不同,可将个体分为纯合子快代谢型、杂合子快代谢型以及纯合子慢代谢型,而CYP2C19呈遗传多态性,是引起个体和种族间对同一药物表现出不同代谢能力的原因之一。本研究结果提示3种CYP2C19基因代谢型之间差异均有统计学意义。3种基因型患者的疗效和不良反应比较的χ2检验结果显示,不同的基因型对药物疗效和不良反应存在明显不同的影响,这可能与不同基因型影响伏立康唑在体内代谢快慢有关,这为指导临床合理用药提供了重要依据,也为减轻患者住院时长及减少合并症的出现起到了显著的影响。
如患者基因检测存在高代谢CYP2C19 681GG-636GG,则考虑为对伏立康唑呈高代谢者,故临床按照抗真菌药物使用规范指南常规剂量给药,即可达到临床疗效,但应注意在效果不佳时可加大伏立康唑应用剂量;患者基因检测存在CYP2C19 681GA-636GG和681GG-636GA,应考虑为中等代谢,临床建议给予患者标准剂量即可达到伏立康唑抗菌效果,若检测存在低代谢CYP2C19 681AA-636GG和681GA-636GA基因时,则应减少临床伏立康唑使用剂量以避免不良反应出现概率。
对比应用基因检测指导使用伏立康唑剂量及常规按照指南治疗剂量患者住院时间及不良反应发生率均明显减少,且治愈率明显升高,故在临床上应用基因指导下药物使用存在明显优势。
鉴于侵袭性真菌感染在重症监护病房是一种严重危害患者的感染类型,早期识别、诊断和处理显得尤为重要[13-14]。迄今已有的研究尚缺乏成熟、准确的评估手段能早期发现本症。因此,对有关基因影响因素进行筛选、精确度量其评定价值、进而构建可应用于临床的、简便实用的预测模型就显得尤为必要,这不仅能减轻相关患者的疾病痛苦、也对降低患者的经济负担、合理利用医疗资源颇有裨益,而本院为北京东部地区最大的综合性医院,每年对大量创伤和各型术后以及各种急危重症患者进行救治,其中,还有大量细菌真菌感染病例,故在基因层面上有多种基因诊断伏立康唑敏感性不同,故产生多种不同的治疗效果。
综上所述,CYP2C19基因多态性检测对应用伏立康唑抗真菌治疗,在提高药物疗效,降低药物不良反应,减少患者住院时间及花费,指导侵袭性真菌感染重症患者抗真菌药物的合理使用中,具有显著的社会和经济意义。
[1] Job K M, Olson J, Stockmann C. et al. Pharmacodynamic studies of voriconazole: informing the clinical management of invasive fungal infections[J]. Expert Rev Anti Infect Ther, 2016,14(8):731-746.
[2] 王璨环,店惠林,段京莉.CYP2C19基因多态性对伏立康唑药代动力学影响的系统评价[J].中国临床药理学杂志,2011,27(8):607-611.
[3] Chuwongwattana S, Jantararoungtong T, Chitasombat M N, et al. A prospective observational study of CYP2C19 polymorphisms and voriconazole plasma level in adult Thai patients with invasive aspergillosis[J]. Drug Metab Pharmacokinet, 2016,31(2):117-122.
[4] Li X, Yu C, Wang T, et al. Effect of cytochrome P450 2C19 polymorphisms on the clinical outcomes of voriconazole: a systematic review and meta-analysis[J]. Eur J Clin Pharmacol, 2016,72(10):1185-1193.
[5] Owusu Obeng A, Egelund E F, Alsultan A, et al. CYP2C19 polymorphisms and therapeutic drug monitoring of voriconazole: are we ready for clinical implementation of pharmacogenomics?[J]. Pharmacotherapy,2014,34(7):703-718.
[6] Moriyama B, Kadri S, Henning S A, et al. Therapeutic drug monitoring and genotypic screening in the clinical use of voriconazole[J]. Curr Fungal Infect Rep, 2015,9(2):74-87.
[7] Barbarino J M, Owusu Obeng A, Klein T E, et al. Pharm GKB summary: voriconazole pathway, pharmacokinetics[J]. Pharmacogenet Genomics, 2017,27(5):201-209.
[8] Wang T, Zhu H, Sun J, et al. Efficacy and safety of voriconazole and CYP2C19 polymorphism for optimised dosage regimens in patients with invasive fungal infections[J]. Int J Antimicrob Agents,2014,44(5):436-442.
[9] Jin H, Wang T, Falcione B A, et al. Trough concentration of voriconazole and its relationship with efficacy and safety: a systematic review and meta-analysis[J]. J Antimicrob Chemother, 2016,71(7):1772-1785.
[10] 中华医学会重症医学分会. 重症患者侵袭性真菌感染诊断与治疗指南(2007) [J]. 中华内科杂志,2007,46(11): 960-966.
[11] Pappas P G, Kauffman C A, Andes D R, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America[J]. Clin Infect Dis, 2016, 62(4):e1-e50
[12] Rubio P M, Sevilla J, Gonzalez-Vicent M, et al. Increasing incidence of invasive aspergillosis in pediatric hematology oncology patients over the last decade:a retrospective single centre study [J]. J Pediatr Hematol Oncol,2009,31(9):642-646.
[13] Pestka E I,Hale A M,Johnson B I,et al. Cytochrome P450 testing for better psychiatric care[J]. J Psychosoc Nurs MentHealth Serv, 2007,4(10):15-18.
[14] 孙爱红,刘媛,姜扬文.急性白血病缓解期强化化疗肺肝脾侵袭性真菌感染误诊为白血病浸润[J].临床误诊误治,2017,30(11):16-18.

