膀胱癌根治术前单次动脉灌注化疗的长期疗效评估
瓦斯里江·瓦哈甫 刘 赛 王梦童 贺庆豹 宋黎明 平 浩 王明帅 杨飞亚 田溪泉
(首都医科大学附属北京朝阳医院泌尿外科,北京 100020)
肌层浸润性膀胱癌(muscle-invasive bladder cancer, MIBC)的5年生存率约为60%~70%,这一预后在过去30年内没有显著地提高[1-2]。根治性膀胱切除术加扩大淋巴结清扫是治疗浸润性膀胱癌的标准术式,但Zehnder等[3]回顾30年的手术病例发现其并没有显著改善生存率。近十几年里,顺铂为基础的新辅助化学药物治疗(以下简称化疗)的循证医学证据明显高于术后辅助化疗,而且预后也有所提高[4-6]。然而2010年美国国家癌症数据库显示仅有大约21%的患者接受新辅助和术后辅助化疗,大多数手术患者没有接受过化疗[7]。除了对于化疗不敏感的患者,新辅助化疗将可能导致过度治疗以外,延误手术时机也是医生考虑的主要原因[8]。腹腔镜膀胱癌根治(laparoscopic radical cystectomy, LRC)术前短期进行单次动脉灌注化疗是否可以在不延误手术时机的同时影响预后是本研究的目的。
1 资料与方法
1.1 一般资料
2006年2月至2015年12月首都医科大学附属北京朝阳医院泌尿科共有26例行LRC的患者在术前2~4周内行单次动脉灌注化疗(吉西他滨+顺铂)。其中,男性22(84.6%)例,女性4(15.4%)例,年龄55~71岁,平均年龄60岁。体质量指数为(25.2±3.12)kg/m2,平均麻醉评分为2分(1~3分),年龄相关的Charlson合并症指数[9]评分为4分(3~7分),东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为1分。26例患者中既往高血压者12例(46.2%),糖尿病者4例(15.4%),吸烟者15例(57.7%)。
1.2 术前病理
术前肿瘤活检病理或影像学资料诊断为肌层浸润性或高危的非肌层浸润性膀胱尿路上皮癌分期: cT1N0M0为1例,cT2aN0M0为6例,cT2bN0M0为4例,cT3aN0M0为4例,cT3aN1M0为1例,cT3bN0M0为6例,cT3bN1M0为1例,cT4aN0M0为2例,cT4aN1M0为1例。
1.3 治疗方法及化疗后血液学检查
26例患者均在局部麻醉下采用Seldinger技术穿刺右股动脉,在导丝引导下将Cobra导管置入髂内动脉灌注顺铂(70 mg/m2)和吉西他滨(1 000 mg/m2),根据计算的患者肌酐清除率情况将化疗药物灌注剂量调整为70%~100%。患者化疗后术前复查血液学检查均值:血红蛋白134 g/L(88~158 g/L),红细胞压积38.7%(27.1%~47.1%),白细胞6.5×109/L(3.38~11.3×109/L),血小板220×109/L(141~362×109/L),肌酐79.9 μmol/L(53~127.3 μmol/L),尿素氮5.9 mmol/L(3.81~9.58 mmol/L),白蛋白35 g/L(24.6~42.7 g/L)。
1.4 统计学方法
应用 SPSS 19.0 (SPSS Inc, Chicago, IL, USA)软件对数据进行分析。采用Wilcoxon配对秩和检验比较26例患者手术前后的病理分期情况。根据癌症级别将26例患者分为低级别组和高级别组,采用Kaplan-Meier生存分析中的Log-rank检验比较两组患者生存率并绘制两组患者的总体生存曲线和疾病特异性生存曲线。采用Fisher精确检验和Mann-WhitneyU检验比较两组患者的术后合并症情况。以P<0.05为差异具有统计学意义。
2 结果
2.1 围术期一般资料
26例患者动脉灌注化疗后2~4周内行LRC,回肠膀胱9例(34.6%),原位回肠新膀胱15例(57.7%),输尿管皮肤造口2例(7.7%),无中转开放。平均手术时间373 min(210~600 min),平均术中出血量为407 mL(100~1 400 mL)。7例(26.9%)围术期有输悬浮红细胞或新鲜血浆,2例(7.7%)术后入重症监护室。术后肠道功能恢复平均时间4.8 d(1~18 d),引流管拔除平均时间12.4 d(5~28 d)。
2.2 术后病理比较
术后病理提示均为尿路上皮癌,其中3例伴鳞样分化,2例伴腺样分化,4例伴原位癌,6例低级别,20例高级别,切缘均未见肿瘤。有7例患者的肿瘤临床分期与病理分期相符[采用2002年世界卫生组织(World Health Organization, WHO) TNM分期标准],包括1例T1, 2例T2a,1例T2b,2例T3a和1例T3b;降期17例,包括4例T2a降为T1,1例T2b降为T1,1例T2b降为T2a,1例T3a降为T1,1例T3a降为T2a,2例T3b降为T1,1例T3b降为T2a,1例T3b降为T2b,2例T3b降为T3a,1例T4a降为T3a,2例T4a降为T3b;升期2例,包括1例T3a升为T4a和1例T2b升为T3a。对手术前后的病理分期结果进行配对秩和检验(Wilcoxon Signed Ranks Test),发现其差异具有统计学意义(Z=-3.157,P=0.002),详见表1,可见动脉灌注化疗局部降期效果显著。平均淋巴结清扫数目17个(8~28个),8例患者淋巴结阳性,阳性数目为12个。
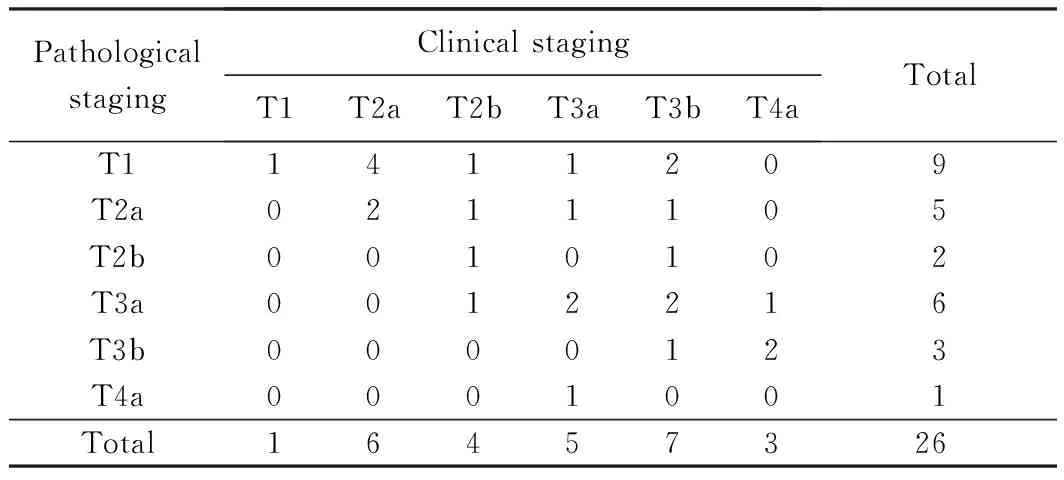
表1 手术前后病理分期Tab.1 Pathological staging before and after surgery
Wilcoxon Signed Ranks Test,Z=-3.157,P=0.002。
2.3 术后合并症
根据Clavien-Dindo分级系统对术后合并症进行评估[10]:术后30 d内合并症,2级21例(80.8%),3级3例(11.5%),病理级别可见低级别6例,高级别18例,对此进行分析显示低级别和高级别肿瘤之间术后合并症差异无统计学意义(P=0.081,图1);术后30至90 d内的短期合并症,2级1例(3.8%),3级1例(3.8%),该2例病理为高级别;术后超过90 d的长期合并症3级1例(3.8%),4级1例(3.8%),该2例病例为高级别。
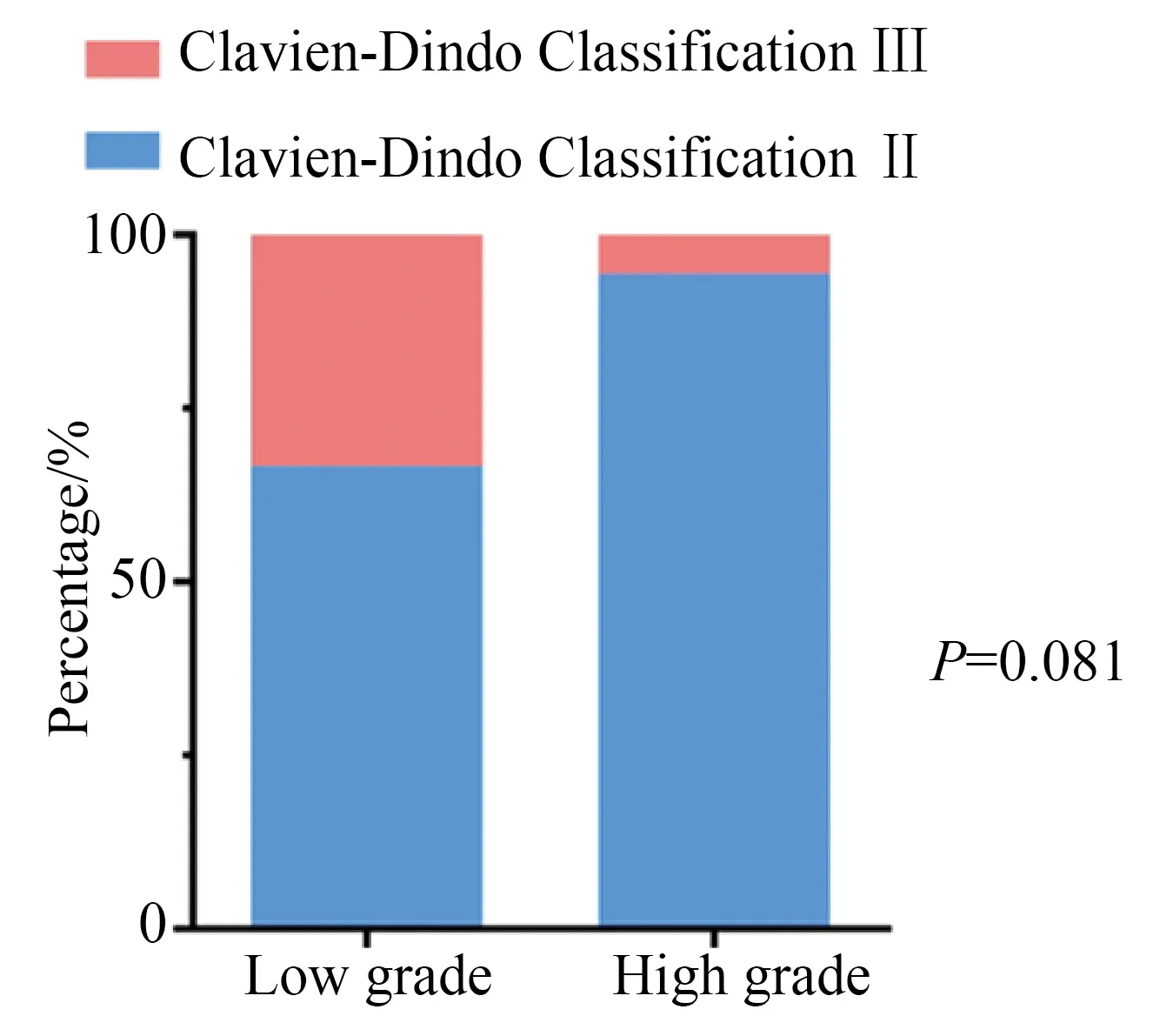
图1 术后30 d内合并症情况构成比分析Fig.1 Analysis of the 30 days postoperative complicationsratio between high-grade and low-grade tumor
2.4 术后随访
26例患者平均随访时间88个月(2~121个月),有3例患者死亡,其中2例分别于术后11和31个月因肿瘤扩散死亡,1例于术后2个月因肠梗阻拒绝手术治疗死亡。总生存率和肿瘤特异性生存率见图2。将患者分为病理高级别组和低级别组进行生存率比较,总生存率(P=0.746)和肿瘤特异性生存率(P=0.446)差异均无统计学意义(图3)。
3 讨论
全球范围内膀胱癌每年的新发病例数约为430 000,主要病理类型为尿路上皮癌[11]。大约70%的新发病例为非肌层浸润性膀胱癌,5年的总生存率为90%,而剩余的20%~40%的患者为MIBC或者进展性(T4b、或者N1-3、或者M1)肿瘤,一旦发生远处转移,5年总生存率仅为6%[1-2]。因此,积极的治疗MIBC患者是避免远处转移和提高生存率的关键时机。
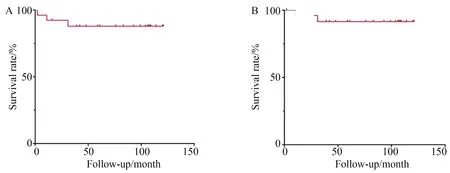
图2 动脉灌注化疗总生存率和肿瘤特异性生存率Fig.2 Overall survival and cancer-specific survival in intra-arterial chemotherapy group
A:overall survival in intra-arterial chemotherapy group;B:cancer-specific survival in intra-arterial chemotherapy group.
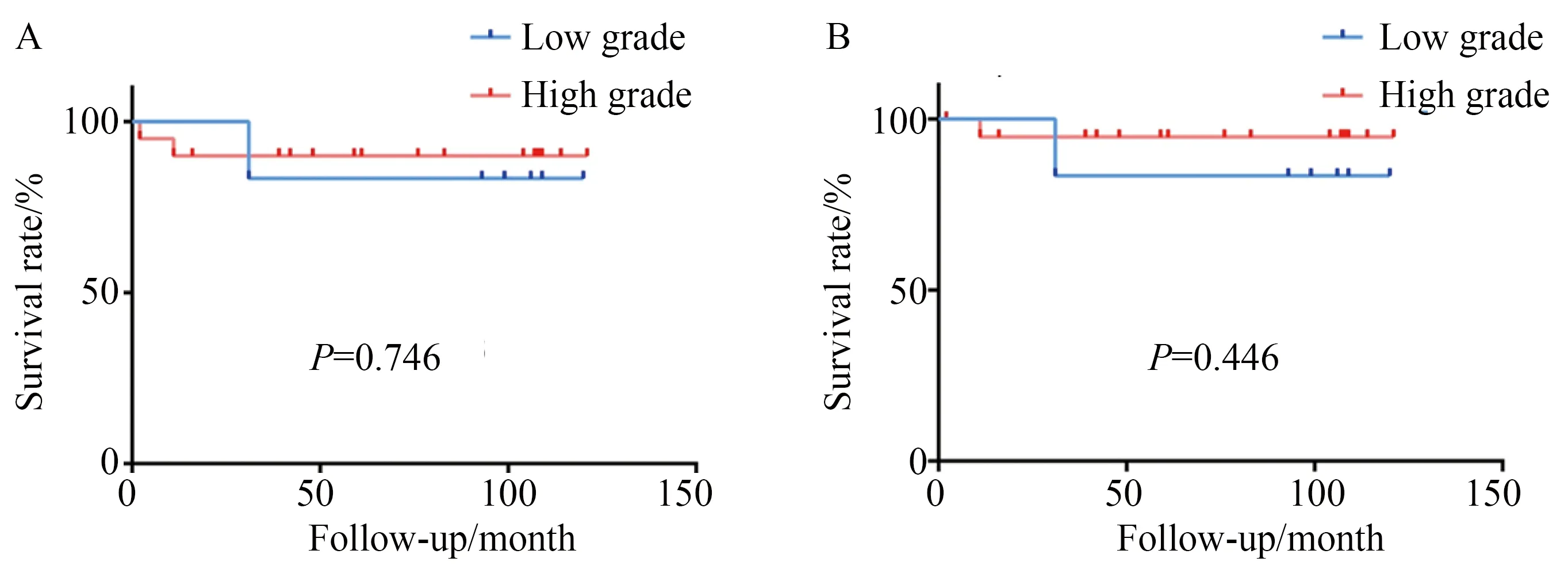
图3 动脉灌注化疗中高级别和低级别肿瘤之间的总生存率和肿瘤特异性生存率比较Fig.3 Comparison of overall survival and cancer-specific survival between high-grade and low-grade tumor
A:overall survival in intra-arterial chemotherapy group;B:cancer-specific survival in intra-arterial chemotherapy group.
尽管先后有MVAC方案(甲氨蝶呤+长春碱+阿霉素+顺铂),GC方案(吉西他滨+顺铂)和剂量密集的MVAC方案(dose-dense MVAC)确定为术后的一线辅助化疗,但是中位的总生存时间也仅为12~15个月,其中约10%~20%的患者能达到长期存活,主要为 ECOG评分较好(0~1)和没有内脏转移的患者[12-16]。
动脉灌注化疗的特点是可以显著提高膀胱及其周围盆腔区域的药物浓度。Collins[17]使用同等剂量的顺铂对比静脉化疗和动脉化疗的局部药物浓度,发现后者在瘤体内的药物浓度是前者的1.4至5.0倍。Mitsuzane等[18]报道如果动脉灌注化疗的同时用导管球囊堵塞肿瘤供应血管,则肿瘤部位的药物浓度将超过6倍。高浓度的顺铂除了直接诱导肿瘤细胞死亡,有研究[19]指出动脉灌注化疗造成的局部区域严重缺氧可显著提高顺铂的抗癌效果。本研究中,有17例(65.4%)患者最终病理分期较临床分期下降,对手术前后的病理分期结果进行比较,其差异具有统计学意义(P=0.002),动脉灌注化疗的局部降期效果显著,但没有pT0病例。Maatman等[20]对25例患者进行平均2次的术前动脉灌注化疗,有6例完全缓解,其中16例根治患者中有3例术后病理为T0N0M0。本研究中没有pT0可能是因为仅单次动脉灌注化疗,是否根据化疗治疗效果增加根治术前灌注次数,还需要大样本随机临床试验进一步验证。
术前新辅助化疗并不会影响手术的可行性和安全性。Grossman等[4]研究显示术前MVAC方案不会影响患者的手术机会,而且相对于没有新辅助化疗的患者,手术合并症的发生率也没有明显增加。同样,动脉灌注化疗后的毒性反应对围术期恢复以及术后长期合并症方面的影响也并不明显。牛亦农等[21]对19例局部晚期膀胱癌患者进行术前动脉灌注新辅助GC方案化疗,结果显示患者耐受性好,未对化疗后手术治疗造成不良影响。本研究中术后合并症共28人次,其中术后30 d内的早期合并症发生率最高(24人次,92.3%),这明显高于文献报道的30%~67%[22]。仔细分析上述数据可见2级合并症占80.8%(21/26),这其中14例(53.8%)因为给予术后肠外营养而定义为2级合并症,事实上很大一部分患者并不需要术后肠外营养,既往传统模式的术后康复正在逐渐被改变。同时,将以上合并症依据术后病理低级别和高级别肿瘤进行分类,两者之间差异无统计学意义(P=0.081),术后30 d之后的4人次合并症均为高级别膀胱癌。术后30 d内、30~90 d内以及超过90 d Clavien 3级以上合并症分别为3例(11.5%),1例(3.8%)和2例(7.6%),并没有明显增加术后合并症发生率,动脉灌注化疗对手术的安全性没有显著影响。
尽管本研究平均随访时间超过7年,但作为回顾性研究的病例数较少,术后随访过程中无法准确提供肿瘤复发方面的数据,仅能以总生存率和肿瘤特异性生存率作为预后指标,这一结果并不能提供令人信服的数据;此外,本研究根据患者肌酐清除率情况调整药物剂量,早期多采用100%剂量,后期的患者多采用70%的剂量,这主要考虑到术前化疗不良反应可能会延迟手术实施时间,非统一的化疗剂量对预后的影响可能干扰对预后的判断。尽管如此,本研究得出LRC术前进行单侧动脉灌注化疗并没有明显增加围术期合并症,同时起到显著地降期降级作用,但在肿瘤学预后方面还需要随机对照研究进行评估,同时辅助膀胱癌根治术的多模式治疗方案仍需进一步探索。
[1] Kamat A M, Hahn N M, Efstathiou J A, et al. Bladder cancer[J]. Lancet,2016,388:2796-2810.
[2] Marcos-Gragera R, Mallone S, Kiemeney L A, et al. Urinary tract cancer survival in europe 1999-2007: results of the population-based study EUROCARE-5[J]. Eur J Cancer, 2015, 51(15): 2217-2230.
[3] Zehnder P, Studer U E, Skinner E C, et al. Unaltered oncological outcomes of radical cystectomy with extended lymphadenectomy over three decades[J]. BJU Int, 2013,112(2):E51-58.
[4] Grossman H B, Natale R B, Tangen C M, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer[J]. N Engl J Med, 2003,349(9):859-866.
[5] International Collaboration of Trialists, Medical research council advanced bladder cancer working party (now the National Cancer Research Institute Bladder Cancer Studies group), European Organisation for Research and Treatment of Cancer Genito-Urinary Tract Cancer Group, et al. International phase Ⅲ trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial[J]. J Clin Oncol, 2011,29(16):2171-2177.
[6] Advanced Bladder Cancer Meta-analysis Collaboration.Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and Meta-analysis of individual patient data advanced bladder cancer (ABC) Meta-analysis collaboration[J]. Eur Urol, 2005,48(2):202-205; discussion 5-6.
[7] Reardon Z D, Patel S G, Zaid H B, et al. Trends in the use of perioperative chemotherapy for localized and locally advanced muscle-invasive bladder cancer: a sign of changing tides[J]. Eur Urol, 2015,67(1):165-170.
[8] Shah J B, McConkey D J, Dinney C P. New strategies in muscle-invasive bladder cancer: on the road to personalized medicine[J]. Clin Cancer Res, 2011,17(9):2608-2612.
[9] Koppie T M, Serio A M, Vickers A J, et al. Age-adjusted Charlson comorbidity score is associated with treatment decisions and clinical outcomes for patients undergoing radical cystectomy for bladder cancer[J]. Cancer, 2008,112(11):2384-2392.
[10] Nogueira L, Katz D, Pinochet R, et al. Critical evaluation of perioperative complications in laparoscopic partial nephrectomy[J]. Urology, 2010,75(2):288-294.
[11] Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[12] Saxman S B, Propert K J, Einhorn L H, et al.Long-term follow-up of a phase Ⅲ intergroup study of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study[J]. J Clin Oncol, 1997,15(7):2564-2569.
[13] von der Maase H, Sengelov L, Roberts J T, et al.Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer[J]. J Clin Oncol, 2005,23(21):4602-4608.
[14] Sternberg C N, de Mulder P, Schornagel J H, et al. Seven year update of an EORTC phase Ⅲ trial of high-dose intensity M-VAC chemotherapy and G-CSF versus classic M-VAC in advanced urothelial tract tumours[J]. Eur J Cancer, 2006,42(1):50-54.
[15] Bajorin D F, Dodd P M, Mazumdar M, et al.Long-term survival in metastatic transitional-cell carcinoma and prognostic factors predicting outcome of therapy[J]. J Clin Oncol, 1999,17(10):3173-3181.
[16] Apolo A B, Ostrovnaya I, Halabi S, et al. Prognostic model for predicting survival of patients with metastatic urothelial cancer treated with cisplatin-based chemotherapy[J]. J Natl Cancer Inst, 2013,105(7):499-503.
[17] Collins J M. Cancer chemotherapy, challenges for the future[J]. Excepta Medica, 1989,4:3-10.
[18] Mitsuzane K, Terada M, Nomura S, et al. Balloon-occluded arterial infusion as chemotherapy in bladder cancer-long-term results. Gan To Kagaku Ryoho, 1990,17(8Pt2):1701-1704.
[19] Abbott D W, Freeman M L, Holt J T. Double-strand break repair deficiency and radiation sensitivity in BRCA2 mutant cancer cells[J]. J Natl Cancer Inst, 1998,90(13):978-985.
[20] Maatman T J, Montie J E, Bukowski R M, et al.Intra-arterial chemotherapy as an adjuvant to surgery in transitional cell carcinoma of the bladder[J]. J Urol, 1986,135(2):256-260.
[21] 牛亦农,闫勇,张军晖,等. 局部晚期膀胱癌术前动脉灌注新辅助化疗的安全性与疗效分析[J]. 中华泌尿外科杂志, 2009,30(10):681-684.
[22] Shabsigh A, Korets R, Vora K C, et al. Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology[J]. Eur Urol, 2009,55(1):164-174.

