高脂饲料中添加丙硫氧嘧啶对大鼠血脂、体质量及体脂的影响
郝维佳 杨秋实 李静宜, 2 马 毅 陆 莉 熊 杰 李宇航 徐平湘 陈 怡 薛 明 李晓蓉*
(1.首都医科大学基础医学院药理学系,北京 100069;2.首都医科大学附属北京友谊医院 北京热带医学研究所 热带病防治研究北京市重点实验室,北京 100050)
高脂血症是导致动脉粥样硬化、脑卒中、冠状动脉粥样硬化性心脏病(以下简称冠心病)、心肌梗死的独立危险因素,也是促进高血压、糖尿病、脂肪肝等的重要危险因素。多年来,高脂血症病因、病理机制以及药物开发始终是研究的热点。而理想的高脂血症动物模型是这些研究工作成功的基石,制备高脂血症动物模型有多种方法,其中最常用的方法是使用提高了能量和脂质含量的高脂饲料,如加入植物油脂、动物油脂、胆固醇等,诱发动物高脂模型。此法简单易行,成本低廉,对动物损伤小,应用非常广泛。但是饮食诱发的高脂模型常常需要数月时间,制作周期长,且有时血脂升高程度不理想,因此在制作模型时研究者常会加入抗甲状腺药物——丙硫氧嘧啶作为工具药,大幅度缩短成模时间和提高血脂浓度,因而添加丙硫氧嘧啶是常用的建模策略[1-2]。笔者曾对2011-2015年发表的使用高脂饲料的中文文献进行了统计,其中使用丙硫氧嘧啶作为添加剂的文献约占13%,说明国内使用这一方法的研究者较多[3]。但是作为抗甲状腺药,丙硫氧嘧啶协助升高血脂的同时带来甲状腺功能抑制的其他伴随症状,例如体质量下降、体脂降低、体质下降以及脂质代谢酶活性改变等,可能对合理分析高脂血症的病理机制,以及对调脂药物的药效和作用机制的评价产生影响,尤其是体质量、体脂等方面的影响非常容易被忽略,目前关于这方面的研究报道还比较少,本研究将系统探讨丙硫氧嘧啶对饮食诱导的高脂模型大鼠的血脂及动物采食量、体质量和体脂的影响。
1 材料与方法
1.1 实验动物
SD大鼠32只,雄性,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。
1.2 实验药品和仪器
丙硫氧嘧啶(纯度>99%)(国药集团化学试剂有限公司,批号:20140326)。全自动生化分析仪(美国Dade Behring 公司),光学显微镜(日本Olympus公司 BX41),免疫分析仪(美国贝克曼公司DX1800),万分之一电子天平(北京赛多利斯科学仪器有限公司),2D5-2A型低速离心机(北京医用离心机厂),Vortex-Genie2涡旋混合器(美国Scientific Industries公司)。K-Viewer数字病理解决方案软件(宁波江丰生物信息技术有限公司)。
1.3 动物分组及方法
所有动物适应性饲养2 d后,采用数字表法随机分为4组[4],分别为正常饲料组(control,Con)、正常饲料+丙硫氧嘧啶组(control+propylthiouracil,Con+PTU)、高脂饲料组(high fat diet,HFD)、高脂饲料+丙硫氧嘧啶组(high fat diet+propylthiouracil,HFD+PTU)。正常饲料为啮齿类动物正常维持料,高脂饲料为基础饲料中添加10%(质量分数)猪油、2%(质量分数)胆固醇、0.3%(质量分数)胆盐构成。PTU剂量为 50 mg·kg-1·d-1,每日灌胃1次,连续4周。实验过程中每日测量动物体质量,并记录采食量,实验结束日采用10%(质量分数)水合氯醛麻醉后准确测量大鼠从鼻尖至肛门的长度即体长,并根据公式Lee’s 指数=体质量(g)1/3×103/体长(cm)计算Lee’s 指数[5-7],腹主动脉插管取血,静置1 h,4 000 r/min,离心10 min,取血浆检测血脂4项、血糖、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和门冬氨酸氨基转移酶(aspartate aminotransferase,AST),血浆三碘甲状腺原氨酸(triiodothyronine,T3)、甲状腺素(tetraiodothyrenine, T4)、游离T3(free T3, FT3)及游离T4(free T4, FT4)浓度,并且取肝脏、肾周脂肪和睾周脂肪,称质量计算肝系数和脂肪系数,多聚甲醛固定肝脏和脂肪组织,肝脏进行HE和油红O染色,脂肪组织进行HE染色[8]。Image J软件测量脂肪细胞面积(400×),每份标本测量10个视野[9-10]。
1.4 统计学方法
检测数据采用SPSS 20.0软件,应用析因设计方法对测量值进行分析,采用SPSS中的General Linear ModelUnivariate模块进行分析。动物体质量和采食量数据采用重复测量数据的方差分析,使用SPSS中General Linear ModelRepeated Measurement模块进行分析,两两比较用LSD法。以P<0.05为差异有统计学意义
2 结果
2.1 高脂饲料和丙硫氧嘧啶对大鼠血脂的影响
高脂饲料和丙硫氧嘧啶对大鼠血脂的影响结果详见表1,正常饲料组血浆总胆固醇(total cholesterol, TC)为(1.51±0.29)mmol/L,HFD和PTU均具有升高血浆TC的作用(P<0.01),HFD与PTU合用后血浆TC浓度更进一步显著升高,较单用HFD或PTU升高数倍,析因分析表明HFD和PTU之间的交互效应具有统计学意义(P<0.001),结合数据表明HFD和PTU有协同升高TC的作用。低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)的变化趋势与总胆固醇的变化趋势一致,HFD和PTU均具有升高LDL-C浓度的作用,二者合用进一步显著升高LDL-C浓度,HFD和PTU的交互效应具有统计学意义(P<0.001),说明添加PTU可加强高脂饲料诱导升高血浆LDL-C浓度的作用。给予HFD后血浆高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C) 浓度下降(P<0.05),此特点与临床常见的高脂血症中血脂变化特征相似,而给予PTU后血浆HDL-C浓度升高,这一特征与高脂饲料引起的变化趋势不一致,造成动物模型中HDL-C浓度表现复杂多变,与临床血脂变化常常不统一。各组之间的三酰甘油(triglycerides,TG)浓度差异无统计学意义。总之,从上述实验数据可以看出,高脂饲料中添加PTU,可协同升高血浆中TC和LDL-C浓度,使动物造模速度和幅度均提高。
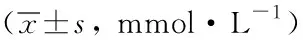
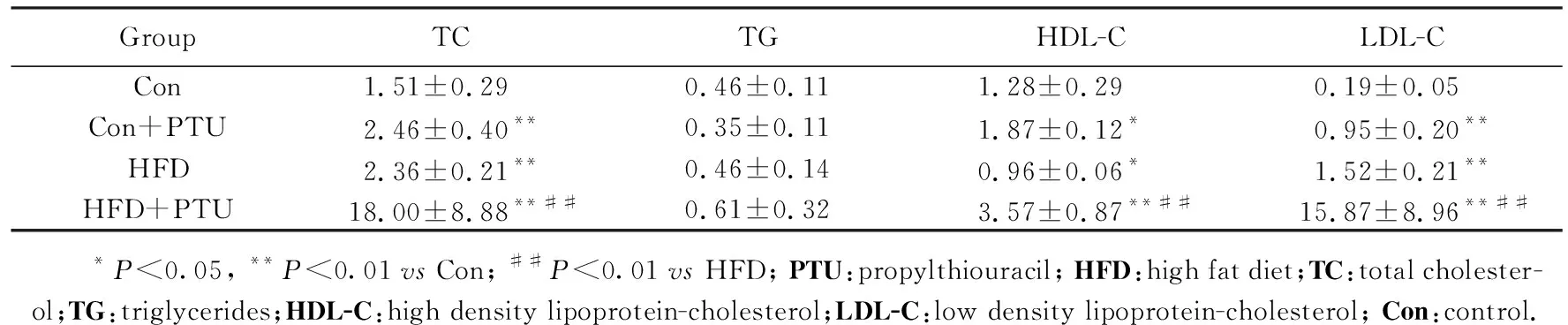
GroupTCTGHDL-CLDL-CCon1.51±0.29 0.46±0.111.28±0.29 0.19±0.05 Con+PTU2.46±0.40**0.35±0.111.87±0.12*0.95±0.20**HFD2.36±0.21**0.46±0.140.96±0.06*1.52±0.21**HFD+PTU18.00±8.88**##0.61±0.323.57±0.87**##15.87±8.96**## *P<0.05, **P<0.01 vs Con; ##P<0.01 vs HFD; PTU:propylthiouracil; HFD:high fat diet;TC:total cholester-ol;TG:triglycerides;HDL-C:high density lipoprotein-cholesterol;LDL-C:low density lipoprotein-cholesterol; Con:control.
2.2 高脂饲料和丙硫氧嘧啶对大鼠血浆转氨酶和血糖的影响
如表2所示,各组之间的ALT和AST浓度差异无统计学意义,单独给予HFD或与PTU合用诱导1个月并没有造成血浆转氨酶浓度显著升高,提示诱导1个月并未造成明显的肝细胞损伤。血糖检测结果表明,仅给予PTU组血糖浓度下降,而HFD和HFD+PTU组的血糖浓度与正常组相当。
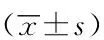
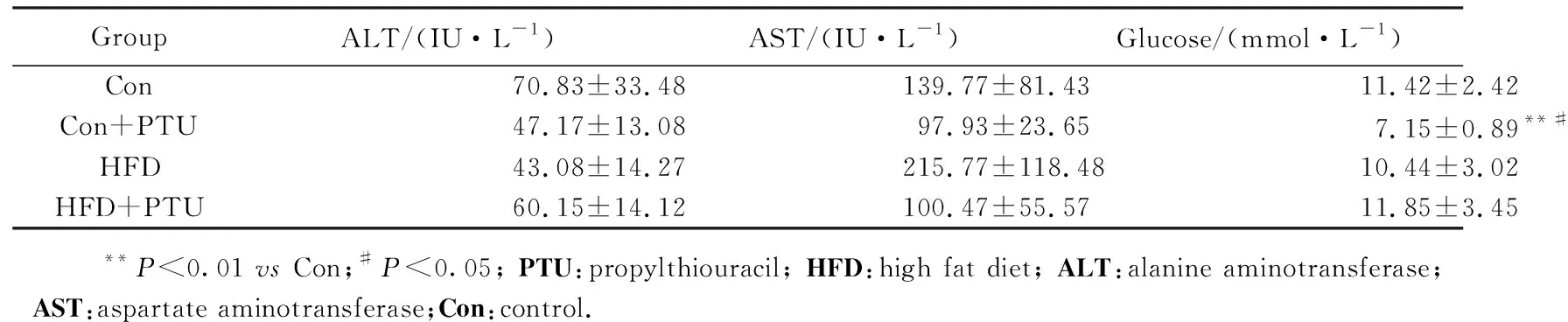
GroupALT/(IU·L-1)AST/(IU·L-1)Glucose/(mmol·L-1)Con70.83±33.48139.77±81.4311.42±2.42Con+PTU47.17±13.0897.93±23.657.15±0.89**#HFD43.08±14.27215.77±118.4810.44±3.02HFD+PTU60.15±14.12100.47±55.5711.85±3.45 **P<0.01 vs Con;#P<0.05; PTU:propylthiouracil; HFD:high fat diet; ALT:alanine aminotransferase;AST:aspartate aminotransferase;Con:control.
2.3 高脂饲料和丙硫氧嘧啶对大鼠甲状腺功能的影响
从表3可看出,单独给予HFD对血浆T3、T4、FT3、FT4浓度没有影响,而PTU可使甲状腺素浓度下降尤其是T3、T4浓度(P<0.01),析因分析表明HFD和PTU之间无交互作用。
2.4 高脂饲料和丙硫氧嘧啶对大鼠体质量及采食量的影响
对各组大鼠体质量数据应用重复测量数据方差分析显示, 时间因素有统计学意义(P<0.001), 说明动物体质量有随时间变化的趋势;但时间和饲料的交互作用没有统计学意义, 说明时间因素的作用不随着饲料的不同而不同,时间和PTU分组的交互作用具有统计学意义(P<0.001), 说明时间因素的作用随着是否加入PTU的不同而不同。组间变异计算结果显示,HFD处理因素无统计学意义,PTU处理因素具有统计学意义(P<0.001),提示PTU的有或无可造成动物体质量的不同。实验的最初几天动物体质量匀速上升,且各组体质量增长趋势相同,大约到第10天左右时,动物体质量增长趋势分化为含PTU和不含PTU两类,不含PTU组动物体质量依然保持原有增长速度,含有PTU组动物体质量不再继续增长,而是基本维持不变,继而略有下降。在第10天时Con与Con+PTU组的体质量差异有统计学意义,第13天HFD与HFD+PTU组差异有统计学意义,这些差异越来越显著,一直持续到实验结束(图1)。
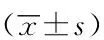

GroupT3/(ng·dL-1)T4/(ng·mL-1)FT3/(pg·mL-1)FT4/(ng·dL-1)Con68.72±8.22 50.89±8.60 1.94±0.30 1.66±0.23 Con+PTU23.59±20.62**##18.04±4.14**##0.72±1.591.08±0.35HFD56.21±6.7845.23±7.281.83±0.171.29±0.17HFD+PTU15.58±10.07**##14.94±8.17**##0.12±0.29*#0.56±0.49** *P<0.05, **P<0.01 vs Con;#P<0.05, ##P<0.01 vs HFD; PTU:propylthiouracil; HFD:high fat di-et; T3:triiodothyronine;T4:tetraiodothyronine;FT3:free T3;FT4:free T4;Con:control.
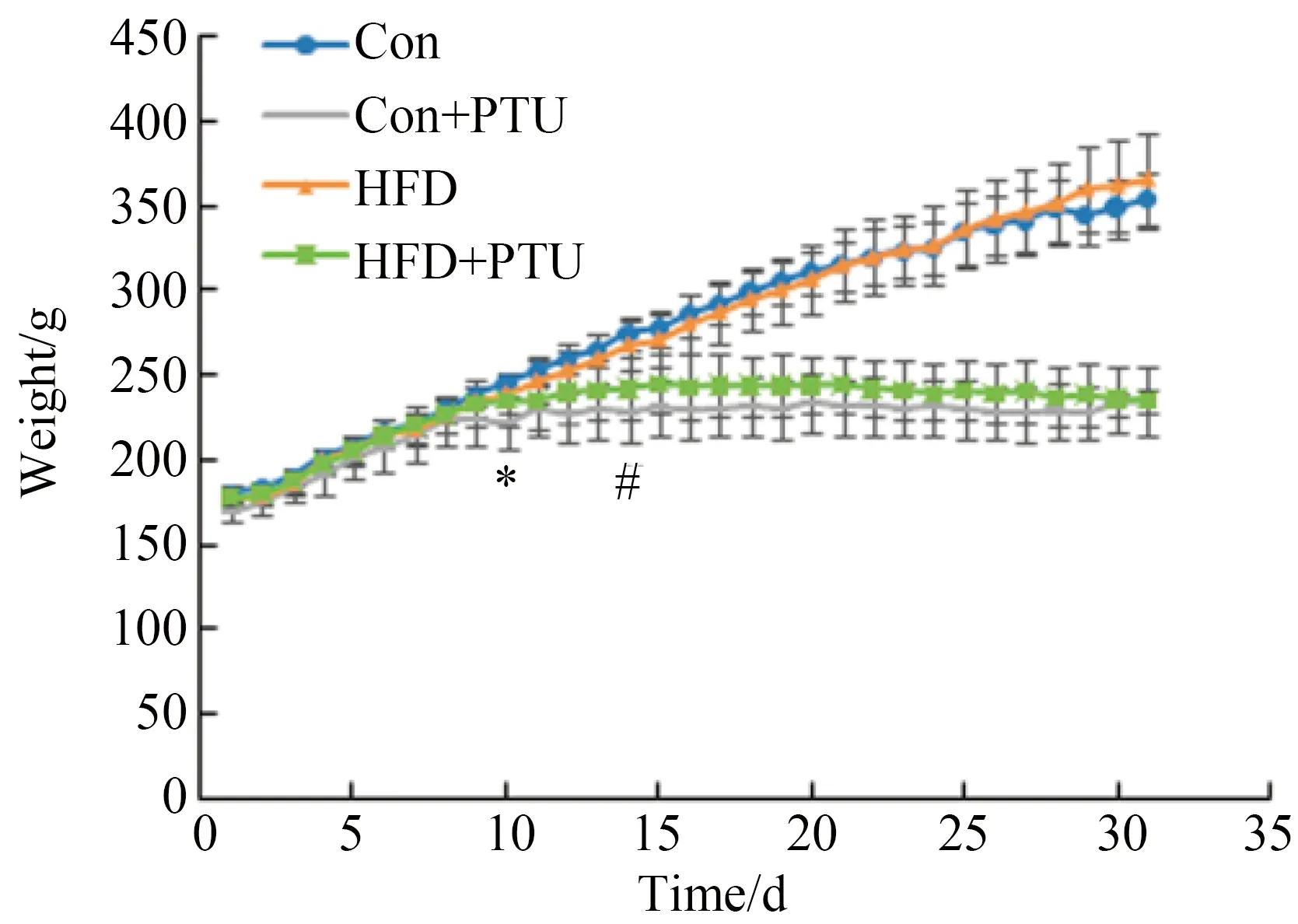
图1 丙硫氧嘧啶和高脂饲料对大鼠体质量的影响Fig.1 Effects of PTU and HFD on body weightof rats(n=8)
*P<0.05,Con+PTUvsCon;#P<0.05,HFD+PTUvsHFD;Con:control;PTU:propylthiouracil;HFD:high fat diet.
对采食量的分析表明,时间因素有统计学意义(P<0.001), 说明动物采食量有随时间变化的趋势;时间和饲料分组的交互作用(P<0.01)以及时间和PTU分组的交互作用(P<0.001)均具有统计学意义, 说明动物采食量随时间的变化趋势与是否使用高脂饲料和是否加入PTU的不同而不同。组间变异结果显示,HFD和PTU处理因素的差异均具有统计学意义(P<0.001),提示饲喂高脂饲料或加入PTU可对动物的采食量产生显著影响。各组动物的采食量在最初5 d左右基本相同,围绕20 g/d左右上下波动,Con组和Con+PTU在第5 d,HFD和HFD+PTU组于第8 d差异出现统计学意义(P<0.05),含PTU的组动物采食量均低于相应不含PTU的实验组。第6~30天,HFD组采食量低于Con组,第8~30天,HFD+PTU采食量低于Con+PTU组,高脂饲料为基础的组的采食量低于不含高脂饲料组(图2)。结合体质量和采食量结果可知采食量下降几天后,体质量出现下降[11]。
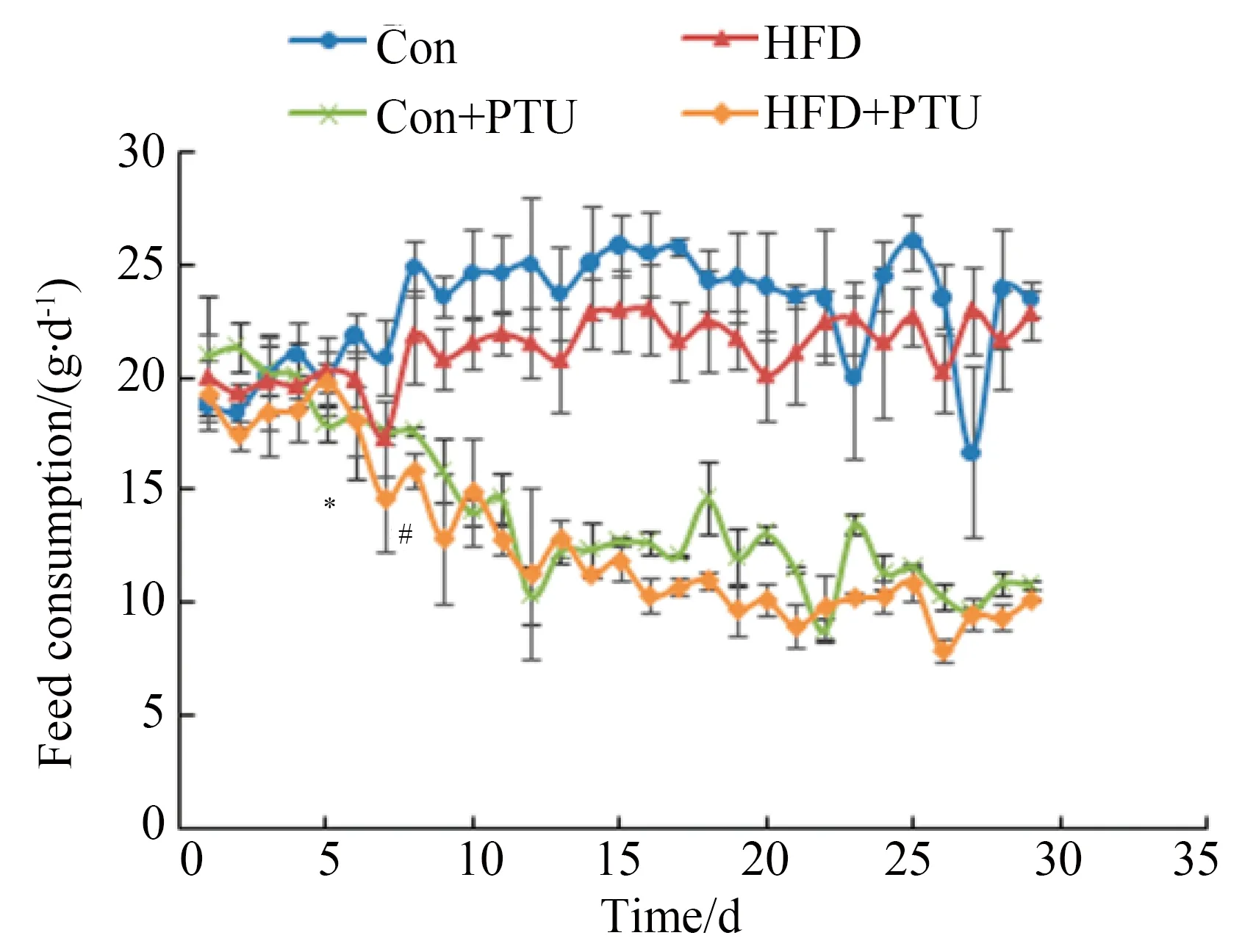
图2 丙硫氧嘧啶和高脂饲料对大鼠采食量的影响Fig.2 Effects of PTU and HFD on feed consumptionof rats(n=8)
*P<0.05,Con+PTUvsCon;#P<0.05,HFD+PTUvsHFD;Con:control;PTU:propylthiouracil;HFD:high fat diet.
2.5 高脂饲料和丙硫氧嘧啶对大鼠Lee’s指数、肝系数及肾周脂肪和睾周脂肪的影响
各组之间Lee’s指数差异没有统计学意义,但是含有PTU组的均数低于不含PTU组,析因分析表明,PTU主效应差异具有统计学意义(P<0.01),HFD效应差异无统计学意义,二者之间也不存在交互效应(图3A)。表明PTU可引起动物以体长为标准的体质量降低,动物消瘦。
以高脂饲料为基础的两个组的肝系数均比相应的两个正常饲料组显著升高,析因分析表明高脂饲料是影响肝系数的重要因素(P<0.01)。在正常饲料的基础上加入PTU可使肝系数显著降低,而在高脂饲料的基础上加入PTU后肝系数显著升高(图3B),此结果表明PTU本身并不造成肝系数升高或肝损伤,但是PTU与高脂饲料合用后,可加强高脂饲料提高肝系数造成肝损伤的作用。结合前文血脂的数据,可看出PTU与HFD合用后,协同升高血浆TC、LDL-C和肝系数,提高高脂饲料升高血脂及对肝脏造成的损伤。
对于脂肪组织的分析结果表明,对于脂肪组织,高脂饲料可显著提高睾周脂肪系数(图3C),但是对肾周脂肪系数(图3D)没有升高作用。无论是正常饲料还是高脂饲料加入PTU后,肾周和睾周脂肪组织的重量均显著减轻,析因分析结果也表明,PTU对肾周和睾周脂肪的影响具有统计学意义,是影响脂肪系数的重要因素(P<0.01)。
图3 丙硫氧嘧啶和高脂饲料对大鼠Lee’s指数、肝系数及脂肪系数的影响Fig.3 Effects of PTU and HFD on the Lee’s index, liver index, adipose index of
**P<0.01;A:Lee’s index;B:liver index;C:epididymal adipose index;D: perirenal adipose index;Con:control;PTU:propylthiouracil;HFD:high fat diet.
2.6 高脂饲料和丙硫氧嘧啶对高脂血症大鼠肝组织病理学的影响
肝脏组织油红O染色的病理检查结果显示:肝细胞核为蓝色,脂滴为橘红色。正常组肝索排列整齐,肝小叶结构正常,肝细胞以中央静脉为中心单行排列成板状结构,肝细胞形态、大小正常,胞质丰富,胞质内没有橘红色脂质颗粒(图4A)。正常饲料+PTU组肝细胞形态略小,细胞内有少量脂质沉积,肝索结构正常(图4B)。高脂饲料组肝细胞增大胞质内有大量红染脂滴,部分肝索结构紊乱,局部肝细胞溶解坏死(图4C)。高脂饲料+PTU组肝细胞内也有大量的脂质沉积,肝细胞点状坏死(图4D)。
2.7 高脂饲料和丙硫氧嘧啶对大鼠脂肪细胞大小的影响
Image J测量脂肪细胞面积显示,正常饲料组脂肪细胞饱满,结构清晰,高脂饲料组的脂肪细胞面积比正常饲料组面积增大,但是差异无统计学意义,给予PTU后,脂肪细胞面积显著小于相应的无PTU饲料组,即正常饲料+PTU<正常饲料组,高脂饲料+PTU<高脂饲料组,并且高脂饲料+PTU组>大于正常饲料+PTU组(P<0.01)(图5A、B)。析因分析表明HFD和PTU对脂肪细胞面积的影响均具有统计学意义,两因素间没有交互作用,表明两个因素均对脂肪细胞面积具有独立显著影响。
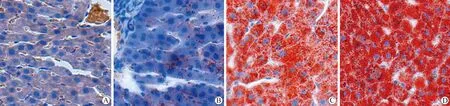
图4 丙硫氧嘧啶和高脂饲料对大鼠肝脏组织病理学影响Fig.4 Effects of HFD and PTU on liver histopathological changes of rats (oil red staining, 200×)
**P<0.01;A:Con;B:Con+PTU;C:HFD;D:HFD+PTU;Con:control;HFD:high fat diet;PTU:propylthiouracil.
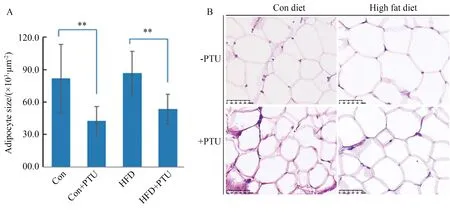
图5 高脂饲料和丙硫氧嘧啶对大鼠脂肪细胞大小的影响Fig.5 Effects of HFD and PTU on adipocytes size of rats(HE staining, 400×)**P<0.01;Con:control; HFD:high fat diet; PTU:propylthiouracil.
3 讨论
血脂异常在人群中很常见,可表现为高胆固醇血症、高三酰甘油(triglyceride, TG)血症、低HDL-C和混合型高脂血症4种类型,其中以LDL-C升高为主要表现的高胆固醇血症是动脉粥样硬化性心血管病的最重要危险因素,控制血浆总胆固醇和LDL-C是冠心病的一级预防和二级预防中的重要任务。数十年来,我国居民血脂异常的流行趋势日趋严重,高胆固醇血症发病率逐年上升,控制高胆固醇血症的形势还相当严峻,研究开发优秀的降血脂药依然是药理学工作者的重任。构建合适的高脂血症动物模型是降脂研究的基石,应用提高胆固醇和饱和脂肪酸含量的高脂饲料诱发高脂血症动物模型是最常用、最方便的方法,但是常规高脂饲料造模需要数月时间,周期较长,且血脂浓度升高程度有限,因此加入抗甲状腺药物加速造模和提高模型血脂浓度是常用策略,PTU是最常用的工具药。本研究的结果也支持这个观点,本研究中在给予SD大鼠高脂饲料的基础上给予PTU能够使血脂在1个月时就非常显著地升高,大大提高了造模的速度和幅度。但是甲状腺是体内重要的代谢调节激素,对糖、脂肪、蛋白质的代谢及交感、副交感神经均具有调节作用,因此抑制甲状腺功能,会在升高血脂的同时带来多种复杂影响,这些作用可能会干扰降脂药物研究过程中药效和作用机制的评价,需要慎重权衡。
首先,抑制甲状腺功能除了影响脂质代谢外还可影响蛋白质和糖的代谢,因此加入PTU实际上是制作了一个复杂代谢障碍的模型,并非是一个单纯的高胆固醇血症模型。单纯高脂饲料诱发的高脂血症模型中血脂四项及血糖常常表现为升高[12-14],加入PTU后血脂的变化以TC和LDL-C升高为主,TG浓度变化小,并且血糖升高不明显甚至表现为下降[15],这些变化特征与单纯高脂饲料引起的血脂变化特征不完全一致,且和临床常见饮食相关的高脂血症患者的血脂谱表现形式也不一致,此模型适于进行高胆固醇血症的研究,不适用于高TG或混合型高脂血症的研究。而且甲状腺功能降低或抑制还和多种对高血脂、高血压、心血管病不利因素有关,如炎性反应、舒张期高血压、高同型半胱氨酸血症、止血异常、肾功能改变、非酒精性脂肪肝、胰岛素抵抗、代谢综合征等[16-19]。
其次,添加PTU在降低代谢率的同时可显著抑制动物食欲,从而引起采食量显著下降,继之体质量持续下降,动物逐渐消瘦、活动减少、毛色发黄干枯、精神不振、对外界刺激反应性下降,本研究中HFD+PTU组的动物采食量、体质量、肾周脂肪、睾周脂肪、Lee’s指数等均低于单纯使用HFD组,并且统计学结果表明针对这些指标,PTU作用具有统计学意义。这些现象总体呈现为血浆胆固醇持续升高,肝脏脂质蓄积,而体脂却持续减少,动物一般情况下降的特征,这与临床高脂血症的特征也不一致,因而在研究中需要慎重权衡。
另外,抑制甲状腺功能还能够影响体内多种代谢脂质的酶和转运体的活性,甲状腺功能下降时,胆汁酸合成的限速酶7a羟化酶活性下降最快、最明显[20],而肝脏、成纤维细胞和其他组织中LDL-C受体的表达明显降低,肝脏摄取LDL-C减少[21-22]。甲状腺功能减退症时促甲状腺激素(thyrotropin,thyroid stimulating hormone,TSH)浓度升高可提高HMG-CoA还原酶活性,加速胆固醇合成[23],而TSH浓度升高还可提高ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)表达,从而加速胆固醇外排过程[24],加速胆固醇从血管内皮、平滑肌等外周细胞转移至HDL-C。将胆固醇酯从HDL-C转移到LDL-C和VLDL-C的胆固醇酯转移蛋白(cholesterol ester transfer protein, CETP)的活性下降[25],抑制了HDL-C和LDL-C、VLDL-C之间的胆固醇酯交换过程,肝脂肪酶和脂蛋白脂肪酶活性下降,抑制脂蛋白中富含TG的脂蛋白的降解和TG从这些脂蛋白转移到HDL-C的速度[26],有研究[27]表明甲状腺激素可提高肝脏HDL-C受体即B类I型清道夫受体(scavenger receptor class-B, type I,SR-BI)的表达,这些过程不利于HDL-C循环利用。因此甲状腺功能减退时表现为胆固醇合成增加、代谢减少、细胞外排胆固醇过程加强,而肝脏摄取胆固醇能力下降,这些变化共同造成血浆胆固醇浓度升高。因而抗甲状腺药物虽然是很好的高脂血症造模工具药,但是进行降脂药物作用机制研究时,它们对多种脂质代谢酶的影响会严重干扰研究者对药物作用机制和作用靶点的分析判断。因此这种模型适用于药物开发临床前研究阶段药物降脂疗效的筛选或初步评价,而不适用于药物作用靶点和作用机制的深入探讨。总之决定是否添加PTU需要根据研究目的和研究方案慎重考虑。
[1] 蔡洁娜,胡志明,张犁,等. 口服脂肪酶对高脂性模型大鼠脂代谢和脂肪肝的影响[J]. 广东医学, 2014,35(7): 989-992.
[2] 吴人照,吴焕淦,寿张根,等. 生物信息反馈红外治疗仪对高血脂大鼠降脂作用的实验研究[J]. 世界中医药, 2016,11(12): 2533-2538.
[3] 郝维佳,李静宜,蒋辉,等. 纯化成分高脂/高糖饲料的优势及国内应用现状[J]. 卫生研究,2017,46(1): 143-147.
[4] 徐勇勇,孙振球.医学统计学[M]. 4版. 北京: 人民卫生出版社, 2015: 571-574.
[5] Lu Y, Li H, Shen S W, et al. Swimming exercise increases serum irisin level and reduces body fat mass in high-fat-diet fed Wistar rats[J]. Lipids Health Dis, 2016, 15: 93-100.
[6] 何明,涂长春,黄起壬,等. Lee’s指数用于评价成年大鼠肥胖程度的探讨[J]. 中国临床药理学与治疗学杂志, 1997,2(3): 177-179.
[7] 董乃相,张书义,梁玉磊,等. 针刺对不同性别单纯性肥胖大鼠Lee’s指数与Leptin含量的影响[J]. 中医学报, 2015,30(6): 846-848.
[8] Van der Heijden R A, Sheedfar F, Morrison M C, et al. High-fat diet induced obesity primes inflammation in adipose tissue prior to liver in C57BL/6j mice[J]. Aging (Albany NY), 2015, 7(4): 256-268.
[9] 曹艳丽,谷剑秋,王涤非,等. 肥胖者脂肪组织中TNF-α表达与脂肪细胞大小的相关性分析[J]. 中国组织化学与细胞化学杂志,2013,22(4): 282-285.
[10] Aoki S, Iwai A, Kawata K, et al. Oral administration of the aureobasidium pullulans-derived β-glucan effectively prevents the development of high fat diet-induced fatty liver in mice[J]. Sci Rep, 2015, 5: 10457-10466.
[11] 常露,赵珍,朱振东,等. 两种高脂饲料分段喂养对大鼠体重和血脂的影响[J]. 昆明医科大学学报, 2015,36(8): 19-22.
[12] Sung Y Y, Kim D S, Choi G, et al. Dohaekseunggi-tang extract inhibits obesity, hyperlipidemia, and hypertension in high-fat diet-induced obese mice[J]. BMC Complement Altern Med, 2014, 14: 372-380.
[13] Han J M, Lee J S, Kim H G, et al. Synergistic effects of Artemisia iwayomogi and Curcuma longa radix on high-fat diet-induced hyperlipidemia in a mouse model[J]. J Ethnopharmacol, 2015, 173: 217-224.
[14] Lee H S, Nam Y, Chung Y H, et al. Beneficial effects of phosphatidylcholine on high-fat diet-induced obesity, hyperlipidemia and fatty liver in mice[J]. Life Sci, 2014, 118(1): 7-14.
[15] Al-Noory A S, Amreen A N, Hymoor S. Antihyperlipidemic effects of ginger extracts in alloxan-induced diabetes and propylthiouracil-induced hypothyroidism in (rats)[J]. Pharmacognosy Res, 2013, 5(3): 157-161.
[16] Pandrc M S, Ristic A, Kostovski V, et al. The effect of early substitution of subclinical hypothyroidism on biochemical blood parameters and the quality of life[J]. J Med Biochem, 2017, 36(2): 127-136.
[17] Hennessey J V, Espaillat R. Subclinical hypothyroidism: a historical view and shifting prevalence[J]. Int J Clin Pract, 2015, 69(7): 771-782.
[18] Pesic M M, Radojkovic D, Antic S, et al. Subclinical hypothyroidism: association with cardiovascular risk factors and components of metabolic syndrome[J]. Biotechnol Biotechnol Equip, 2015, 29(1): 157-163.
[19] Karabulut A, Dogan A, Tuzcu A K. Myocardial performance index for patients with overt and subclinical hypothyroidism[J]. Med Sci Monit, 2017, 23: 2519-2526.
[20] Ness G C, Pendleton L C, Li Y C, et al. Effect of thyroid hormone on hepatic cholesterol 7 alpha hydroxylase, LDL receptor, HMG-CoA reductase, farnesyl pyrophosphate synthetase and apolipoprotein A-I mRNA levels in hypophysectomized rats[J]. Biochem Biophys Res Commun, 1990, 172(3): 1150-1156.
[21] Pearce E N. Hypothyroidism and dyslipidemia: modern concepts and approaches[J]. Curr Cardiol Rep, 2004, 6(6): 451-456.
[22] Thompson G R, Soutar A K, Spengel F A, et al. Defects of receptor-mediated low density lipoprotein catabolism in homozygous familial hypercholesterolemia and hypothyroidism in vivo[J]. Proc Natl Acad Sci U S A, 1981, 78(4): 2591-2595.
[23] Tian L, Song Y, Xing M, et al. A novel role for thyroid-stimulating hormone: up-regulation of hepatic 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase expression through the cyclic adenosine monophosphate/protein kinase A/cyclic adenosinemonophosphate-responsive element binding protein pathway[J]. Hepatology,2010, 52(4): 1401-1409.
[24] Zhang T, Zhou L, Li C C, et al. TSH increases synthesis of hepatic ATP-binding cassette subfamily A member 1 in hypercholesterolemia[J]. Biochem Biophys Res Commun, 2016, 476(2): 75-81.
[25] Tan K C, Shiu S W, Kung A W. Plasma cholesteryl ester transfer protein activity in hyper-and hypothyroidism[J]. J Clin Endocrinol Metab, 1998, 83(1): 140-143.
[26] Lam K S, Chan M K, Yeung R T. High-density lipoprotein cholesterol, hepatic lipase and lipoprotein lipase activities in thyroid dysfunction—effects of treatment[J]. Q J Med, 1986, 59(229): 513-521.
[27] Johansson L, Rudling M, Scanlan T S, et al. Selective thyroid receptor modulation by GC-1 reduces serum lipids and stimulates steps of reverse cholesterol transport in euthyroid mice[J]. Proc Natl Acad Sci U S A, 2005, 102(29): 10297-10302.

