伴白细胞计数异常的B细胞非霍奇金淋巴瘤临床特征及预后分析
王 琨 张建华 张睿娟 董春霞 马小雯 申 星 陈 昆 常舒婷 杨林花
(山西医科大学第二医院血液科, 太原 030001)
淋巴瘤典型临床特征为无痛性、进行性淋巴结肿大。其异质性明显,无论是经典国际预后指数(international prognostic index, IPI)评分还是改良后IPI评分,均不能准确预测所有淋巴瘤患者的预后[1];基因表达谱分析、遗传学检测、基于免疫组织化学的预后生物学标志物等新技术费用昂贵、对实验室要求较高,多数结果目前尚无统一结论。近年来,越来越多的研究回归探索更为经济、方便易行的指标,血细胞相关指标,如淋巴细胞绝对值、单核细胞绝对值等在淋巴瘤预后研究中取得良好进展[2];白细胞计数已成为急性淋巴细胞白血病、套细胞淋巴瘤的预后预测指标;国内外大量研究[3-6]显示,淋巴瘤累及骨髓后可有血细胞计数异常。临床中,一部分非霍奇金淋巴瘤(B-cell non-Hodgkin lymphoma,B-NHL)患者就诊时伴有外周血白细胞计数明显异常,但对于该类患者,白细胞计数异常是否可以提示骨髓受累情况、是否影响预后、是否需要强化治疗,国内外报道罕见。本研究回顾性总结了山西医科大学第二医院近7年诊治的伴白细胞计数异常的B-NHL患者的临床特征、治疗方案及生存情况,对其特点及预后影响因素进行深入分析。
1 资料与方法
1.1 病例资料
山西医科大学第二医院2011年1月至2017年12月期间经组织病理学明诊断的B-NHL患者242例,其中77例初诊时伴有白细胞计数异常,有完整临床特征资料68例,可进行早期疗效评价的患者40例;随访截至2018年1月31日,有效随访43例。
1.2 研究方法
1.2.1 病例筛选及分组
有完整临床资料、至少2次化验血常规示白细胞(white blood cell, WBC)计数异常(WBC>10×109/L或<4×109/L)的B-NHL患者68例,诊断及分型标准参考《2016年WHO淋巴组织肿瘤分类》[3]。分组参考《2016年中国成人急性淋巴细胞白血病诊断与治疗指南》[4]中急性B淋巴细胞白血病预后分层中白细胞计数对预后的影响。根据白细胞计数异常程度分为3组:白细胞计数明显增高组(WBC>30×109/L)、轻度增高组[WBC为(10~30)×109/L]、减低组(WBC<4×109/L)。
1.2.2 临床特征统计
统计患者的临床特征、常规辅助检查及病理学检查。临床资料包括一般特征、全血细胞计数、生物化学检查、自身抗体、肿瘤标志物、血清免疫球蛋白、EB病毒DNA、浅表淋巴结B超、腹部彩超,胸腹盆腔CT扫描;病理学检查包括淋巴结、骨髓或其他组织病理及免疫组织化学,骨髓细胞形态学检查,骨髓流式细胞术(无法取得骨髓血者采用外周血),细胞遗传学及分子生物学检测。分期采用Ann Arbor分期法,白血病期为骨髓或外周血细胞形态学检查示淋巴瘤样细胞或原幼淋样细胞≥20%。本研究中Ann Arbor Ⅳ期不包括白血病期。
1.2.3 治疗及疗效评价
结合疾病评估及患者意愿予以治疗,治疗方案包括:(1)CHOP方案: 环磷酰胺750 mg/m2,第1天,多柔比星50 mg/m2,第1天;长春地辛4 mg,第1天;泼尼松100 mg/m2(合并有高血压、糖尿病者减量为1 mg/kg),第1~5天。(2)CHOP+B/E方案:CHOP方案基础联合博来霉素、依托泊苷。(3)R-CHOP方案: 利妥昔单克隆抗体 375 mg/m2,第0天,余同CHOP方案。(4)强化治疗方案:参考《2016年中国成人急性淋巴细胞白血病诊断与治疗指南》[4]治疗方案。3~4个疗程化疗后评价早期疗效,疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD);计算总反应率(overall response rate,ORR);分析ORR的影响因素。
1.2.4 随访及生存分析
随访至2018年1月31日,统计有效随访患者的总生存(overall survival,OS)、无进展生存(progression-free survival,PFS)情况。分析临床特征、治疗及早期疗效是否影响预后。有效随访定义为随访满30个月。
1.3 统计学方法
采用 SPSS 21.0 软件进行统计学分析,结果以中位数、率或构成比表示。率的比较采用χ2检验,非正态分布数据采用秩和检验。单因素预后分析采用Kaplan-Meier法,并行Log-rank检验,多因素预后分析采用Cox比例风险回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
初诊时伴白细胞计数异常的患者占B-NHL的31.8%(77/242)。68例有完整临床资料,白细胞计数明显增高组13例,轻度增高组26例,减低组29例。中位就诊年龄63(19~80)岁;男性40例,女性28例,男女比约为1.4∶1;自出现症状至诊断中位时间为2(0.2~120.0)个月。白细胞明显增高组患者男女比达5.5∶1,与白细胞减低组性别比差异有统计学意义(P=0.002)。不同白细胞分组的中位就诊年龄、自出现症状至诊断时间差异无统计学意义(P>0.05),详见表1。
病理亚型中,边缘区B细胞淋巴瘤(marginal zone B-cell lymphoma,MZL)最常见,达29.41%(20/68),其次为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL),占20.59%(14/68)。白细胞明显增高组以MZL为主,占46.15%(6/13),套细胞淋巴瘤(mantle cell lymphoma,MCL)占38.46%(5/13);白细胞轻度增高组以MZL为主,占38.45%(10/26),其次为DLBCL,占23.08%(6/26);白细胞减低组以DLBCL为主,占27.59%(8/29)。3组间病理类型分布差异无统计学意义(P=0.055)。
68例患者常见就诊原因有腹胀、纳差、乏力、体检发现血细胞计数异常;其他原因还有淋巴结、扁桃体肿大、乏力、呼吸困难、呃逆;有B症状39例,脾大43例,肝大13例,结外侵犯8例。Ann Arbor分期,Ⅲ期7例,Ⅳ期45例,白血病期16例。3组均以Ⅳ期患者最多,各组分期分布差异无统计学意义(P=0.518)。
2.2 实验室检查
32.3%(22/68)患者为单纯白细胞计数异常;57.4%(39/68)伴有贫血,58.8%(38/68)合并血小板减少。白细胞明显增高组,单纯白细胞计数异常15.4%(2/13),三系异常38.5%(5/13),淋巴细胞比例均异常(13/13);白细胞轻度增高组,单纯白细胞计数异常50%(13/26),三系异常30.8%(8/26),淋巴细胞比例异常为65.4%(17/26);白细胞减低组,单纯白细胞计数异常17.2%(5/29),三系异常69.0%(20/29),淋巴细胞比例异常为28%(8/29)。白细胞减低组患者贫血、三系异常比例高于白细胞轻度增高组(P=0.000,P=0.012),三组间外周血淋巴细胞百分比均不同,差异有统计学意义(P1=0.041,P2=0.007,P3=0.000);其余组间比较均差异无统计学意义(P>0.05)。
免疫球蛋白单克隆异常者占19.7%(13/66),以IgG增高多见;肿瘤标志物增高占21%(14/66),包括CA125、CA199、CA153;检测出自身抗体者占22.7%(15/66),其中4例Coombs试验阳性;合并EB病毒(Epstein-Barr virus, EBV)感染者占13.1%(9/66);LDH异常者占54.24%(32/59),其中白细胞明显增高组为58%(7/12),白细胞轻度增高组为33%(8/24),白细胞减低组为74%(17/23),白细轻度增高组LDH异常率较白细胞减低组低,差异有统计学意义(P=0.006);其余特征3组间差异均无统计学意义(P>0.05)。
91.6%(55/60)的患者骨髓增生程度至少为3级,88.3%(53/60)的患者有骨髓侵犯,28.3%(15/53)伴有骨髓纤维化。白细胞明显增高组均有骨髓侵犯(12/12),白细胞轻度增高组骨髓侵犯率为85.7%(18/21),白细胞减低组骨髓侵犯率为85.2%(23/27),差异无统计学意义(P>0.05)。细胞遗传学或分子学异常检出率为53%(25/47),8例p53阳性。
2.3 治疗方案及治疗效果
40例可评价早期治疗效果。首次治疗后,骨髓受累患者的骨髓改善率为50%(17/34)。早期治疗效果评价CR率为17.5%(7/40),ORR为55.0%(22/40);ORR与初诊时LDH、血小板计数、首次治疗后骨髓改善情况相关(P=0.028,P=0.048,P=0.037)。接受R-CHOP方案治疗的患者其ORR为66.7%(12/18),接受强化方案治疗的患者其ORR为66.7%(4/6);例接受CHOP/CHOP样方案治疗的患者其ORR为37.5%(6/16),差异无统计学意义(P=0.217)。Ⅲ/Ⅳ期患者30例,其接受R-CHOP方案与CHOP/CHOP样方案治疗的ORR分别为62.5%(10/16)、42.9%(6/14),差异无统计学意义(P=0.464)。白血病期患者10人,R-CHOP方案治疗后ORR为100%(2/2),强化方案治疗的患者ORR为66.7%(4/6),CHOP/CHOP样方案治疗的ORR为0%(0/2);差异无统计学意义(P=0.333)。其余临床特征均不影响ORR(P>0.05)。
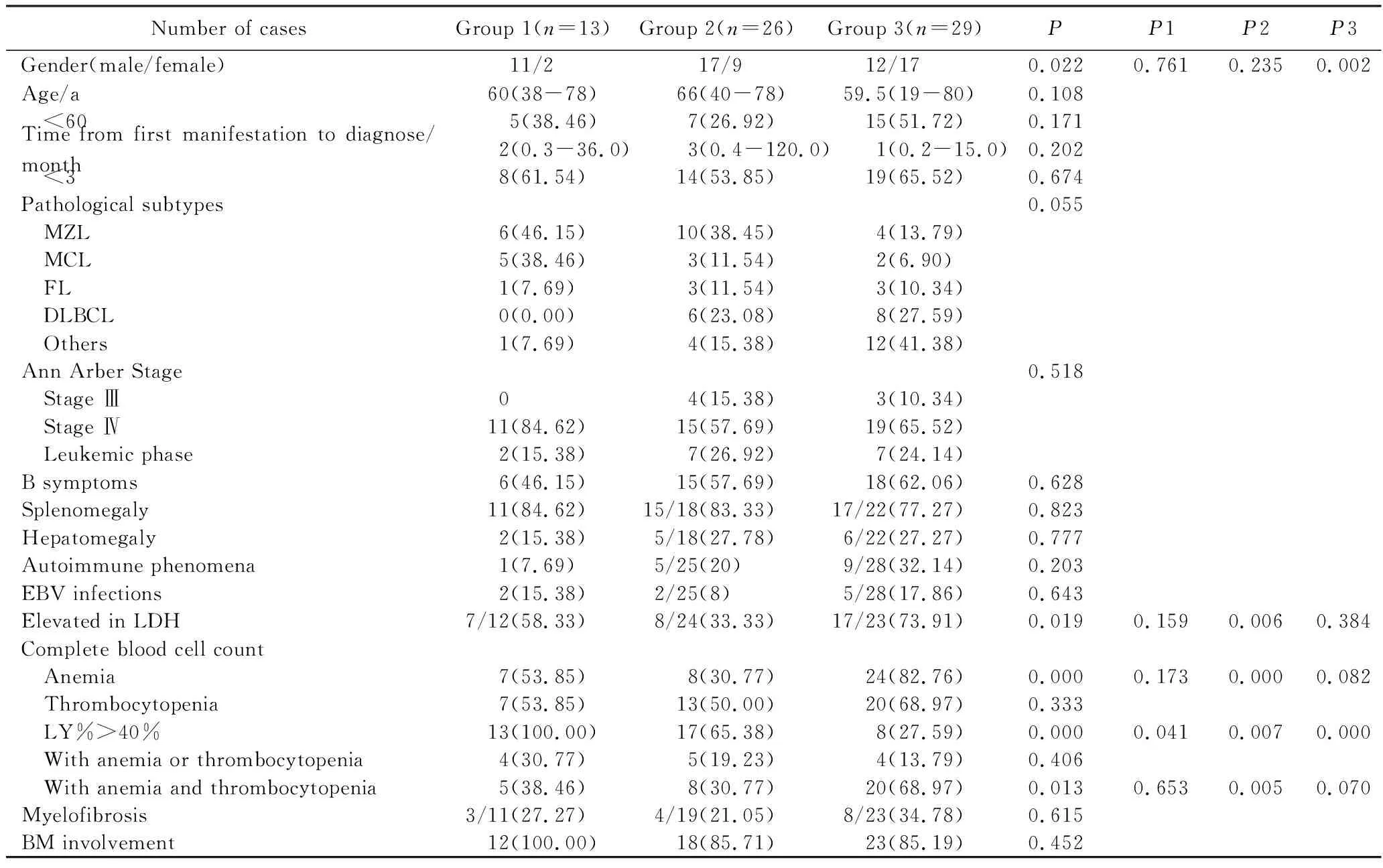
表1 伴白细胞计数异常B-NHL临床特征Tab.1 Clinical characteristics of B-cell Non-Hodgkin lymphoma with abnormal leukocyte count n(%)
Group1:significant leukocytosis;Group2:slightly leukocytosis;Group3:leucopenia;MZL:marginal zone B-cell lymphoma;MCL:mantle cell lymphoma;FL:follicular lymphoma;leucopenia;DLBCL:diffuse large B-cell lymphoma;EBV:Epstein-Barr virus;LDH:lactate dehydrogenase;LY:lymphocyte;BM:bone marrow;P1:the statistical comparison between group 1 and group 2;P2:the statistical comparison between group 2 and group 3;P3:the statistical comparison between group 1 and group 3.
2.4 生存分析
随访截至2018年1月31日,中位随访时间22(1-70)个月,失访11例,有效随访43例。其中位OS为24个月(95%CI:8.722~39.278),中位PFS为13个月(95%CI:2.721~23.279),30个月OS率为48.8%,PFS率为25.6%。
白细胞明显增高组中位OS为25个月,白细胞轻度增高组中位OS未达到,白细胞减低组中位OS为15个月(95%CI:0.000~30.210),3组30个月OS率分别为45.5%、60%、41.2%,差异无统计学意义(P=0.549)。白细胞明显增高组中位PFS为11个月(95%CI:0.211~21.789),白细胞轻度增高组中位PFS为30个月(95%CI:13.589~46.411),白细胞减低组中位PFS为7个月(95%CI:2.966~11.034),3组30个月PFS率分别为9.1%、46.7%、17.6%;白细胞轻度增高组PFS明显优于其他两组(P1=0.017,P2=0.026)。
未治疗者均早期死亡,中位OS仅有2个月(95%CI:0.400~3.600)。接受R-CHOP方案、强化方案治疗的患者中位OS均未达到,30个月OS率均为71.4%;接受CHOP方案治疗的患者中位OS为15个月(95%CI:3.959~26.041),30个月OS率为31.6%;接受R-CHOP方案治疗的患者的OS明显优于CHOP/CHOP样方案治疗的患者(P=0.017)。不同治疗方案之间PFS差异无统计意义(P>0.05),详见图1。
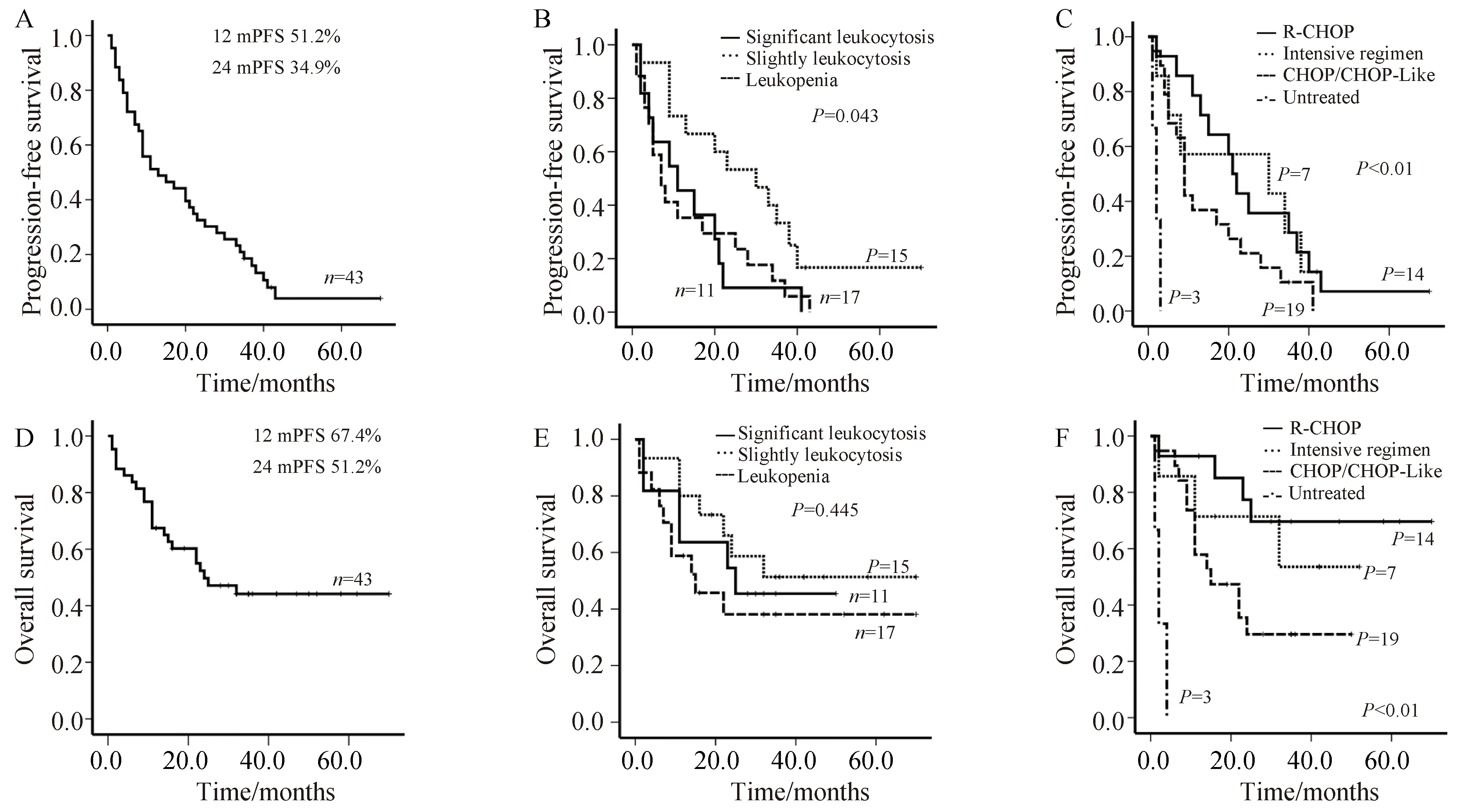
图1 伴白细胞计数异常B-NHL的Kaplan-Meier曲线Fig.1 Kaplan-Meier curves of B-NHL with abnormal leukocyte count
A:PFS of all patients;B:PFS of three leukocyte count groups;C:PFS of different chemotherapy regimens;D:OS of all patients;E:OS ofthree leukocyte count groups;F:OS of different chemotherapy regimens;OS:overall survival;PFS:progression-free survival;WBC:white blood cell;B-NHL:B-cell non-Hodgkin lymphoma;
对除白细胞分组、治疗方案外的其他因素进行预后分析。侵袭性组织学、B症状、贫血、血小板减少、不同治疗方案、治疗后能否早期达CR或PR是OS的影响因素;LDH升高、白细胞分组、是否治疗、治疗后能否早期达CR或PR是PFS的影响因素;其余分类变量经Log-rank检验,差异均无统计学意义(P>0.05)。将单因素分析中P<0.05的因素进行多因素预后分析。B症状、治疗后能否早期达CR或PR为OS的预后影响因素,治疗后能否早期达CR或PR也是PFS的预后影响因素,差异有统计学意义(P>0.05),详见表2。
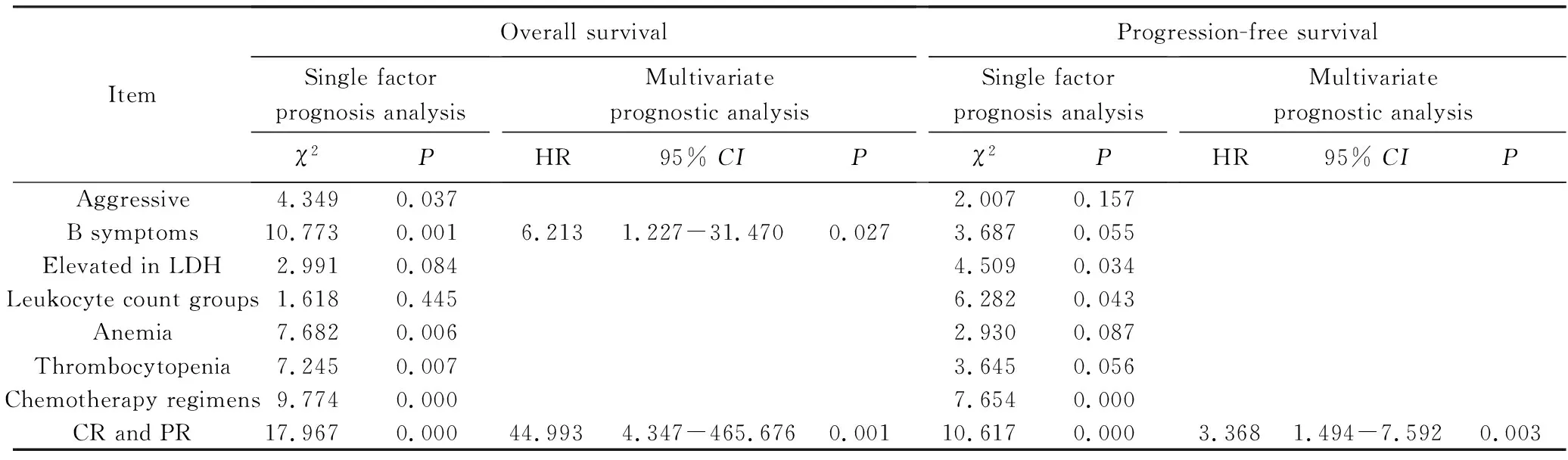
表2 单因素及多因素预后分析Tab.2 Single factor prognosis analysis and multivariate prognostic analysis
LDH:lactate dehydrogenase;CR:complete response;PR:partial response.
3 讨论
2015年美国一项NHL的流行病学调查统计[5],6万名患者的中位诊断年龄为67岁,男性占53.7%;2017年东南亚研究[6]显示,NHL中位诊断年龄为57岁,男女性别比约为1.3∶1。本研究患者中位诊断年龄为63岁,男女比约为1.4∶1,但在白细胞增高组中男性患者要远多于女性,由于该组样本量较小,需要扩大样本研究白细胞明显增高的患者是否存在性别差异。不同病理亚型的B-NHL之间B症状发生率从20%~50%不等,LDH异常比例为22%~65%[6],骨髓侵犯的患者42%出现B症状[7]。本组患者57%出现B症状,LDH异常率为54%,处于高水平,尤其是白细胞减低组,LDH异常率达74%,提示该类型的患者肿瘤负荷更高。
NHL患者骨髓受累后,特别是白血病阶段常出现血细胞计数异常[7],但白血病期在诊断时出现的比例并不高[8]。骨髓受累的发生机制尚不明确,黏附分子差异性表达可能是淋巴细胞从淋巴结迁移的机制之一[9]。Nishimura等[10]研究显示,骨髓受累的NHL患者23%出现外周血异常;骨髓侵犯后33.82%的患者发生白细胞增高,66.18%的患者发生贫血,血小板减少有42.65%[7];不同病理亚型外周血受累发生率不同,脾边缘区淋巴瘤外周血受累的发生率高,DLBCL患者外周血受累仅有5.3%[11]。在山西医科大学第二医院血液中心初诊的B-NHL患者中有92%出现骨髓受累,白细胞计数异常的发生率达32%,尤其是白细胞>30×109/L的患者均发生了骨髓受累,此类患者57%伴有贫血,59%合并血小板减少,发生两系、甚至是三系异常的比例高达68%,非MALT边缘区淋巴瘤中白细胞计数异常的发生率为66%,DLBCL仅为8%。与之前研究骨髓侵犯的B-NHL患者病理亚型分布及血象异常数据类似,因此可以通过血常规间接判断骨髓受累情况。
B-NHL患者贫血程度一般较轻,血红蛋白浓度为100~120 g/L,贫血与疾病晚期、LDH升高、结外侵犯等不良特征相关[12]。Adams等[13]研究,B-NHL患者治疗前贫血、治疗6个月后贫血未改善与PFS和OS降低显著相关。Hong等[14]研究血红蛋白<100 g/L的DLBCL患者无论治疗前骨髓受累情况如何,无事件生存和无病生存均较差。此外,血红蛋白<120 g/L已作为滤泡性淋巴瘤国际预后指数的风险因素[15]。血小板计数也可影响NHL的预后。Ochi等[16]研究显示,血小板计数<100×109/L是独立于NCCN-IPI之外影响OS的因素。Montalbán等[17]一项对593例脾边缘区淋巴瘤患者的回顾性研究显示,贫血、血小板计数减少与淋巴瘤特异性生存(LSS)独立相关。山西医科大学第二医院血液中心该类患者贫血、血小板减少的发生率高,其为OS的预后不良因素,与文献报道相符。
本研究显示,白细胞计数异常程度影响B-NHL患者的PFS;白细胞轻度增高的患者相对其他两组预后较好,该组患者肿瘤负荷指标如LDH异常、B症状以及三系异常率低于白细胞减低组,骨髓受累程度较白细胞明显增高组轻,这可能是白细胞轻度增组患者生存优于其他两组的原因。尽管淋巴细胞绝对值、单核细胞绝对值以及相关比值在淋巴瘤预后研究中取得良好进展[2,18]。但本研究中,由于骨髓及外周血受累比例高,淋巴细胞绝对值明显异常,绝对值计数及比值偏差较大,仅对淋巴细胞百分比异常率及淋巴细胞绝对值/血小板比率做了初步分析,并未得出有效结果。因此,该类指标对于此类患者是否仍有预后评估价值,有待大样本进一步研究。此外,山西医科大学第二医院血液中心此类患者骨髓纤维化比例高达28%,但该部分患者骨髓并未观察到明显的造血功能衰竭,可能是肿瘤细胞侵犯骨髓后,其分泌一些细胞因子破坏骨髓造血微环境,从而引起骨髓纤维化及血细胞异常。
B-NHL患者由于成熟B细胞恶变,其免疫功能缺陷,EBV、CMV感染率高,相关病毒感染可导致白细胞减少,甚至引发噬血细胞综合征,因此,免疫介导的血细胞破坏、病毒感染也是导致血细胞减少重要因素。Jachiet等[19]研究显示,淋巴瘤发生系统性炎性反应以及自身免疫性疾病率为4.3%,其中自身免疫性血细胞减少症占71.3%。杨申淼等[20]研究血象异常的脾边缘区淋巴瘤合并自身免疫现象高达80%。山西医科大学第二医院血液中心伴有白细胞计数异常的B-NHL患者诊断时免疫球蛋白单克隆性异常比例及自身抗体阳性率高,合并EBV感染率为13%,这可能是导致山西医科大学第二医院血液中心患者血细胞减少的原因之一。因此,伴有血细胞减少的淋巴瘤患者需对相关因素进行筛查、治疗。
NHL的常见治疗方法包括化疗、放疗、免疫治疗、造血干细胞移植技术等[21-23]。CHOP方案作为第一代联合化疗的方案,使得晚期NHL患者的长期生存得到明显提高。在CHOP的基础上,增减药物剂量、结合新药的第二代、第三代方案使疗效有了进一步提高,随着CD20单抗利妥昔单克隆抗体批准用于临床,NHL的治疗迎来了新时代。R-CHOP目前已成为DLBCL以及其他CD20+NHL患者的标准治疗方案[1,24]。然而,并非所有患者均可从常规治疗中获益[25]。各种强化方案,如EPOCH-R、ACVBP-R、来那度胺+CHOP-R方案在不断的尝试中[26-28]。本研究结果显示,早期ORR与LDH、血小板计数、首次治疗后骨髓改善情况相关,早期治疗后能否获得CR或PR是影响该类患者OS、PFS的唯一共同预后因素,并且与临床医生的治疗决策有相关性。白血病期患者R-CHOP与强化治疗方案的早期ORR与总生存率接近,均高于CHOP方案;R-CHOP方案治疗的患者OS优于CHOP方案;但由于样本量较小,其差异并无统计学意义。因此,白血病期患者接受ALL强化诱导治疗方案可获得较高的ORR及PFS,该方案联合利妥昔单克隆抗体是否可以改善伴白细胞计数异常的B-NHL患者整体疗效及生存,有待进一步研究。
遗传学及分子学异常与淋巴瘤预后密切相关[29]。本组患者遗传学及分子学异常检出率超过50%,但由于早期病例该数据缺失率高、近期有完整资料患者未到随访周期,因此并未将该指标纳入生存分析。本研究需要更多样本、更长的随访周期评估该指标是否影响预后。
总之,就诊时伴有白细胞计数异常、合并贫血、血小板减少的淋巴瘤患者并不少见,全血细胞减少或白细胞增高的急性白血病的诊断中需注意淋巴瘤的鉴别。虽然部分患者骨髓淋巴细胞比例极高,但由于淋巴瘤细胞形态多样,单纯骨髓细胞形态学检查并不能很好识别,如何结合骨髓细胞病理、流式细胞术等检查早期识别更高危患者,有待进一步研究。该类患者若不进行治疗,中位生存时间短;山西医科大学第二医院血液中心患者分期晚,尽管多数治疗积极,但早期ORR仅约50%,OS、PFS也远低于其他研究[5-6],尤其是对于白细胞明显增高及减低的患者,疾病多在1年内进展,中位生存期不足两年半。白血病期患者接受ALL强化诱导治疗方案可获得较高的ORR及PFS,该方案联合利妥昔单克隆抗体是否可以改善伴白细胞计数异常的B-NHL患者整体疗效及生存,有待进一步研究。
[1] Sehn L H, Berry B, Chhanabhai M, et al. The revised International prognostic index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP [J]. Blood, 2007, 109(5):1857-1861.
[2] Wang J, Zhou X, Liu Y, et al. Prognostic significance of neutrophil-to-lymphocyte ratio in diffuse large B-cell lymphoma: A meta-analysis [J]. PLoS One, 2017, 12(4):e0176008.
[3] Swerdlow S H, Campo E, Pileri S A, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms [J].Blood,2016, 127(20):2375-2390.
[4] 中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会白血病淋巴瘤学组,中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)[J]. 中华血液学杂志,2016,37(10):837-845.
[5] Al-Hamadani M, Habermann T M, Cerhan J R, et al. Non-Hodgkin lymphoma subtype distribution, geodemographic patterns, and survival in the US: A longitudinal analysis of the National Cancer Data Base from 1998 to 2011 [J]. Am J Hematol, 2015, 90(9):790-795.
[6] Intragumtornchai T, Bunworasate U, Wudhikarn K, et al. Non-hodgkin lymphoma in south east asia: an analysis of the histopathology, clinical features, and survival from Thailand[J]. Hematol Oncol, 2018, 36(1):28-36.
[7] Xin X, Liu Z, Meng F, et al. Analysis of prognostic factors in lymphoma patients with bone marrow involvement: a single center cohort study[J]. Int J Clin Exp Med, 2015, (6):9676-9683.
[8] Bain B J, Catovsky D. The leukaemic phase of non-Hodgkin’s lymphoma [J]. J Clin Pathol, 1995, 48(3):189-193.
[9] Muringampurath-John D, Jaye D L, Flowers C R, et al. Characteristics and outcomes of diffuse large B-cell lymphoma presenting in leukaemic phase[J]. Br J Haematol, 2012, 158(5):608-614.
[10] Nishimura K, Ota R, Mikajiri Y, et al. Useful laboratory markers for the diagnosis of bone marrow involvement by malignant lymphoma[J]. Int J Lab Hematol, 2018,40(1):34-40.
[11] Sovani V, Harvey C, Haynes A P, et al. Bone marrow trephine biopsy involvement by lymphoma: review of histopathological features in 511 specimens and correlation with diagnostic biopsy, aspirate and peripheral blood findings [J]. J Clin Pathol, 2014, 67(5):389-395.
[12] Spivak J L. The anaemia of cancer: death by a thousand cuts [J]. Nat Rev Cancer, 2005, 5(7): 543-555.
[13] Adams H J, de Klerk J M, Fijnheer R, et al. Prognostic value of anemia and C-Reactive protein levels in diffuse large B-Cell Lymphoma[J]. Clin Lymphoma Myeloma Leuk, 2015, 15(11):671-679.
[14] Hong J, Woo H S, Kim H, et al. Anemia as a useful biomarker in patients with diffuse large B-cell lymphoma treated with R-CHOP immunochemotherapy[J]. Cancer Sci, 2014, 105(12):1569-1575.
[15] Federico M, Bellei M, Marcheselli L, et al. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project[J]. J Clin Oncol, 2009, 27(27):4555-4562.
[16] Ochi Y, Kazuma Y, Hiramoto N, et al. Utility of a simple prognostic stratification based on platelet counts and serum albumin levels in elderly patients with diffuse large B cell lymphoma[J]. Ann Hematol, 2017, 96(1):1-8.
[17] Montalbán C, Abraira V, Arcaini L, et al. Risk stratification for splenic marginal zone lymphoma based on haemoglobin concentration, platelet count, high lactate dehydrogenase level and extrahilar lymphadenopathy: development and validation on 593 cases[J]. Br J Haematol, 2012, 159(2):164-171.
[18] Belotti A, Doni E, Bolis S, et al. Peripheral blood lymphocyte/monocyte ratio predicts outcome in follicular lymphoma and in diffuse large b-cell lymphoma patients in the rituximab era[J]. Clin Lymphoma Myeloma Leuk, 2015, 15(4):208-213.
[19] Jachiet V, Mekinian A, Carrat F, et al. Autoimmune manifestations associated with lymphoma: characteristics and outcome in a multicenter retrospective cohort study [J]. Leuk Lymphoma, 2018,59(6):1399-1405.
[20] 杨申淼, 江倩, 江滨, 等.伴血象异常的脾边缘区淋巴瘤的临床特点[J].中国实验血液学杂志, 2013,21(1):87-94.
[21] 杨小芸, 沈丽达,龙庭凤,等.1326例非霍奇金淋巴瘤临床病理特点分析[J].中华肿瘤防治杂志,2016,23(9):605-609,620.
[22] 李喆,谭晓虹,岑洪.局限期侵袭性非霍奇金淋巴瘤联合放化疗临床意义Meta分析[J].中华肿瘤防治杂志,2015,22(11):885-890.
[23] 张丽娟,周静,王林,等.一项来自中国的单中心研究:18例原发性卵巢非霍奇金淋巴瘤的临床特征、治疗及预后分析[J].中国医科大学学报,2015,44(11):1024-1030.
[24] Stopeck A T, Unger J M, Rimsza L M, et al. A phase 2 trial of standard-dose cyclophosphamide, doxorubicin, vincristine, prednisone (CHOP) and rituximab plus bevacizumab for patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: SWOG 0515[J]. Blood, 2012, 120(6):1210-1217.
[25] Rezvani A R, Maloney D G. Rituximab resistance[J]. Best Pract Res Clin Haematol, 2011, 24(2):203-216.
[26] Wilson W H, Jung S H, Porcu P, et al. A Cancer and Leukemia group B multi-center study of DA-EPOCH-rituximab in untreated diff use large B-cell lymphoma with analysis of outcome by molecular subtype [J]. Haematologica, 2012, 97(5):758-765.
[27] Molina T J, Canioni D, Copie-Bergman C, et al. Young patients with non-germinal center B-cell-like diffuse large B-cell lymphoma benefit from intensified chemotherapy with ACVBP plus rituximab compared with CHOP plus rituximab: analysis of data from the Groupe d’Etudes des Lymphomes de l’Adulte/lymphoma study association phase Ⅲ trial LNH 03-2B [J]. J Clin Oncol, 2014, 32(35):3996-4003.
[28] Nowakowski G S, LaPlant B, Macon W R, et al. Lenalidomide combined with R-CHOP overcomes negative prognostic impact of non-germinal center B-cell phenotype in newly diagnosed diffuse large B-cell lymphoma: a phase Ⅱ study[J]. J Clin Oncol, 2015, 33(3):251-257.
[29] Arcaini L, Rossi D, Paulli M. Splenic marginal zone lymphoma: from genetics to management [J]. Blood, 2016; 127(17):2072-2081.

