重型血友病A患儿关节出血后IL-1β、IL-6、TNF-α释放与关节病变形成的相关性研究
刘国青 陈振萍 唐 凌 吴心怡 甄英姿 李 刚 王 岩 张宁宁 张纪水 于国霞 吴润晖
(首都医科大学附属北京儿童医院血液肿瘤中心 儿童血液病与肿瘤分子分型北京市重点实验室 儿科学国家重点学科 教育部儿童重大疾病重点实验室, 北京 100045)
血友病A是一种由凝血因子Ⅷ缺乏所致X染色体连锁的先天性出血性疾病,发病率为每5 000例活产男婴中发病1例。尽管血友病的相关治疗取得了很大的进展,关节病变作为血友病关节出血后的第一合并症,其发生发展仍未得到有效预防和治疗,关节炎甚至关节残疾的出现影响着许多患者(尤其是患儿)的身心健康[1-2]。世界血友病联盟(World Federation of Hemophilia, WFH)将预防治疗推荐为重型血友病的标准治疗方法。预防治疗的优势及有效性已得到公认,但是研究[3]也显示,虽然预防治疗可以降低出血事件的发生概率,一旦血友病性关节病形成,就不可再逆转,此时预防治疗只能延缓关节病的进展。
临床观察[4]显示,相同出血情况下,关节病的形成与否、严重程度存在个体差异,提示除关节出血因素外,存在其他影响因素参与血友病关节病的形成。血友病关节出血后血液对关节软骨具有直接侵蚀作用:血液充满关节腔后激活单核/巨噬系统释放白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、基质金属蛋白酶类等细胞因子,导致血管内皮生长因子(vascular endothelial growth factor, VEGF)分泌增加,诱发滑膜肥大和新生血管生长,形成滑膜炎性反应;出血后滑膜内的铁沉积导致关节软骨细胞损伤和死亡,最终造成整个关节的退行性变和功能障碍[3,5-6]。而风湿性关节炎也有类似的过程,因此人们普遍认为,血友病关节出血后的关节病发病机制及过程类似于类风湿性关节炎退行性变软骨的破坏过程[1]。
在其他炎性关节病变,尤其是风湿免疫病领域中,已经发现关节炎与炎性反应因子的关系,尤其是IL-1β、IL-6、TNF-α,并且抗细胞因子的药物如抗IL-1β、IL-6、TNF-α的靶向药物已经成功的应用于预防风湿性关节炎的慢性关节病变。近几年,人们通过体外细胞和小鼠模型的研究,可以得知IL-1β、IL-6、TNF-α等炎性反应因子在血友病关节病变的形成过程中起着重要作用[7],但究竟炎性反应因子在关节出血后关节病变形成过程中如何作用至今仍不清楚,故本研究主要探讨血友病患儿不同关节出血期炎性反应因子的表达情况,通过观察不同关节出血时期IL-1β、IL-6、TNF-α的血清蛋白浓度,以及外周单个核细胞中mRNA表达的情况,从血清水平和基因表达水平得到一个变化规律,寻找患儿关节病变形成过程中的主要因素,为更好地了解关节出血后关节病变形成的机制,为之后关节病变的用药和治疗提供可靠的理论依据。
1 资料与方法
1.1 研究对象
收集2015年10月至2016年4月在首都医科大学附属北京儿童医院血友病门诊常规筛查抑制物处于不同关节出血分期的47例血友病患儿作为研究组。所有入组患者均签署知情同意书。
纳入标准:(1)年龄2~18岁;(2)重型血友病患儿;(3)没有抑制物产生病史;(4)没有危重部位出血;(5)常规筛查抑制物后留取足够残留血标本进行检测。
排除标准:(1)年龄<2岁或>18岁;(2)抑制物阳性;(3)伴有类风湿关节病、骨关节炎、混合性结缔组织病、银屑病等自身免疫系统疾病;(4)各种感染病的急性期;(5)近期服用过抗炎镇痛药物;(6)病程中曾服用过免疫制剂。
1.2 相关诊断标准及定义[6]
(1)关节出血:关节的异常感觉并满足以下任意一条:①关节表面皮肤进行性肿胀或皮肤温度进行性升高;②疼痛加剧;③与原来相比,关节活动范围进行性缩小或肢体活动困难加剧。在婴儿和小幼儿如果出现唯独不愿活动的肢体,可能提示关节或肌肉出血。(2)重型血友病A:患儿血浆因子FⅧ活性水平<1%。(3)关节病变:血友病性关节病是由于关节反复出血而引起的关节滑膜、软骨及软骨下骨的一系列病理改变。
1.3 实验分组
分为以下3组:(1)无关节出血(non-joint bleeding, NJB) 组:3个月内无关节出血;(2)急性关节出血 (acute joint bleeding, AJB)组:1个月内有关节出血;(3)慢性关节出血(chronic joint bleeding, CJB) 组:3个月内有关节出血,1个月内无关节出血。
1.4 实验方法
1)临床资料收集:收集患儿年龄及关节出血时间。
2)标本收集:紫帽管(EDTA抗凝)收集患儿静脉血标本,保证在采集后2 h内处理标本。
3)实验检测: ①应用ELISA法测定血清中IL-1β、IL-6、TNF-α细胞因子的浓度。收取外周血标本,用离心机3 000 r/min离心25 min,收集血清,放入-70°低温冰箱保存备用。用ELISA法测定血清中IL-1β、IL-6、TNF-α细胞因子的浓度。 ②外周单个核细胞进行RNA提取、反转录及用RT-PCR测定IL-1β、IL-6、TNF-α的mRNA表达量。收取外周血标本,裂解红细胞,洗涤单个核细胞,Trizol法提取分选细胞总RNA,进行RNA纯度与浓度的测定,加RNA 2 μg,Random Primers 1 μL, 补Rnase Free Water至12.5 μL,70 ℃ 5 min;反转录第二步上机(PCR仪):每12.5 μL产物中加M-MLV 5×Buffer 5 μL,dNTPs(2.5 mmol/L)5 μL,RnaseSin 0.5 μL,M-MLV 1 μL。37 ℃ 60 min。cDNA终浓度为80 ng/μL。将1 μg细胞总RNA反转录合成cDNA第一条链,随后进行PCR扩增。根据NCBI基因库描述的IL-1β、IL-6、TNF-α基因序列,设计IL-1β、IL-6、TNF-α、β-actin引物序列如表1,每次实验用无酶水代替cDNA,作为PCR阴性对照。扩增体系:cDNA 1 μL、PCR Master MIX 5 μL、灭菌注射用水3 μL,上游引物(2.5 μmol/L) 0.5 μL、下游引物(2.5 μmol/L) 0.5 μL,IL-1β、IL-6、TNF-α和β-actin用染料法进行荧光相对定量PCR,ABI ViiA7实时荧光定量PCR仪上机,程序为:95 ℃ 15 min,95 ℃ 15 s,62 ℃ 30 s,72 ℃ 30 s(35个循环),收集数据。③用到的公式:目的基因mRNA=2-△△Ct[△△Ct=(待测样本目的基因平均Ct-待测样本内参基因平均Ct)—(对照样本目的基因平均Ct-对照样本内参基因平均Ct)]。
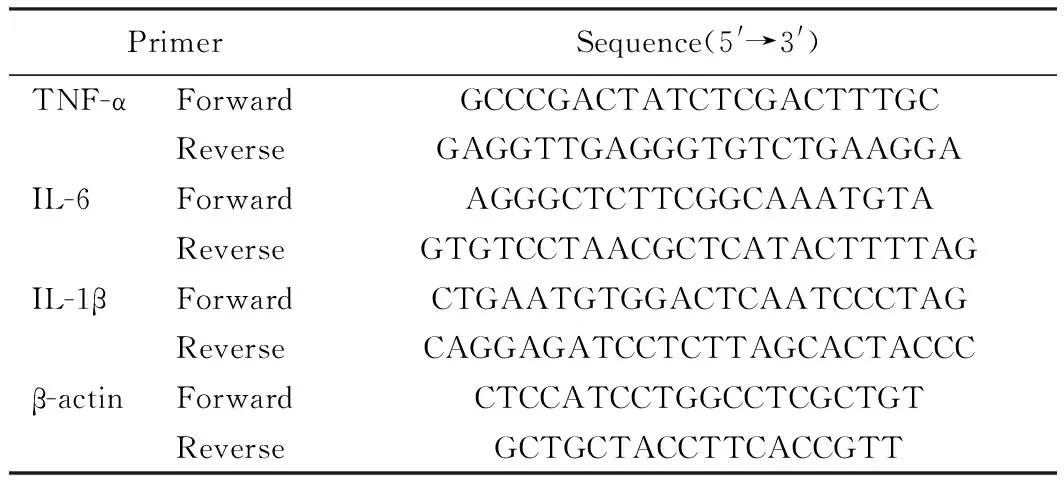
表1 RT-PCR的引物序列Tab.1 Primer sequences
TNF-α:tumor necrosis factor-α;IL-6:interleukin-6;IL-1β:interleukin-1β.
1.6 统计学方法
2 结果
2.1 一般资料
入组患儿47例,其中AJB组17例(伴关节病变8例,不伴关节病变9例),CJB组13例,NJB组17例。患儿中位年龄5.5(2~18)岁。
2.2 关节出血后炎性反应因子变化情况
1)关节出血组与无关节出血组相比,IL-1β、IL-6及TNF-α血清浓度差异无统计学意义(P>0.05),而细胞内mRNA的表达水平均升高,其中以TNF-α升高为主且差异有统计学意义(P=0.002);即血友病患儿关节出血后IL-1β、IL-6及TNF-α表达水平均升高,其中以TNF-α升高为主;2)急性出血期与无关节出血组比较,IL-1β、IL-6及TNF-α血清浓度差异无统计学意义(P>0.05),而细胞内IL-1β、IL-6及TNF-α的mRNA的表达水平均值升高,其中以TNF-α升高为主且差异有统计学意义(P=0.009);3)慢性出血组与无关节出血组比较,仅细胞内TNF-α的mRNA的表达水平升高且差异有统计学意义(P=0.031);4)急性出血期与慢性出血期的L-1β、IL-6及TNF-α血清表达浓度及细胞内mRNA的水平差异无统计学意义(P>0.05),见表2~4。
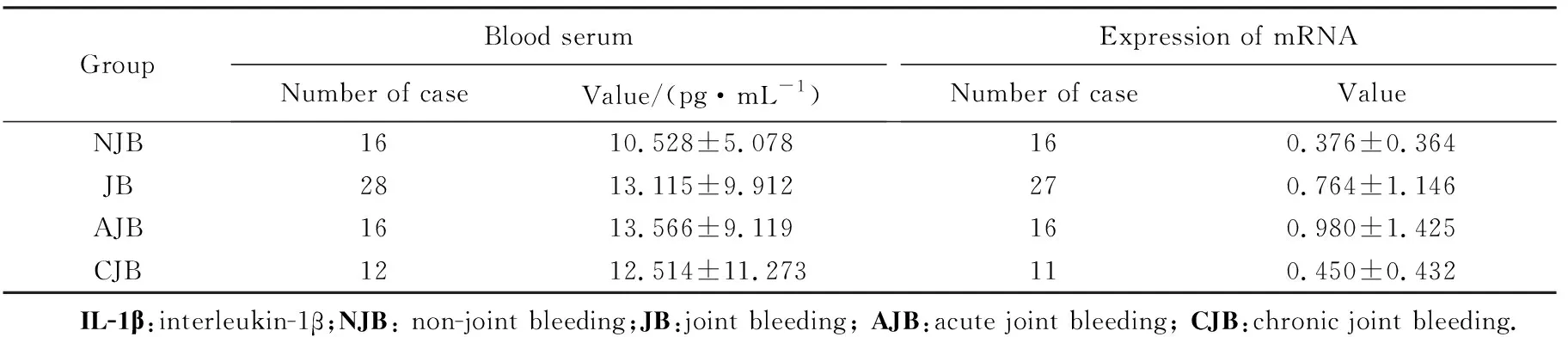
GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB1610.528±5.078160.376±0.364JB2813.115±9.912270.764±1.146AJB1613.566±9.119160.980±1.425CJB1212.514±11.273110.450±0.432 IL-1β:interleukin-1β;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleeding; CJB:chronic joint bleeding.
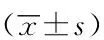
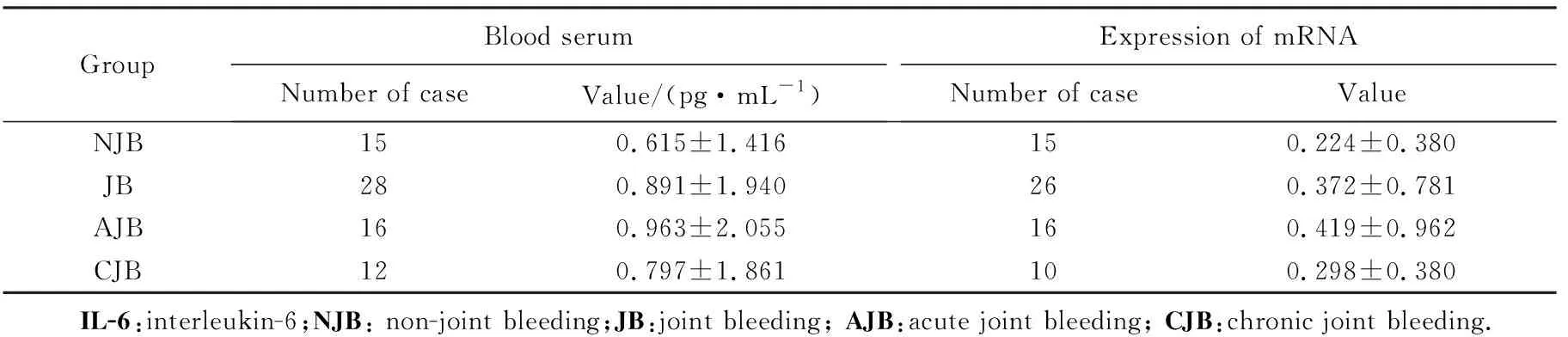
GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB150.615±1.416150.224±0.380JB280.891±1.940260.372±0.781AJB160.963±2.055160.419±0.962CJB120.797±1.861100.298±0.380 IL-6:interleukin-6;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleeding; CJB:chronic joint bleeding.
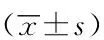
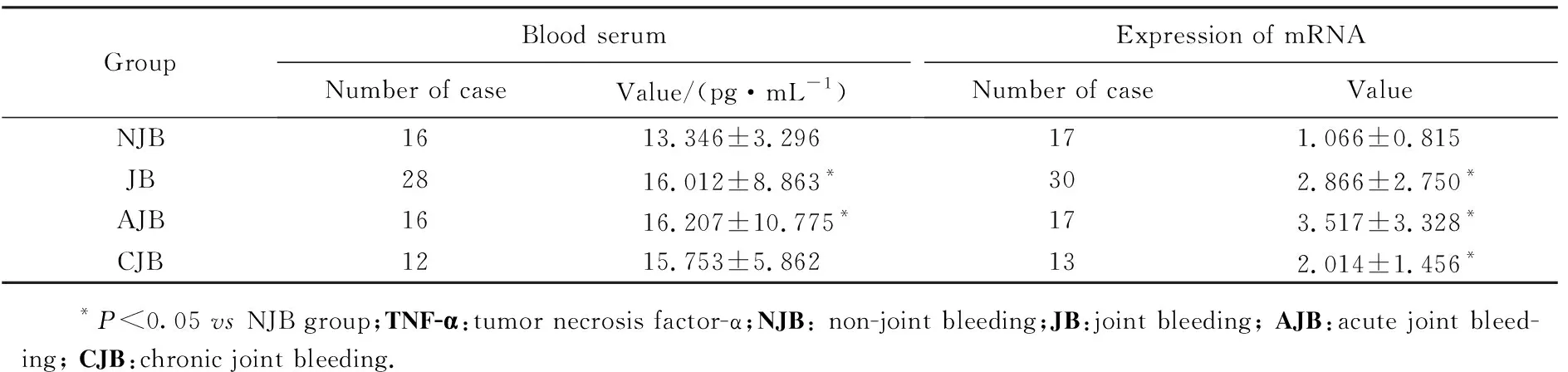
GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB1613.346±3.296171.066±0.815JB2816.012±8.863*302.866±2.750*AJB1616.207±10.775*173.517±3.328*CJB1215.753±5.862132.014±1.456* *P<0.05 vs NJB group;TNF-α:tumor necrosis factor-α;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleed-ing; CJB:chronic joint bleeding.
2.3 关节病变的患儿炎性反应因子表达水平
血清水平:AJB组伴关节病变与AJB组不伴关节病变的IL-1β的血清表达水平(12.976±6.100vs14.024±11.287),IL-6的血清表达水平(0.162±0.487vs1.991±2.836)及TNF-α的血清表达水平(20.250±15.770vs13.062±2.390)差异均无统计学意义(P值分别为0.828、0.140、0.276)(图1)。
细胞内mRNA的水平:AJB组伴关节病变与AJB组不伴关节病变的IL-1β的mRNA表达水平(1.542±1.879vs0.4718±0.317),IL-6的mRNA表达水平(0.125±0.612vs0.647±1.263)差异均无统计学意义(P值分别为0.137和0.250);TNF-α的mRNA表达水平(5.584±3.634vs1.680±1.590)差异有统计学意义(P=0.02)(图2)。
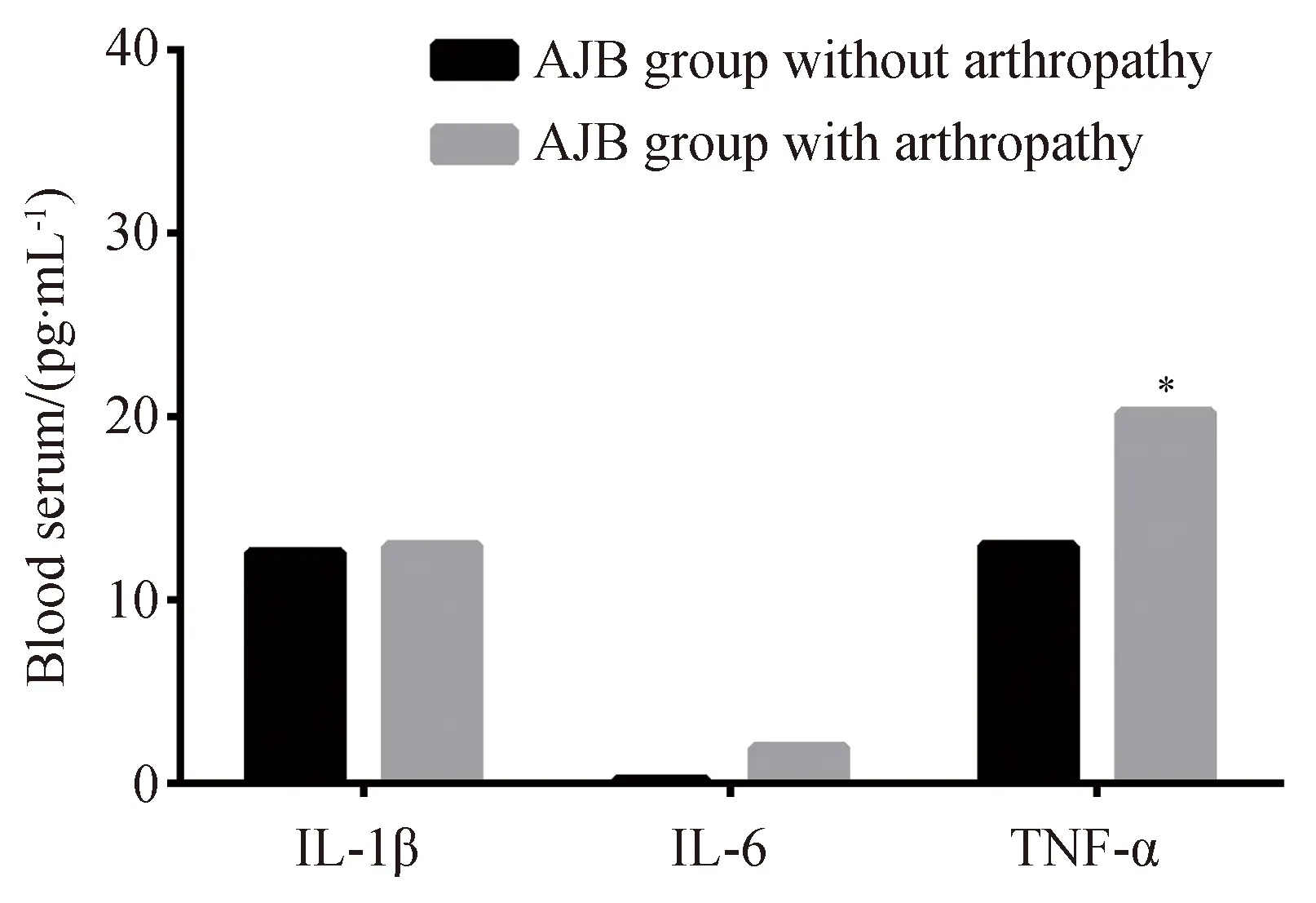
图1 AJB组伴与不伴关节病变患儿的IL-1β、IL-6、TNF-α的血清蛋白表达水平Fig.1 The levels of IL-1β, IL-6 and TNF-α inblood serum between AJB group with arthropathy and AJB group without arthropathy
AJB:acute joint bleeding;IL-1β:interleukin-1β;IL-6:interleukin-6;TNF-α:tumor necrosis factor-α.
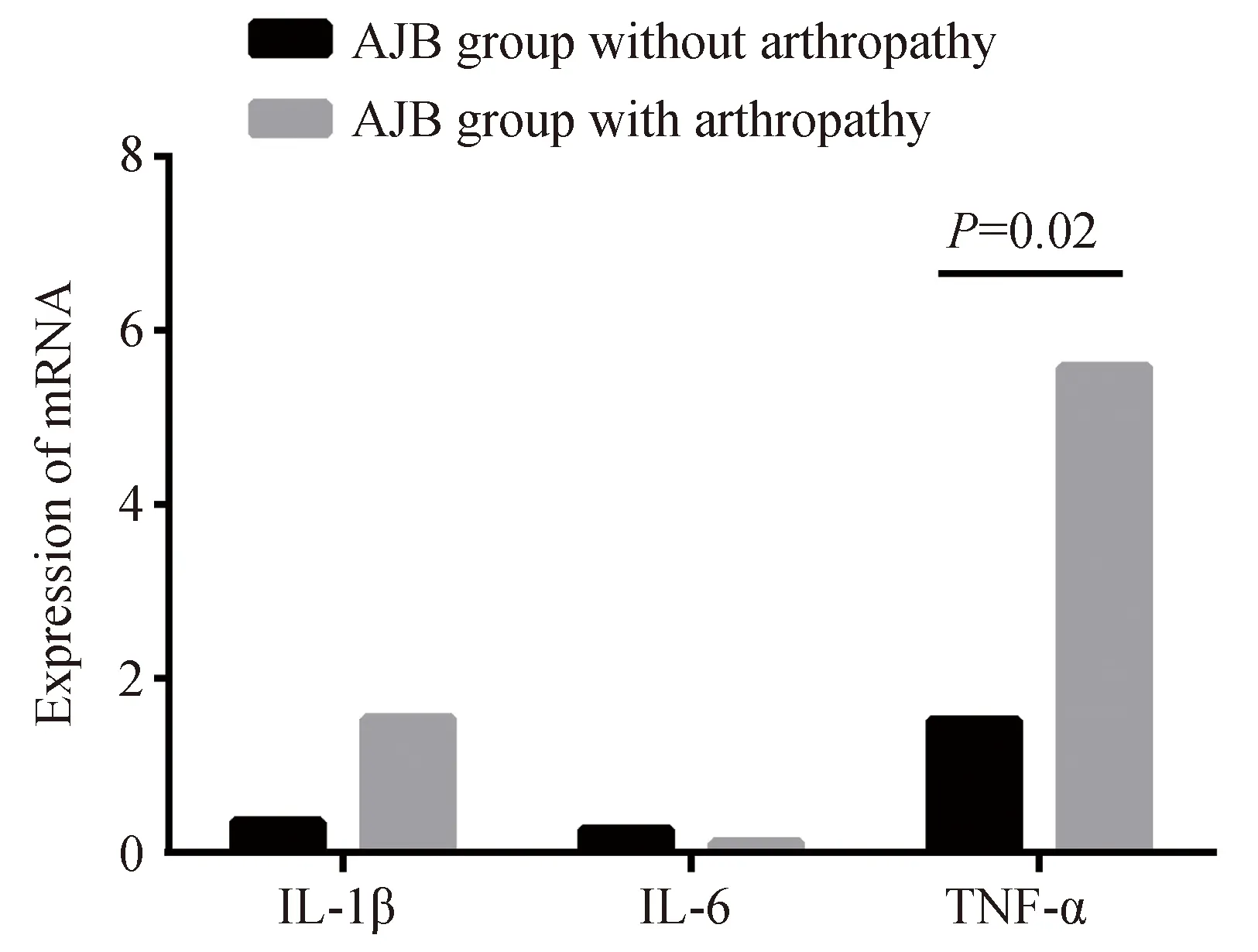
图2 AJB组伴与不伴关节病变患儿的IL-1β、IL-6、TNF-α的mRNA表达水平Fig.2 The levels of IL-1β, IL-6 and TNF-α mRNAbetween AJB group with arthropathy and AJB groupwithout arthropathy
AJB:acute joint bleeding;IL-1β:interleukin-1β;IL-6:interleukin-6;TNF-α:tumor necrosis factor-α;There was significant difference in the expression of mRNA of TNF-α between AJB group with arthropathy (P=0.02).
3 讨论
血友病是一种X染色体连锁的先天性出血性疾病。该病由于凝血因子Ⅷ/Ⅸ缺乏,导致患儿异常出血,其中以关节出血为主,严重的出血可致死,凝血因子替代治疗后,该疾病由致死性疾病变为致残性疾病[8]。重度血友病患者中82%的出血事件发生在关节,膝关节、踝关节及肘关节占了所有关节出血的80%,反复出血最终将形成血友病关节病变,引起疼痛和导致永久性功能障碍[9-10]。
炎性细胞因子被认为参与人类炎性关节炎的形成。TNF-α是有效的前炎性反应因子蛋白,Ji等[11]提出TNF-α在关节炎性病变中起着重要的作用。国外研究[1]已证实TNF-α在小鼠模型的类风湿关节病的形成中起到重要作用,如K/BxN模型中TNF-α目标失活的小鼠中关节病变的概率降低。近期TNF-α抑制剂药物也开始试用于硬皮病的临床治疗中。细胞因子中的TNF-α是炎性反应的诱发因子。近几年人们通过体外细胞和小鼠模型的研究[11-12],可以得知TNF-α、IL-1β、IL-6和IL-10等炎性反应因子在血友病关节病变的形成过程中起着重要作用。Forsyth等[13]提出血友病关节出血后,实际的机械损伤引发的出血可能微乎其微,而促炎性细胞因子(特别是TNF-α、IL-1β、IL-6)通常作为组织修复因子,巨噬细胞样滑膜细胞来增生扩增,随着铁、成纤维细胞样滑膜细胞增生,对滑膜和软骨组织造成进一步破坏,在关节内出血后进行正常伤口愈合时大大地延长了正常的生理时间,导致了病理性的结果而不是生理性的修复。
本研究显示关节出血期TNF-α的mRNA表达水平明显升高,差异有统计学意义,而TNF-α血清蛋白可见升高,但差异无统计学意义,考虑本研究标本均用临床检测因子抑制物剩余标本,实验取血时间和标本收取存在困难,而TNF-α血清蛋白容易裂解,不稳定,故认为mRNA表达水平相对稳定,结果更加可信,故关节出血期TNF-α升高。
本研究显示急性关节出血期伴关节病变与不伴关节病变的患儿相比较,TNF-α的mRNA表达水平明显升高,且差异有统计学意义,而未见其他因子的升高,故认为TNF-α在关节病变时会升高,是关节病变形成的关键因子。
本研究还显示,关节出血慢性期TNF-α的mRNA高于无关节出血组,并且差异有统计学意义(P<0.05),而IL-1β、IL-6未见明显升高,可见TNF-α在急性期及慢性期持续升高,并且在伴关节病变的患儿中升高明显,故认为TNF-α是血友病慢性滑膜炎形成中的关键炎性因子,并且在慢性关节病变形成过程中可能发挥重要作用。
虽然血友病关节病变的机制仍不甚明确,但是人们逐渐认识到血友病关节病变是血友病患者关节腔内频繁出血引起的软骨退行性变和滑膜炎性反应[14-15],因此探讨关节病变和炎性反应因子的关系,可寻找有效控制关节病变进展的靶点药物,以提高血友病关节病变的防治水平。而本研究显示,关节出血后炎性反应因子释放升高,并且在关节出血慢性期仍可见TNF-α明显升高,同时伴关节病变的患儿的TNF-α表达水平较不伴关节病变者明显升高,故认为TNF-α可能参与了慢性关节病变的形成,而其他炎性反应性关节炎中,尤其是类风湿关节炎中,细胞因子TNF-α已经成为类风湿性关节炎的主要药物靶点,TNF-α抑制剂在临床中也广泛应用。因此,笔者期待如同目前已经应用于临床的类风湿关节炎的治疗一样,将TNF-α抗体用于血友病性关节病的治疗,为预防血友病性关节病变提供新的治疗方向和思路。
但本研究也存在局限性,本研究的入组患者的年龄并不均等,主要是急性出血期伴靶关节病变的患儿一般均为年龄较大患儿,故年龄出现明显不均等, 而儿童的细胞因子水平与年龄无关,故考虑本研究中年龄对于细胞因子水平的影响不大,同时本研究为横断面研究,未进行随访调查研究,且病例研究数量少,因此,需要前瞻性、大样本、动物实验等研究进一步证实。
结论:重型血友病A患儿关节出血急性期IL-1β、IL-6、TNF-α表达升高,以TNF-α升高为主,慢性期只见TNF-α表达升高,伴有关节病变的患儿TNF-α表达水平明显升高,故TNF-α是关节病变形成的关键因子。
[1] Haxaire C, Blobel C P. With blood in the joint-what happens next? Could activation of a pro-inflammatory signalling axis leading to iRhom2/TNF-α-convertase-dependent release of TNF-α contribute to haemophilic arthropathy?[J]. Haemophilia, 2014, 20(Suppl 4):11-14.
[2] Murdaca G, Spano F, Contatore M, et al. Potential use of TNF-α inhibitors in systemic sclerosis[J]. Immunotherapy, 2014, 6(3):283-289.
[3] Srivastava A, Brewer A K, Mauser-Bunschoten E P, et al. Guidelines for the management of hemophilia[J]. Haemophilia, 2013, 19(1):e1-e47.
[4] Narkbunnam N, Sun J, Hu G, et al. IL-6 receptor antagonist as adjunctive therapywith clotting factor replacement to protect against bleeding-induced arthropathy in hemophilia[J]. J Thromb Haemost, 2013, 11(5):881-893.
[5] Jansen N W, Roosendaal G, Hooiveld M J, et al. Interleukin-10 protects against blood-induced joint damage[J]. Br J Haematol, 2008, 142(6):953-961.
[6] Astermark J, Dolan G, Hilberg T, et al. Managing haemophilia for life: 4th haemophilia global summit[J]. Haemophilia, 2014, 20(Suppl 5):1-20.
[7] Øvlisen K, Kristensen A T, Jensen A L, et al. IL-1β, IL-6, KC and MCP-1 are elevated in synovial fluid from haemophilic mice with experimentally induced haemarthrosis[J]. Haemophilia, 2009, 15(3):802-810.
[8] Fischer K,van der Bom J G,Mauser Bunsehoten E P,et al. The effects of postponing prophylactic treatment on long-term outcome in patients with severe hemophilia[J].Blood,2002,99(7):2337-2341.
[9] Hermans C, De Moerloose P, Fischer K, et al. Management of acute haemarthrosis in haemophilia a without inhibitors: literature review, European survey and recommendations[J]. Haemophilia, 2011, 17(3):383-392.
[10] McCarthy A, Moore A, Redhead L, et al. Development of haemophilic arthropathy of the ankle: results of a Delphi consensus survey on potential contributory factors[J]. Haemophilia, 2014, 21(1):116-123.
[11] Ji H, Pettit A, Ohmura K, et al. Critical roles for interleukin 1 and tumor necrosis factor α in antibody-induced arthritis[J]. J Exp Med, 2002, 196(1): 77-85.
[12] Valentino L A. Blood‐induced joint disease: the pathophysiology of hemophilic arthropathy[J]. J Thromb Haemost, 2010, 8(9): 1895-1902.
[13] Forsyth A L, Rivard G E, Valentino L A, et al. Consequences of intra-articular bleeding in haemophilia: science to clinical practice and beyond[J]. Haemophilia, 2012, 18(Supple 4):112-119.
[14] 郝晓阳, 王霖虹,谢燕燕,等.血友病患者骨代谢相关生化指标及细胞因子特点的研究[J].中国煤炭工业医学杂志,2016,19(8):1108-1112.
[15] 郝晓阳,闫振宇.血友病性骨质疏松的研究进展[J].中国煤炭工业医学杂志,2016,19(1):167-170.

