CTLA-4与CD28在FⅧ抑制物阳性的血友病A患儿中的表达分析
李 杨 陈振萍 李 刚 甄英姿 吴心怡 吴润晖
(首都医科大学附属北京儿童医院血液肿瘤中心,北京 100045)
血友病A(hemophilia A, HA)是由于缺乏FⅧ导致的先天性出血性疾病,最主要的临床表现为自发性、难以控制的出血。凝血因子抑制物是在血友病替代治疗过程中产生的针对凝血因子的特异性抗体,是目前血友病治疗中最严重的合并症之一。重型血友病A患者抑制物发生率高达20%~30%,儿童是抑制物产生的高危人群;血友病B患者抑制物发生率<5%[1]。抑制物能特异性的中和外源性输注的凝血因子,不仅增加了出血的风险,而且使得替代治疗效果降低或无效。目前对于抑制物的产生没有预防性耐受治疗方法,对于抑制物阳性患者,尤其是有严重出血的患者,建议尽早开始进行免疫诱导耐受治疗(immune tolerance induce,ITI)。虽然免疫耐受治疗以及免疫抑制剂的治疗方案取得了一定的治疗成效,但是对于相关的免疫机制仍不清楚。对于抑制物产生及消除的过程中免疫系统调节状态的研究十分重要。
FⅧ抑制物的产生主要依赖Th细胞功能,抗原提呈细胞和B淋巴细胞共同作用[2]。T细胞上的CTLA-4/CD28是目前发现的最为重要的协同刺激分子之一,它们竞争性地与抗原提呈细胞上的B7分子结合,在调控和维持机体免疫状态的平衡中发挥重要作用。CD28分子表达在T细胞表面,激活和维持T细胞功能,CD28结合B7分子,产生激活T细胞的第二信号,刺激机体产生免疫应答。细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4),又称CD152,表达在包括调节性T细胞(regulatory T cells, Tregs)以及其他被激活的T细胞[3],与CD28分子竞争性结合B7分子,是体内重要的免疫负调控因子。CTLA-4与B7分子有很强的结合力,能够改变正常的T细胞激活,抑制了适当的免疫反应,促进肿瘤细胞的存活[4],作为重要的免疫调控因子,其在自身免疫性疾病、肿瘤及移植免疫中发挥重要作用。
目前对于血友病抑制物产生的免疫机制仍不清楚,导致抑制物的预防和治疗目前均无可靠全面的理论依据,本研究探讨在Th细胞上CTLA-4/CD28轴的平衡对血友病A儿童抑制物的作用,为进一步探索血友病A儿童FⅧ抑制物产生及消除过程中的免疫机制提供基础。
1 对象与方法
1.1 研究对象
收集自2016年12月1日至2018年1月1日于首都医科大学附属北京儿童医院血友病专业门诊进行治疗的血友病A患儿,入组标准为:1)年龄<18岁,男性;2)均已经确诊为中重型血友病A患儿,FⅧ∶C活性≤2%;3)在首都医科大学附属北京儿童医院血液肿瘤中心血检室连续两次检测血友病FⅧ抑制物为阳性(抑制物滴度≥0.6 BU/mL)或阴性(抑制物滴度<0.6 BU/mL),抑制物阴性患儿暴露日(exposure day, ED)均超过50 d。排除标准为:1)血友病A患儿,FⅧ∶C活性>2%;2)血友病B患儿;3)血友病FⅧ抑制物阴性患儿暴露日小于50天;4)伴有骨关节炎、风湿及类风湿关节病、银屑病、混合性结缔组织病等自身免疫系统疾病。
本研究内容征得入组患儿监护人的知情同意,研究方案获得首都医科大学附属北京儿童医院伦理委员会的批准。
1.2 FⅧ抑制物检测[5-6]
FⅧ抑制物滴度检测应用改良Nijmegen法。检测前经过72 h洗脱期,连续2次检测滴度≥0.6 BU/mL定义为抑制物阳性,<0.6 BU/mL定义为抑制物阴性。
1.3 CD28+Th细胞检测
应用流式细胞术检测患儿外周血CD28+Th细胞。外周全血中加入流式抗体:anti-CD3-PerCP (BD公司,美国)、anti-CD4-FITC (BD公司,美国)、anti-CD28-PE (Milteny公司,德国),室温避光孵育20 min,红细胞裂解液(BD FACS Lysing Solution,美国)溶解红细胞10 min,所有样本设置对照管,洗涤后上机分析。
1.4 CTLA-4+Th细胞检测
应用流式细胞术检测患儿外周血CTLA-4+Th细胞。外周全血分离单个活细胞,应用植物血凝素(PHA,Sigma Aldrich©, Saint Louis, 美国)10 μg/mL 刺激培养48 h。刺激后细胞加入流式抗体:anti-CD3-PerCP, anti-CD4-FITC,室温避光孵育20 min,加入破膜固定工作液[FoxP3 Fixation/Permeabilization concentrate体积∶FoxP3 Fixation/Permeabilization Diluent(4 ℃保存)体积=1∶3]避光孵育1 h,洗涤后加入anti-CTLA-4-PE抗体(BD公司,美国),避光孵育40 min,所有样本均设置对照管,洗涤后上机分析。
1.5 统计学方法
2 结果
2.1 入组情况
共计入组58例患儿,入组患儿均为中重型血友病A(FⅧ∶C活性≤2%)患儿,其中抑制物阳性患儿28例,中位月龄为41(14~158)个月;中位抑制物滴度为18.10(1.00~100.00)BU/mL;抑制物阴性患儿30例,月龄为72(6~199)个月,所有抑制物阴性患儿均超过50个暴露日。
2.2 血友病FⅧ抑制物阳性组与阴性组患儿外周血CTLA-4+Th、CD28+Th细胞的表达情况
抑制物阳性组患儿外周血CD28+Th细胞表达与阴性组差异无统计学意义(P=0.065);血友病FⅧ抑制物阳性组患儿外周血的CTLA-4+Th细胞表达百分比低于阴性组患儿(P=0.038),差异具有统计学意义;血友病FⅧ抑制物阳性组患儿CTLA-4/CD28细胞表达百分比比值低于阴性组(P=0.042),差异具有统计学意义,数据在Th细胞门下记录统计,详见表1、图1。
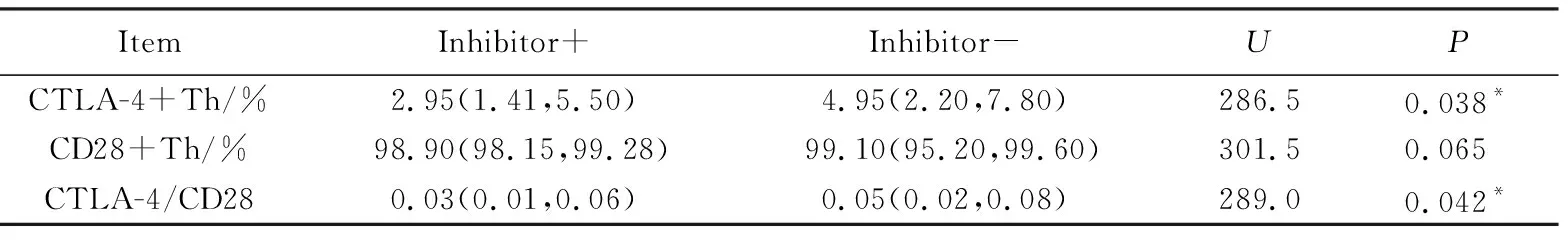
表1 抑制物阴性组与阳性组相关免疫细胞表达Tab.1 Immune cells in inhibitor negative and positive group M(P25,P75)

图1 抑制物阳性组与阴性组相关免疫细胞的表达Fig.1 Immune cells in inhibitor negative and positive group
A:There was no difference in the proportion of CD28+Th cells in peripheral blood between inhibitor positive group (n=28) and inhibitor negative group(n=30);B:There was significant difference in the proportion of CTLA-4+Th cells in peripheral blood between inhibitor positive group (n=28) and inhibitor negative group(n=30);C:There was significant difference in the proportion of CTLA-4/CD28 in peripheral blood between inhibitor positive group (n=28) and inhibitor negative group (n=30)*P<0.01;ns:no significance..
2.3 血友病FⅧ抑制物低滴度组和抑制物高滴度组CTLA-4+Th、CD28+Th细胞表达情况
因为FⅧ抑制物滴度的不同会导致抑制物消除治疗的效果存在差异。将抑制物阳性组分为低滴度组(滴度<40 BU/mL)和高滴度组(滴度≥40 BU/mL),比较血友病FⅧ抑制物低滴度组和抑制物高滴度组CTLA-4+Th细胞、CD28+Th细胞在外周血中的比例情况。
低滴度组患儿抑制物滴度为12.30(1.02~35.20)BU/mL,高滴度组滴度为59.20(43.20~100.00)BU/mL。研究结果显示,CD28+Th细胞及CTLA-4+Th细胞的表达百分比和CTLA-4/CD28比值在两组间差异无统计学意义。详见表2。
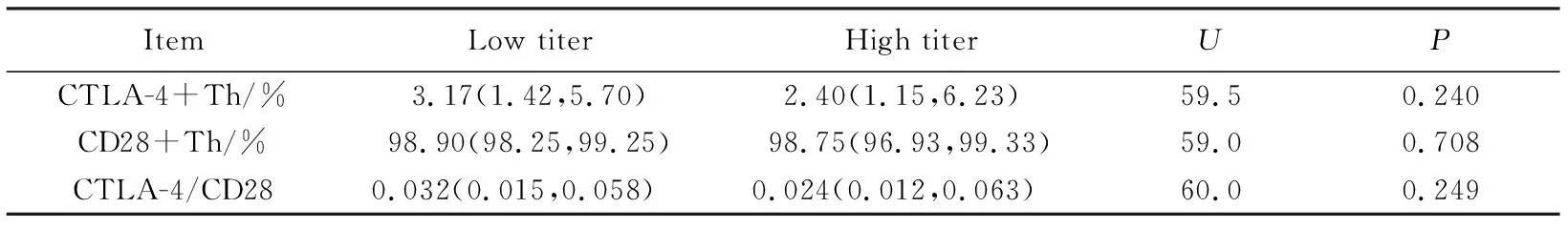
表2 相关免疫细胞在低滴度和高滴度组的表达Tab.2 Immune cells in low titer inhibitor and high titer inhibitor group M(P25,P75)
3 讨论
血友病A是X性染色体连锁遗传的出血性疾病,临床以自发性出血为主要临床表现,主要为男性发病,女性携带,发病率在活产男婴中为0.5/10 000[7]。目前最为有效的治疗方式为外源性凝血因子制剂的替代治疗,根据患者的疾病类型及出血的轻重程度,补充凝血因子。随着诊断水平的提高、药品供应的增加以及社会关注程度的加强,中国血友病A儿童从诊断、治疗到康复及护理等多方面的医疗水平均得到很大程度的提高,极大的改善了中国血友病儿童的生活质量,显著降低了中国血友病A儿童由于关节、肌肉出血引起的残疾,甚至是由于严重、大量出血导致的死亡[8]。
目前,替代治疗过程中血友病FⅧ抑制物的产生问题成为目前血友病治疗中最大的“拦路虎”之一。无论是内外源性凝血因子的替代治疗还是基因治疗,血友病凝血因子抑制物的产生都是挑战[1]。在不同研究[9-11]中,血友病凝血因子FⅧ抑制物阳性率为5%~30%,而血友病FⅨ抑制物阳性率远低于FⅧ,目前有研究显示低于3%。儿童是抑制物发生的高危人群,同样也是预防和治疗抑制物的重要群体。中国血友病A儿童的抑制物产生率为20%~30%[12-13]。根据临床研究及流行病学的分析,血友病A抑制物的产生受到多方面因素的共同影响。首先是遗传因素,抑制物的产生受到种族、家族史、FⅧ基因突变类型和细胞表面分子的遗传易感性等影响[10-11,14-16];同样,抑制物的形成还受到非遗传因素的影响,包括治疗方案、治疗强度、初次治疗的年龄、治疗使用药品的类型(重组或血浆源性),研究[17]表明,强烈的FⅧ暴露,尤其生命早期的严重出血、手术、肿瘤、免疫、炎性反应、感染等事件,也是导致抑制物形成的重要原因。
T细胞的活化过程为免疫性疾病的治疗提供了思路和方法,共刺激通路作为T细胞活化的重要方式,其通路上的拮抗剂可以诱导抗原特异性耐受,从而防止自身免疫性疾病和器官移植中排异反应的发展[18]。T细胞的完全激活需要双重信号,第一个信号抗原呈递细胞(antigen presenting cell, APC)上肽-主要组织相容性复合物与T细胞受体连接;第二信号则来源于T细胞表面与APC表面的共刺激分子的相互作用[19]。目前认识较多的共刺激通路分子包括CD28、CTLA-4、B7-1(CD80)、B7-2(CD86)等。
CTLA-4和CD28是表达在CD4+T细胞和CD8+T细胞的同源受体,介导T细胞活化中的相反功能[20]。CD28作为T细胞表面主要的辅助受体分子,其在APC上的配体为B7-1(CD80)、B7-2(CD86)。CD28在确定T细胞活性以及敏感性上发挥关键作用[19],CD28对于控制自身免疫性疾病的调节性T细胞的发育和体内平衡非常重要[21]。而CTLA-4作为重要的负调控因子,在自身免疫性疾病和移植排异反应中发挥着显著的负调控作用。CTLA-4多表达在Foxp3+T细胞和活化的T细胞内,实验[20]证实,敲除CTLA-4基因的小鼠会发生自身反应性T细胞释放导致的致死性自身免疫反应。而CTLA-4/CD28在T细胞表达的平衡是T细胞相关免疫正常的重要因素。
在本研究结果中,CTLA-4/CD28比值在血友病A抑制物阳性患儿表达显著低于抑制物阴性患儿,差异具有统计学意义,说明在血友病A抑制物阳性患儿中存在T细胞免疫功能的异常;然而研究结果显示,两组患儿的CD28+Th细胞表达差异无统计学意义,说明上述平衡轴的差异主要由CTLA-4+Th细胞表达的差异引起,比值与外周血CTLA-4+Th细胞的表达百分比具有很高的相关性CTLA-4/CD28轴的失衡与血友病FⅧ抑制物的产生,主要是由于CTLA-4+Th细胞的表达不足。CTLA-4主要发挥免疫负调控作用,笔者对血友病A患儿的研究表明,CTLA-4的表达不足,导致机体T细胞相关的免疫功能在激活后不能得到有效的负向调控,不能及时有效的压制激活的T细胞,在T细胞的刺激下,诱导FⅧ抑制物的产生。CTLA-4途径是机体调控免疫稳态所必需的途径,与Treg细胞的负调控作用是近些年对于免疫负调控研究的热点问题,尤其是在肿瘤的免疫性治疗、移植排异反应和自身免疫相关的疾病中[22]。有学者[23]认为,Treg通常是通过CTLA-4发挥抑制作用,但是CTLA-4也可以在非Treg中发挥作用, Foxp3和CTLA-4可直接指导独立的免疫调节途经,实际上在很大程度上重叠,这些想法有望帮助我们更好地了解这些途径的潜在生物学和治疗意义。
CD28主要表达在CD4+T和CD8+T细胞,发挥激活T细胞的功能。CTLA-4表达在激活的T细胞,主要发挥免疫抑制作用。CD28与CTLA-4与抗原呈递细胞上的CD80和CD86结合,人类CD28和CTLA-4也可以与ICOS(inducible costimulatory molecale)配体结合[3]。Wiest等[4]在特异性哮喘的研究中发现,哮喘严重程度与CD4+CTLA-4+T细胞的表达成反比,即CD4+CTLA-4+T细胞表达越低,哮喘越严重。CTLA-4没有起到足够的负调控功能,不能控制导致炎性反应。
结论:CTLA-4/CD28轴在维持机体免疫稳定中发挥重要作用。在血友病FⅧ抑制物阳性患儿,CTLA-4/CD28轴的平衡情况与阴性组存在差异,其细胞表达比值显著低于抑制物阴性组,并且主要是由于CTLA-4+Th细胞的低表达引起。研究结果表明,CTLA-4可能是血友病FⅧ抑制物产生的免疫影响因素之一。
[1] Sun J, Yuan Z, Abajas Y L, et al. A retrospective study of the cytokine profile changes in mice with FⅧ inhibitor development after adeno-associated virus-mediated gene therapy in a hemophilia a mouse model[J]. Human Gene Therapy, 2018,29(3): 381-389.
[2] Astermark J. Inhibitor development: patient-determined risk factors[J]. Haemophilia, 2010, 16(102): 66-70.
[3] Gardner D, Jeffery L E, Sansom D M. Understanding the CD28/CTLA-4 (CD152) pathway and its implications for costimulatory blockade[J]. Am J Transplant, 2014, 14(9): 1985-1991.
[4] Wiest M, Upchurch K, Yin W, et al. Clinical implications of CD4+T cell subsets in adult atopic asthma patients[J]. Allergy Asthma Clin Immunol, 2018, 14:7.
[5] 李刚,陈振萍,甄英姿,等. 血友病A患儿血浆纠正实验与凝血因子Ⅷ抑制物相关性研究[J]. 中华检验医学杂志,2015,38(7): 480-483.
[6] 李刚,陈振萍,唐凌,等. 血浆纠正试验差值在血友病 A 患儿抑制物中的诊断价值[J]. 检验医学与临床,2015(23): 3451-3452, 3455.
[7] 周敏,唐凌,吴润晖,等. 中国儿童血友病诊断现状多中心研究[J]. 中华实用儿科临床杂志,2017,32(5): 361-364.
[8] 王天有,吴润晖. 迈进儿童血友病关怀新时代[J]. 中国实用儿科杂志,2017,33(1): 18-22.
[9] 王莹,王京华. 血友病A凝血因子Ⅷ抑制物的形成因素和治疗[J]. 临床荟萃,2014,29(1): 101-104.
[10] 魏琪琪,吴润晖. 血友病患者的免疫耐受诱导治疗:依据及前景[J]. 血栓与止血学,2014,20(4): 209-214.
[11] 吴润晖,魏琪琪. 血友病抑制物的产生与防治对策[J]. 中华儿科杂志,2013,51(8): 631-634.
[12] Yao W, Xiao J, Cheng X, et al. The efficacy of recombinant FⅧ low-dose prophylaxis in Chinese pediatric patients with severe hemophilia a: a retrospective analysis from the reCARE study[J]. Clin Appl Thrombo/Hemost, 2016, 23(7): 851-858.
[13] 魏琪琪,唐凌,陈振萍,等. 单中心儿童血友病A抑制物累积发生率及危险因素[J]. 中华实用儿科临床杂志,2017,23(7): 851-858.
[14] Collins P W, Chalmers E, Hart D P, et al. Diagnosis and treatment of factor Ⅷ and IX inhibitors in congenital haemophilia: (4th edition). UK Haemophilia Centre Doctors Organization[J]. Br J Haematol, 2013, 160(2): 153-170.
[15] Viel K R, Ameri A, Abshire T C, et al. Inhibitors of factor Ⅷ in black patients with hemophilia[J]. N Engl J Med, 2009, 360(16): 1618-1627.
[16] Chuansumrit A, Sasanakul W, Sirachainan N, et al. Association of factor Ⅷ and factor IX mutations, HLA Class Ⅱ, tumour necrosis factor-alpha and interleukin-10 on inhibitor development among Thai haemophilia A and B patients[J]. Haemophilia, 2017, 23(6): e518-e523.
[17] Gouw S C, van den Berg H M, Fischer K, et al. Intensity of factor Ⅷ treatment and inhibitor development in children with severe hemophilia A: the RODIN study[J]. Blood, 2013, 121(20): 4046-4055.
[18] Salomon B, Bluestone J A. Complexities of CD28/B7: CTLA-4 costimulatory pathways in autoimmunity and transplantation[J]. Annu Rev Immunol, 2001, 19: 225-252.
[19] Zumerle S, Molon B, Viola A. Membrane rafts in T cell activation: a spotlight on CD28 Costimulation[J]. Front Immunol, 2017, 8: 1467.
[20] Rowshanravan B, Halliday N, Sansom D M. CTLA-4: a moving target in immunotherapy[J]. Blood, 2018, 131(1): 58-67.
[21] Salomon B, Lenschow D J, Rhee L, et al. B7/CD28 costimulation is essential for the homeostasis of the CD4+CD25+immunoregulatory T cells that control autoimmune diabetes[J]. Immunity, 2000, 12(4): 431-440.
[22] 张晓慧, 刘新, 白丽,等. 肝脏CD4+CD25+Foxp3+调节性T细胞在小鼠急、慢性肝损伤中的表达差异及意义[J] 首都医科大学学报, 2014, 35(4):483-487.
[23] Walker L S. Treg and CTLA-4: Two intertwining pathways to immune tolerance[J]. J Autoimmun, 2013, 45: 49-57.

