定悸方对阵发性房颤炎症因子及心肌纤维化影响*
黄 瑶,张振贤,陈若宏,丁阅异,陈 敏
心房颤动是临床上常见的心律失常,常导致脑卒中、心力衰竭及致死等严重临床事件。流行病学研究显示,发达国家房颤目前患病率为1%,中国总患病率为0.61%。近年来的研究发现房颤与炎症因子超敏 C-反应蛋白(hs-CRP)[1]、白介素-6(IL-6)[2]、肿瘤坏死因子-α(TNF-α)[3-4]密切相关,炎症学说在阐明房颤的发生与维持的机制方面具有重要的意义。
目前对于房颤的治疗不仅提倡要降低其发病率、死亡率,而且应积极地预防和治疗阵发性房颤,消除患者临床症状,消除心室重构,延缓心房重建,阻止阵发性房颤向持续性房颤发展[5]。近年中医药治疗房颤取得较为满意的疗效,益气养阴化瘀的治法能降低炎症因子水平。课题组在总结前人经验基础上,提出“益气养阴,活血祛风”法治疗气阴两虚型阵发性房颤,创立了定悸方[6]。本研究主要观察和评价定悸方对阵发性房颤炎症因子表达及心肌纤维化的影响。
1 材料与方法
1.1 一般材料 2014—2015年上海中医药大学附属岳阳医院门诊及住院患者,共入选房颤患者60例,对照组女 17例,男 13例,平均年龄(72.96±6.8)岁,平均病程(55.28±15.3)个月;治疗组女14 例,男 16 例,平均年龄(72.46±7.1)岁,平均病程(54.82±16.7)个月。治疗组与对照组采用随机数字表法进行分组,对照组和治疗组两组人群在年龄、性别、心功能等指标无显著性差异(P>0.05)。
1.2 纳入标准 1)符合阵发性房颤诊断标准及中医心悸气阴两虚证标准者。2)性别不限,年龄18~80周岁。3)经临床评估合格,排除因心肌炎、心肌病及其他非心血管疾病引起的阵发性房颤。4)知情同意,自愿参加临床试验。
1.3 诊断标准
1.3.1 西医诊断标准
1.3.1.1 房颤诊断标准 参照人民卫生出版社2013年版《内科学》[7]。
1.3.1.2 阵发性房颤诊断标准 持续时间7 d以内(大多数>24 h),能自行终止的房颤发作,可反复发作。
1.3.2 中医诊断标准 参照国际药品监督管理局2002年《中药新药临床研究指导原则》[8];中医药学会发布《中医内科常见病诊疗指南》[9]。气阴两虚证:主症:心悸。次症:气短,体倦乏力,少寐多梦,心烦,自汗盗汗,口干。舌脉:舌红,少苔,脉细数无力。
1.4 排除标准 1)年龄在18周岁以下或60周岁以上者。2)合并慢性阻塞性肺疾病、甲状腺功能亢进和嗜铬细胞瘤者。3)适合进行ICD(植入型体内自动除颤器)或射频消融术患者。4)有肝、肾、肺脏病变、血液病变、肿瘤或其他代谢疾病。5)严重心衰,心功能3级以上。6)妊娠期女性、分娩不足1 a者、外科手术不足 1 a者。7)心率<60 次/分。8)已接受其他有关治疗,可能影响本研究的效应指标观察者。9)已知对试验药物成分过敏者。
1.5 剔除和脱落标准 1)不符合纳入标准或符合排除标准者。2)受试者依从性差,不能按时按疗程完成中药治疗者。3)治疗过程中出现过敏反应或严重不良事件者。
1.6 治疗方法 两组患者均给予常规西医治疗:1)节律控制:所用药物为普罗帕酮。2)室率控制:所用药物为地高辛或β受体阻滞剂。3)抗凝治疗:根据CHADS2危险因素评分分级,评分大于等于2分即应接受华法林抗凝治疗,对于不适合口服华法林抗凝的房颤患者,可考虑在服用阿司匹林的基础上加用氯吡格雷。4)上游干预:包括基础病治疗,血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)类药物抑制心室重构等。
对照组仅采用常规西医治疗;定悸方联合治疗组在常规西医治疗的基础上,给予定悸方(黄芪、葛根、麦门冬、益母草、川芎、徐长卿、瓜蒌、苦参等),并按期随访,治疗时间为8周。
1.7 评价指标
1.7.1 主要效应指标 以房颤是否转复窦性心律、发作次数、心率控制来判定疗效[10],分显效、有效、无效、加重等。总有效率=(显效+有效)/总例数×100%。
1.7.2 次要效应指标 中医证候疗效评价标准采用尼莫地平法以百分数表示,分临床显效、有效、无效、加重等。总有效率=(显效+有效)/总例数×100%。1.7.3 干预指标 实验室指标包括:hs-CRP、TNF-α、IL-6(试验前及服药8周后进行检测);左房内径及左室功能(于试验前及治疗后8周及半年进行检测)。
1.8 统计学处理 采用SPSS 19.0进行统计分析。计量资料若数据服从正态分布,数据以均数±标准差(x±s)表示,组内治疗前后比较采用配对t检验,组间比较采用两独立样本t检验;计数资料组间比较采用卡方检验;相关性分析采用Pearson线性相关分析。P<0.05为差异有统计学意义。
2 研究结果
2.1 主要效应指标 经检验,治疗组与对照组比较,总有效率无统计学差异(P>0.05),见表 1。
2.2 次要疗效指标 经检验,治疗组中医证候积分总有效率高于对照组,有统计学差异(P<0.01),见表2。
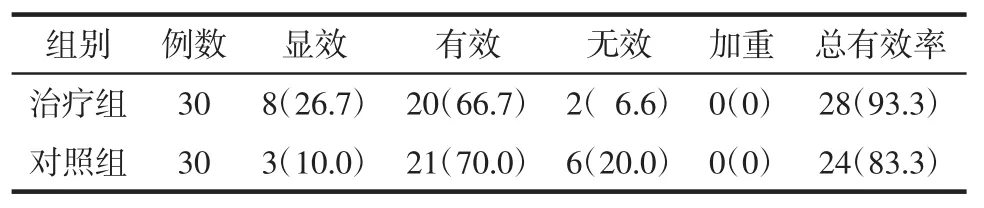
表1 治疗组和对照组总有效率比较Tab.1 Comparison of curative effect rate between treatment group and control group 例(%)
2.3 干预指标
2.3.1 房颤炎症因子水平与左房内径的相关性分析 房颤患者hs-CRP与左房内径呈正相关(r=0.572,P<0.001),见图 1;房颤患者 IL-6 与左房内径呈高度正相关(r=0.806,P<0.001),见图 2。

表2 治疗组和对照组中医证候积分总有效率比较Tab.2 Comparison of traditional Chinese medicine syndrome score effective rate between treatment group and control group 例(%)
2.3.2 血清炎症因子指标比较 经检验,两组患者经治疗后血清hs-CRP、IL-6均显著低于治疗前(P<0.05)。治疗组血清 hs-CRP、IL-6 均低于对照组,且有统计学差异(P<0.05),见表 3。
2.3.3 左房内径及左室功能比较 经检验,治疗前后两组的左房内径、LVEF、FS值均无明显统计学差异(P>0.05)。随访半年后,两组 LVEF、FS 值均比治疗前显著升高,具有统计学差异(P<0.05),且治疗组LVEF 值较对照组升高更为明显(P<0.05);治疗组左房内径较治疗前有明显减小趋势,其差异具有统计学意义(P<0.05),对照组则与治疗前无明显差异,见表4。
3 分析和讨论
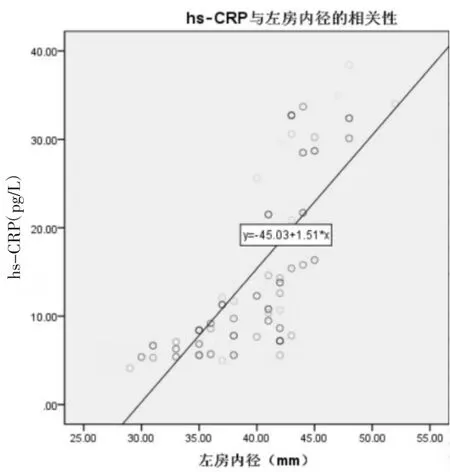
图1 左房内径与hs-CRP的相关性分析Fig.1 Analysis of correlation between left atrial diameter and hs-CRP
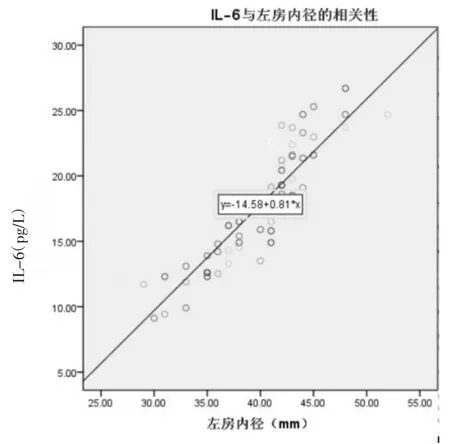
图2 左房内径与IL-6的相关性分析Fig.2 Analysis of correlation between left atrial diameter and IL-6

表3 治疗前后血清hs-CRP、IL-6、TNF-α水平比较Tab.3 Comparison of blood serum hs-CRP,IL-6,TNF-α before and after treatment
研究发现,炎症因子hs-CRP、IL-6及TNF-α与房颤的发生密切相关。其中,hs-CRP是房颤的独立预测因素,其水平升高能预测未来发生心房颤动的潜在危险性[11];IL-6水平越高,则房颤越易被诱发,房颤持续时间越长[12];TNF-α可引发血管局部急性炎症反应而损害内皮细胞进而引起心肌纤维化[13]。在阵发性房颤、持续性房颤及永久性房颤间,炎症因子hs-CRP、IL-6呈阶梯型显著升高。
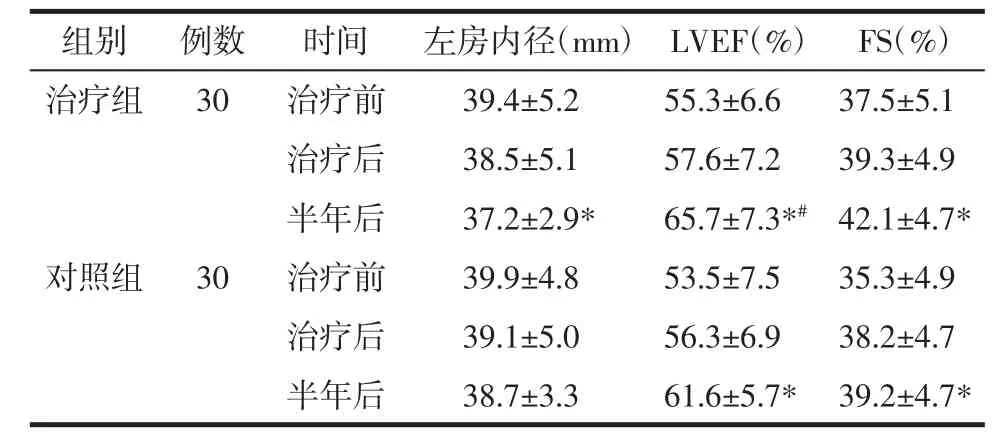
表4 两组左房内径、LVEF、FS比较Tab.4 Comparison of left atrial diameter,LVEF,FS between two groups
本研究证实了阵发性房颤发生时伴随炎症标记物显著增高现象,并随症状改善下降。治疗后,治疗组总有效率显著高于对照组。本次研究还对纳入病例随访半年,观察两组患者左房内径变化情况,发现治疗组相对于对照组的左房内径大小较治疗前减小趋势更为明显,其LVEF值较西药组升高更为显著。可见对于已存在左房结构改变、左房内径接近或超过正常值范围的房颤患者,结合定悸方治疗能更加有效地控制及改善左房结构的改变。
房颤在中医学中属于心悸、怔忡等范畴,临床治疗上多以益气养阴,活血化瘀为大法,课题组观察到房颤的发病具有节律快而多变、感时而发、容易复发、传变迅速等特点与中医“风”特征相似,因此在益气养阴,活血化瘀基础上,加用风药,创立益气养阴、活血祛风的定悸方,经临床运用,疗效良好。全方由黄芪、葛根、麦门冬、益母草、川芎、徐长卿、苦参、瓜蒌[7]等组成。其中黄芪为君药,可补中益气,中气得补,心气可充;麦门冬、葛根共为臣药,可滋心阴、养心血;佐之益母草活血祛瘀,川芎活血行气、祛风止痛,徐长卿祛风止痛、活血解毒;配合瓜蒌宽胸散结化痰,苦参燥湿清热。诸药合用益气养阴、活血祛风、清热化痰,以补益心之气血阴阳亏耗之本,重祛风邪化瘀血,兼清痰热之标,使气血充盈,阳气畅达,虚风自止,心神得宁。现代药理研究显示,黄芪皂苷具有抗心律失常作用,黄芪甲甙可以抑制转化生长因子-β1(TGF-β1)的表达,具有抗心肌纤维化作用[14]。葛根素可促进内皮细胞修复再生[15]。麦门冬总皂苷可降低右心房肌自律性及兴奋性[16]。益母草碱具有抑制炎症因子的作用,川芎嗪具有类钙离子通道阻断剂作用[17]。徐长卿可用于抑制免疫反应、改善炎症反应,对心房纤维化或有良好的抑制修复疗效。苦参碱对TNF-α、IL-6有明显的抑制作用[18]。
基于益气养阴、活血祛风法的定悸方,具有改善患者临床症状、抑制血清炎症因子以及逆转心房重构的作用,该作用机制可能为定悸方降低了房颤患者血清炎症因子水平从而抑制心肌纤维化进程。本方切中房颤患者病因病机,在传统治疗基础上加用风药,疗效良好,具有重要临床运用价值。
[1] 周自强,胡大一,陈 捷,等.中国心房颤动现状的流行病学研究[J].中华内科杂志,2004,43(7):491-494.
[2] 徐梅华,蔡克银.高敏C反应蛋白及白细胞介素6在心房颤动并发血栓中的意义[J].临床心血管病杂志,2013,29(3):171-173.
[3] Engel D,Peshock R,Robert C,et al.Cardiac myocyte apoptosis provokes adverse cardiac remodeling in transgenic mice with targeted TNF overexpression[J].A J P-Heart,2004,287(7):1303.
[4] 王长华,胡大一,汤楚中,等.风湿性心脏瓣膜病慢性心房颤动患者白细胞介素-1β和肿瘤坏死因子-α蛋白表达的研究[J].中华心血管病杂志,2005,33(6):522-525.
[5] 陈 新,张 澍,胡大一,等.心房颤动:目前认识和治疗建议[J].中华心律失常学杂志,2001,5(2):69-94.
[6] 张振贤,张 洁,江艳芬,等.定悸方对冠心病早搏的临床观察[J].辽宁中医杂志,2014,4(41):681-683.
[7] 葛均波,徐永健.内科学[M].第8版.北京:人民卫生出版社,2013.
[8] 郑筱萸.中药新药临床研究指导原则[S].北京:中国医药科技出版社,2002.
[9] 中华中医药学会.中医内科常见病诊疗指南(中医病证部分)[M].北京:中国中医药出版社,2008.
[10]全国中西医结合防治冠心病,心绞痛,心律失常研究座谈会.常见心律失常病因,严重程度及疗效参考标准[J].医学情报资料,1980,1:16.
[11]Demcllis J,Panareton M.C-reation protein and paroxysmal process in paroxysmal atrial fibrillation:evidence of the implication of an inflammatory process in paroxysmal atrial fibrillation[J].Acta Cardiol,2002,58(1):43-44.
[12]Loricchio Ml,C ianfrocca C,Pasceri V,et al.Relation of C-reactive protein to long-term risk of recurrence of atrial fibrillation after electrical cardioversion[J].Am J Cardiol,2007,99:1421.
[13]Psychari SN,APoetolou TS,Sinos L,et al.Relation of elevated C-reactive protein and Interle-Iukin-6 levels to left atrial size and durationofepisodesinpatientswithatrialfibrillation[J].Am J Cardiol 2005,95(5):764-767.
[14]张召才,李双杰,杨英珍,等.黄芪甲甙对慢性心肌炎心肌纤维化的影响[J].中国中西医结合杂志,2007,27(8):728-731.
[15]刘永录,赵引娣,杨会池.葛根保健作用的化学及药理学基础研究近况[J].河北中医,2008,30(4):435-437.
[16]于学康.麦冬的药理作用研究进展[J].天津药学,2012,24(4):69-70.
[17]舒 冰,周重建,马迎辉,等.中药川芎中有效成分的药理作用研究进展[J].中国药理学通报,2006,22(9):1043-1047.
[18]周秀梅,陈 璇.中药苦参防治心肌纤维化的药理学机制[J].中国科技信息,2011,23(21):83.

