双水相萃取法提取紫花油豆中凝集素
□ 鲍宗源 布振钱 郝晓妤 吕晓萌 孙靖莹 东北农业大学理学院
由于能够特异性结合单糖、多糖和糖蛋白,植物凝集素在医学、材料科学和农学方面发挥了巨大的作用和价值[1]。紫花油豆(菜豆)是我国东北地区分布的一种地方性物种。其中蛋白质含量达20%以上。这些蛋白质其合理的氨基酸组成和较高的凝集素含量,使其具有较高的营养价值和生物学价值。
作为传统的蛋白质分离方法,硫酸铵沉淀法也用于提取凝集素。此方法的缺点是它耗时长且产量低[2]。亲和层析法大大提高了凝集素的产量,但其工业化成本高且难以扩大生产[3]。因此,建立一种快速、经济高效的凝集素提取方法,以提高选择性和产量,降低成本尤为重要。
目前,双水相提取技术也被尝试用于分离纯化凝集素。2010年,Nascimento[4]研究了Canavaliabrasiliensis凝集素(ConBr )在PEG600/磷酸盐体系以及PEG600/柠檬酸钠体系中的分配。Soares[5]研 究 了 在 PEG8000/柠檬酸盐体系中,从Canavaliaensiformis种子的粗提取物中提取和纯化ConcanavalinA(ConA)。Nascimento[6]采用PEG8000/柠檬酸钠体系从Cratyliamollis种子中提取凝集素。结果表明,PEG/盐双水相体系在提取凝集素方面具有很大的优势。
本项研究,以PEG600/(NH4)2SO4双水相体系作为提取工具,以紫花油豆为原料,建立一种直接从豆类粗提液中提取凝集素的方法。
1 材料与方法
1.1 材料及试剂
紫花油豆种子,哈尔滨香坊区贡宾种子公司;聚乙二醇600(PEG600),天津致远化学试剂有限公司;氢氧化钠,天津市耀华化学试剂有限公司;氯化钠(分析纯),天津市凯通化学试剂有限公司;硫酸铵(分析纯),上海成捷化学有限公司;福林酚试剂(分析纯)、牛血清白蛋白,北京索莱宝科技有限公司。
1.2 仪器与设备
紫外可见分光光度计(型号:T6新世纪)/北京普析通用仪器有限责任公司;电泳试剂盒/北京索莱宝科技有限公司;Mini-PROTEAN电泳仪/Bio-RAD公司。
1.3 试验方法
1.3.1 凝集素的粗提取
挑选籽粒饱满的紫花油豆种子,用粉碎机粉碎,将充分粉碎后的紫花油豆种子过50目筛,得到的粉状物用1∶6(w/v)石油醚脱脂处理,重复3次后在4℃下使用0.02mol/L磷酸盐溶液浸提12 h,浸提液离心,10 000 rpm离心35min,得到的上清液作为双水相提取的原料,4℃储存。
1.3.2 双水相萃取
将 90%(w/w)PEG600溶 液、25%(w/w)(NH4)2SO4溶 液、1mL粗提液依次加入10mL带有刻度的玻璃离心管中,使体系总体积为5mL,再加入NaCl固体,置于涡流混匀器上混匀后,使用NaOH溶液调节体系的pH值,在2000g离心10min后完成相分离。测量相体积后,收集上相以测定蛋白质浓度和进行电泳分析。
1.3.3 Folin's酚法测定凝集素的含量
使用BSA(牛血清白蛋白)作为标准,在650nm读取样品的吸光度。
1.3.4 测定血凝活性
在微量滴定板中进行凝血活性(HA)的测定。将凝集素(50μL)用中风生理盐水溶液进行2倍系列稀释,添加50μL的2%兔红细胞悬浮液。当阴性对照完全沉积时,在室温下45 min后读取结果。
1.3.5 凝集素特异性活力计算

式中:H代表特异性活力,Ct代表粗蛋白溶液中蛋白质的浓度。
1.3.6 双水相体系参数的定义

式中:Ks代表上相蛋白得率,Cs代表上相蛋白浓度,Vs代表上相蛋白体积,mt代表粗蛋白质量,Hs代表上相蛋白特异性活力,Ht代表粗蛋白特异性活力,Gs代表上相蛋白纯化倍数。
2 双水相单因素试验结果与分析
2.1 (NH4)2SO4质量分数对提取效果的影响
不同浓度(NH4)2SO4上相纯化倍数和得率,如图1所示。
由图1可知,上相蛋白得率与纯化倍数随着(NH4)2SO4质量分数的增加而增加,当(NH4)2SO4达到25%时纯化倍数与蛋白得率达到最大值,随着(NH4)2SO4继续增加,上相蛋白得率与纯化倍数呈下降趋势。分析其原因为:当(NH4)2SO4为15%时,由于体系中离子强度较低两相之间的疏水作用力差异性较小,此时蛋白大部分分配到盐相;随着(NH4)2SO4的增加,体系中离子强度增加,疏水作用力增强,蛋白在盐相中的溶解性降低,迫使蛋白由下相向上相移动,所以上相蛋白得率和纯化倍数都逐渐增加,当(NH4)2SO4为25%时二者达到最大值。当(NH4)2SO4大于25%时,高浓度的盐溶液会破坏蛋白表面水化膜,蛋白溶解度降低,使部分凝集素蛋白沉淀出来,所以上相蛋白得率与纯化倍数降低。
2.2 PEG600质量分数对提取效果的影响
不同浓度PEG600上相纯化倍数与得率,如图2所示。
由图2可知,上相蛋白得率与纯化倍数随PEG600增加而增加,当PEG600为90%时二者达到最大值,之后随着PEG600的继续增加,上相蛋白得率与纯化倍数呈下降趋势。当PEG600为50%时,不能够形成双水相体系;当PEG600为60%时,两相之间疏水作用力差异性较小,PEG600相剥夺水分子能力弱,下相中盐离子浓度较小,下相中盐析作用较小,不能推动蛋白由一相向另一相移动;随着PEG600的增加,PEG600相剥夺水分子能力增强,上相体积增大,下相体积减小,两相之间疏水作用力增大,促使凝集素蛋白由下相向上相移动,使上相蛋白得率与纯化倍数随之增加;当PEG600为100%时,上相中的空间斥力作用加强,体系的黏度增加,下相中的凝集素蛋白分子停留在两相界面处,在两相之间形成一层乳化层,从而阻碍了凝集素蛋白分子在相间的传递和扩散,降低了上相蛋白得率与纯化倍数。
2.3 pH值对提取效果的影响
不同pH值上相纯化倍数与得率,如图3所示。
由图3可知,上相蛋白得率与纯化倍数随pH值增加而上升,在pH为7.5时上线蛋白得率与纯化倍数达到最大,之后随着pH值增大,上线蛋白得率与纯化倍数同时下降。pH值的变化一方面影响盐离子的种类,另一当面改变蛋白质所带电荷的状态,当pH值较低时,体系pH值处在凝集素蛋白的等电点附近,凝集素蛋白聚集在一起,形成沉淀,同时两相之间不能形成跨越界面的电位差,不能促使凝集素蛋白从一相向另一相移动;随着pH值的增加,体系pH值远离蛋白的等电点,两相之间蛋白分配越不均匀越有利于蛋白从一相向另一相移动,当pH值达到7.5时两者达到最大值;随着pH值的继续增大,碱性条件下铵根离子与氢氧根离子结合,释放出氨气,溶液中离子浓度降低,推动蛋白移动的作用力减小,使得上线蛋白得率与纯化倍数下降。
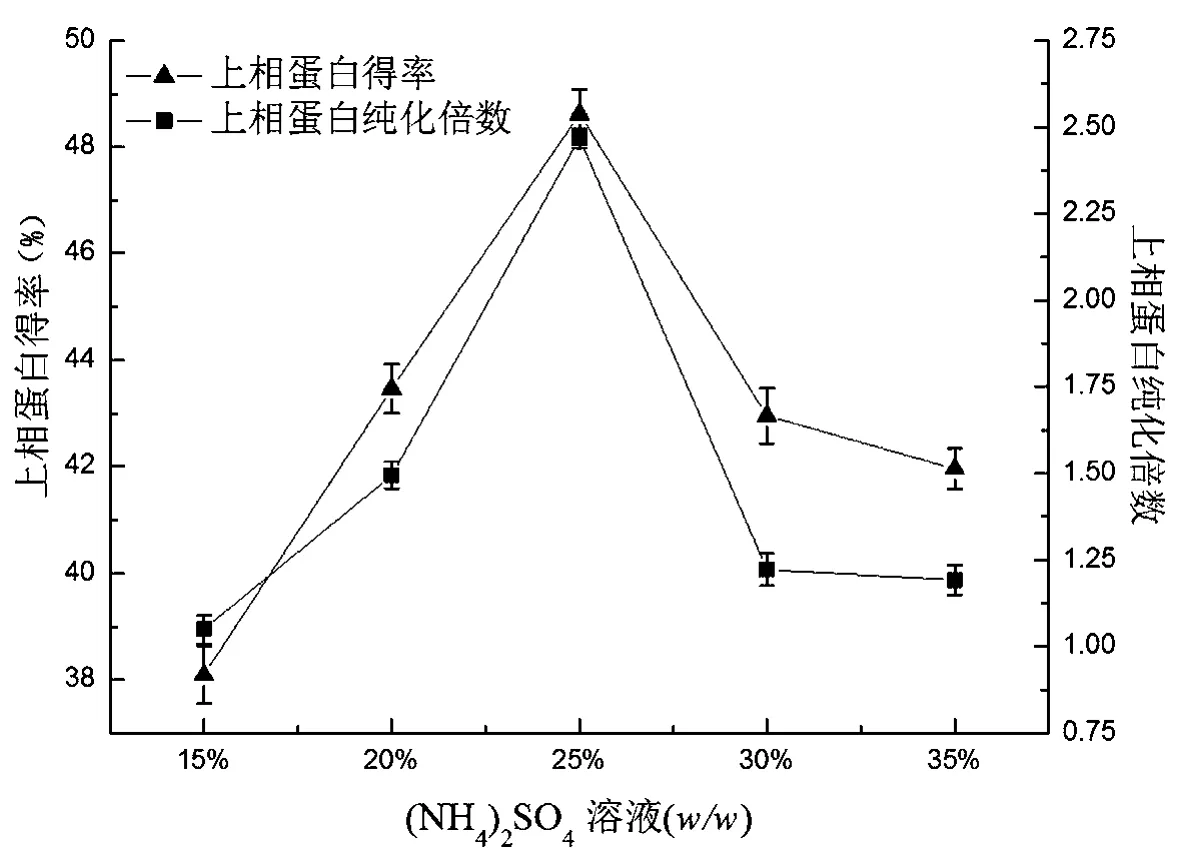
图1 不同浓度(NH4)2SO4上相纯化倍数和得率

图2 不同浓度PEG600上相纯化倍数与得率

图3 不同pH值上相纯化倍数与得率
3 结论
研究得到PEG600/(NH4)2SO4双水相萃取紫花油豆中凝集素的最优条 件 为( 体 系 共5mL):3mL的25%(NH4)2SO4溶 液(w/w),1mL的90%PEG600溶液(w/w),粗提液体积1mL,体系pH值为7.5,此时上相蛋白得率为42.32%,纯化倍数为3.08。
[1]Li J, Qu X, Payne G F, et al.Biospecific Self-Assembly of a Nanoparticle Coating for Targeted and Stimuli-Responsive Drug Delivery[J]. Advanced Functional Materials,2015(9):1404-1417.
[2]Zhang J, Shi J, Sanja I,et al. Biological Properties and Characterization of Lectin from Red Kidney Bean (Phaseolus Vulgaris)[J]. Food Reviews International,2008(1):12-27.
[3]Nascimento K S, Cunha A I, Nascimento K S, et al. An overview of lectins purification strategies[J].Journal of Molecular Recognition,2012 (11):527-541.
[4]Nascimento K S, Rosa P A J,Nascimento K S, et al. Partitioning and recovery of Canavalia brasiliensis lectin by aqueous two-phase systems using design of experiments methodology[J].Separation & Purification Technology,2010(1):48-54.
[5]Soares P A, Nascimento C O, Porto T S, et al. Purification of a lectin from Canavalia ensiformis using PEG-citrate aqueous two-phase system.[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011 (5):457-460.
[6]Nascimento C O, Soares P A G, Porto T S, et al. Aqueous twophase systems: new strategies for separation and purification of lectin from crude extract of Cratylia mollis,seeds[J].Separation & Purification Technology,2013(116):154-161.

