放疗联合甘氨双唑钠治疗骨转移性骨痛的疗效观察
陈佳佳 曾越灿 吴荣
恶性肿瘤骨转移可诱发多种临床骨相关事件,不仅影响患者的生活质量,也是重要的致死原因之一[1]。骨痛是恶性肿瘤骨转移最常见的不良反应,放疗是其姑息性治疗手段,主要目的是缓解疼痛,提高患者生活质量,延长生存期[2]。但肿瘤组织中存在部分乏氧细胞,常导致放疗抵抗,影响治疗效果。硝基咪唑类化合物甘氨双唑钠(CMNa)是我国自主研制的乏氧细胞增敏剂。研究证明CMNa联合放疗或化疗能显著提高头颈部肿瘤的治疗效果[3]。然而CMNa对骨转移癌放疗是否具有增敏作用,目前尚无相关报道。本研究观察58例晚期恶性肿瘤骨转移患者放疗联合CMNa与单纯放疗治疗骨转移性骨痛的疗效,现报道如下。
1 资料与方法
1.1 研究对象
选取2015年7月至2017年6月本院收治的晚期恶性肿瘤骨转移患者。纳入标准:⑴均有CT、MRI或全身骨扫描检查结果,原发灶均经病理组织学明确诊断,依据肿瘤病史、患者临床症状、骨转移部位CT或MRI明确诊断骨转移;⑵预计生存期≥3个月;⑶Karnofsky评分(KPS)≥60分;⑷血常规、肝肾功能和心电图无明显异常,可耐受放疗。排除依从性差,不能配合检查或治疗及CMNa过敏者。共58例患者符合标准纳入研究,采用随机数字法将患者分为观察组和对照组,每组29例。本研究经院内伦理委员会批准通过,全部患者均签署知情同意书。
1.2 治疗方法
两组患者均采用6MV X线医用直线加速器行普通放疗,靶区每次3 Gy照射剂量,1次/d,每周放疗5 d,总剂量为30 Gy,照射靶区为单个或多个骨转移部位。观察组在放疗基础上给予放疗增敏剂CMNa(希美钠,山东绿叶制药有限公司,250 mg/支),用法:800 mg/m2CMNa溶解于100 mL生理盐水中,静滴30 min后1 h内行放疗,隔日1次,3次/周。
1.3 疗效评价
1.3.1 止痛效果评价 参照数字评分法(NRS)对患者疼痛程度进行评分[4],0 分:无痛;1~3 分:轻度疼痛,疼痛不影响睡眠;4~6 分:中度疼痛;7~9 分:重度疼痛,影响睡眠;10分:剧烈疼痛。记录患者应用止痛药物情况,并根据阿片类药物换算表格,将患者所应用阿片类药物剂量换算成等量口服吗啡剂量。止痛效果评价标准:根据国际疼痛反应分类(international pain response category,IPRC)[5],比较患者治疗前和治疗后1个月的疼痛评分和阿片类药物应用剂量,完全缓解(CR):疼痛消失,疼痛评分为0分,且不增加止痛药物使用剂量;部分缓解(PR):疼痛评分下降≥2分,且不增加止痛药物剂量,或止痛药物应用剂量下降≥25%,且治疗部位疼痛强度没有增加[6];轻度缓解(MR):疼痛较治疗前略减轻,但未达到PR;无缓解(NR):疼痛较治疗前无明显变化。有效率(RR)=(CR+PR)/例数×100%。
1.3.2 生活质量改善评价 应用KPS评分评价两组患者的生活质量。显效:KPS评分提高≥20分;有效:KPS评分提高10~19分;无效:KPS评分未升高或下降。有效率=(显效+有效)/例数×100%。
1.3.3 不良反应评价 记录患者放疗期间出现的不良反应,依照按WHO毒性分级评价不良反应,分为0~Ⅳ级。
1.4 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量数据采用均数±标准差(x±s)表示,组间比较采用独立样本t检验;计数数据采用例数(构成比)表示,组间比较采用χ2检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料
纳入研究的患者均有不同程度骨痛。其中,观察组男性 18例,女性 11例,平均年龄(54.3±2.1)岁;原发肿瘤部位:肺癌11例,乳腺癌4例,前列腺癌6例,宫颈癌1例,甲状腺癌1例,消化道肿瘤4例,鼻咽癌1例,肾癌1例;骨转移部位:四肢骨干7例,脊柱骨13,肋骨4例,骨盆5例;参照NRS对疼痛进行评分[7]:轻中度疼痛14例,重度疼痛15例;治疗前KPS平均评分为(65.37±8.50)分。对照组男性22例,女性7例,平均年龄(57.5±2.4)岁;原发肿瘤部位:肺癌 15例,乳腺癌5例,前列腺癌3例,宫颈癌1例,甲状腺癌1例,消化道肿瘤2例,鼻咽癌1例,肾癌1例;骨转移部位:四肢骨干9例、脊柱骨10例、肋骨3例、骨盆7例;轻中度疼痛16例,重度疼痛13例;治疗前KPS平均评分为(67.21±9.40)分。两组患者一般资料比较,差异无统计学意义(P>0.05)。
2.2 两组患者止痛效果和生活质量比较
放疗结束后1个月,观察组获CR 14例,PR 13例,MR1例,NR1例,RR为93.1%;对照组获CR 11例,PR 10例,MR 5例,NR 3例,RR为72.4%,观察组RR高于对照组,差异有统计学意义(χ2=4.350,P=0.037)。观察组KPS评分改善有效率高于对照组,差异有统计学意义(93.1%vs 69.0%,χ2=5.497,P=0.019),见表1。
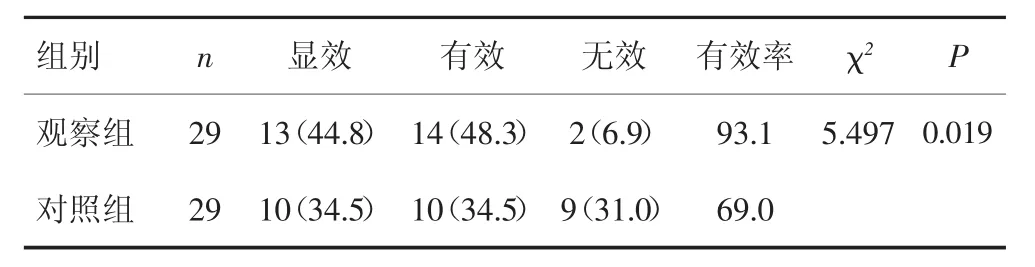
表1 两组患者治疗前后KPS评分比较[n(%)]
2.3 两组患者不良反应比较
观察组发生Ⅰ~Ⅱ级胃肠道反应5例,其中恶心3例,呕吐2例;对照组发生Ⅰ~Ⅱ级胃肠道反应4例,其中恶心2例,呕吐2例,两组患者胃肠道反应发生率差异无统计学意义(17.2%vs 13.8%,P>0.05)。观察组和对照组分别有3例和4例患者发生骨髓抑制,主要为白细胞轻度降低,两组患者骨髓抑制发生率差异无统计学意义(10.3%vs 13.8%,P>0.05)。两组患者均未出现神经毒性反应。
3 讨论
晚期恶性肿瘤常出现骨转移,以乳腺癌、前列腺癌和肺癌最为常见。放疗在缓解疼痛、控制骨转移进展和阻止骨相关事件发生等方面效果良好[7-8]。CMNa作为国内首例乏氧细胞增敏药物被广泛应用于临床治疗,其作用机制为选择性增强放化疗导致的乏氧细胞DNA损伤,抑制DNA聚合酶活性,抑制潜在的致死性或亚致死性细胞损伤,且不良反应较轻[9]。
本研究结果显示,相对于单纯放疗,放疗联合CMNa治疗恶性肿瘤骨转移可显著提高骨转移性骨痛的治疗有效率,改善患者生活质量。分析原因认为CMNa可能通过直接增强放疗对肿瘤细胞的杀伤作用,进一步缩小肿瘤体积,减轻肿瘤压迫而达到止痛效果;此外,CMNa亦可能提高放疗敏感性,增强放疗疗效,使肿瘤细胞加速死亡,间接减少或抑制肿瘤组织释放化学因子,从而增强止痛疗效。但其具体机制仍需进一步研究。
CMNa属于硝基咪唑类化合物,具有亲电子特征,大量累积可能引起神经毒性。研究证明CMNa代谢快,在体内维持48 h后浓度可降至检测值以下,因此隔天应用不会导致药物剂量累积[10],本研究亦采用隔天用药方式,结果未发现神经毒性反应。多个临床研究[5-6]表明CMNa在提高放化疗敏感性的同时不增加不良反应,提示CMNa不良反应较低,安全性较高。本研究放疗联合CMNa治疗胃肠道反应、骨髓抑制程度亦未明显增加,与上述研究结果一致,说明该方案安全有效,具有一定临床推广价值。
[1] Gandaglia G,Abdollah F,Schiffmann J,et al.Distribution of metastatic sites in patients with prostate cancer:a population-based analysis[J].Prostate,2014,74(2):210-216.
[2] Macedo F,Ladeira K,Pinho F,et al.Bone metastases:an overview[J].Oncol Rev,2017,11(1):321.
[3] Zeng YC,Wu R,Xu ZG,et al.Safety and radiation-enhancing effect of sodium glycididazole in locoregionally advanced laryngeal cancers previously treated with platinum-containing chemotherapy regimens:a preliminary report[J].Cancer Radiother,2010,14(1):59-64.
[4] Phan NQ,Blome C,Fritz F,et al.Assessment of pruritus intensity:prospective study on validity and reliability of the visual analogue scale,numerical rating scale and verbal rating scale in 471 patients with chronic pruritus[J].Acta Derm Venereol,2012,92(5):502-507.
[5] Chow E,Hoskin P,Mitera G,et al.Update of the international consensus on palliative radiotherapy endpoints for future clinical trials in bone metastases[J].Int J Radiat Oncol Biol Phys,2012,82(5):1730-1737.
[6] Mendez LC,Raman S,Wan BA,et al.Quality of life in responders after palliative radiation therapy for painful bone metastases using EORTC QLQ-C30 and EORTC QLQ-BM22:results of a Brazilian cohort[J].Ann Palliat Med,2017,6(Suppl 1):S65-S70.
[7] 田继红,王海静,唐鹿群,等.三维适形放疗联合唑来膦酸治疗骨转移癌的临床效果分析[J].中外医学研究,2017,15(27):9-11.
[8] Coleman R,Body JJ,Aapro M,et al.Bone health in cancer patients:ESMO Clinical Practice Guidelines[J].Ann Oncol,2014,25(Suppl 3):Ⅲ124-137.
[9]Wu P,Liu J,Sun X,et al.Enhanced radiosensitizing by sodium glycididazole in a recurrent esophageal carcinoma tumor model[J].Oncotarget,2017,8(38):63871-63880.
[10]付良青,郭军华,高洪志,等.肿瘤放疗增敏药甘氨双唑钠(CMNa)的I期临床药代动力学研究[J].中国临床药理学杂志,2000,16(3):187-190.

