芹菜素对小鼠肺损伤抗炎活性的体外评价
(酒泉职业技术学院,甘肃 酒泉 735000)
1 材料
1.1 实验菌株和细胞
RAW264.7 小鼠单核-巨噬细胞实验室自留。
1.2 主要试剂及药品
胰酶 美国 Hyclone公司
EDTA 美国 Sigma公司
二甲基亚砜(DMSO) 美国 Sigma公司
RPMI-1640 培养基 美国 Hyclone公司
脂多糖(LPS) 美国 Sigma公司
芹菜素标准品 中国药品生物制品检定所
1.3 主要仪器设备
细胞培养箱 SANYO 公司’细胞培养板 Costar公司
恒温干燥箱 上海恒一公司
二氧化碳恒温培养箱 三洋公司
高压蒸汽灭菌器 长春百奥生物公司
SW-CJ-IF 型超净工作台 北京东联哈尔仪器制造公司
高速低温台式离心机 德国 EFFENDOF公司
显微镜 奥林巴斯公司
低温高速冷冻离心机 德国 SORVALL公司
全自动酶标仪 奥地利 TECAN 公司
-80℃超低温冰箱 SANYO 公司
显微镜 奥林巴斯 公司
手术器械 伯乐 公司
半干转膜仪 美国伯乐 公司
湿转转膜仪 BIO-RAD 公司
TH2-82 型恒温振荡器 上海跃进医疗器械厂
1.4 所需试剂的配制
(1) PBS缓冲液(ph 7.2)的配置
NaCl 8.0 g
Na2HPO4·12H2O 3.63 g
KCL 0.2 g
KH2P040.24 g
去离子水 800 mL
后调节pH值为7.2 定容至1.0 L
(2) SDS-PAGE 电泳10%分离胶
去离子水 1.9 mL
30%丙烯酰胺 1.7 mL
1.5M Tris-HCl(pH=8.8) 1.3 mL
10%SDS 50 μL
10%过硫酸铵 50 μL
TEMED 2 μL
(3) SDS-PAGE 电泳5%浓缩胶
去离子水 2.1 mL
30%丙烯酰胺 0.5 mL
1.0M Tris-HCl(pH=6.8) 380 μL
10%SDS 30 μL
10%过硫酸铵 30 μL
TEMED 3 μL
(4) pH=6.8 Tris-HCL(1M)的配置
Tris-Base 12.11 g
去离子水 80 mL
调节pH值至6.8去水定容至100 mL
(5)pH=88 Tris-HCL(1.5M)的配置
Tris-Base 18.17 g
去离子水 80 mL
调节pH值至8.8去离子水定容至100 mL
(6) 10%过硫酸胺
过硫酸铵 1 g
去离子水 10 mL
(7) Tris-甘氨酸电泳缓冲液
Tris 3.02 g
甘氨酸 18.8 g
SDS 1.0 g
去离子水定容至1.0 L
(8) Western blot 转膜缓冲液的配置
Tris-Base 5.82 g
甘氨酸 2.93 g
SDS 0.375 g
甲醇 200 mL
加入去离子水定容至1 L
(9) TBS缓冲液(0.05%Tween-20)的配置
Tris-Base 2.422 g
NaCl 8.775 g
Tween 20
0.5 mL
去离子水定容至1.0 L
调节pH值至7.4
(10) 3% BSA
BSA 3 g
TBST 100 mL
200 mL
2 方法
2.1 药物浓度筛选
2.1.1 配制细胞培养基 1640培养基中加入5%~10%的胎牛血清、1%谷氨酰胺和双抗。
2.1.2 细胞的培养 从液氮中取出细胞,迅速在37°C水浴锅中进行解冻,无菌操作将冻存管中的细胞倒入细胞培养瓶中,加入带有胎牛血清的细胞培养液进行培养。待细胞约长到80%时对细胞进行传代培养。细胞消化需用胰酶进行消化,分装入细胞培养瓶中进行培养为后续的实验进行准备。
2.2 MTT 法测定细胞毒性
对数生长期RAW264.7细胞4×105个/mL接种于96孔培养板,芹菜素浓度0~40 μM预处理细胞1 h,设置调零孔,空白对照孔,每组重复四个。培养24 h后,每孔滴价20 μL MTT,放置温箱继续培养4 h后,弃掉培养液,每孔滴加150 μL DMSO,并放置于振荡器上震荡,最后用酶标仪570 nm波长检测。
2.3 qRT-PCR检测细胞因子TNF-α、IL-1β和IL-6
2.3.1 实验分组 空白对照组、LPS刺激组、芹菜素药物组(10、20、40 μM)组,每组设有三个重复。
2.3.2 接种 RAW264.7细胞接种于6孔板中,芹菜素预处理1 h后,LPS (1 μg/mL)刺激细胞4 h,弃去培养上清,PBS洗涤2次,利用Trizol法提取RNA。
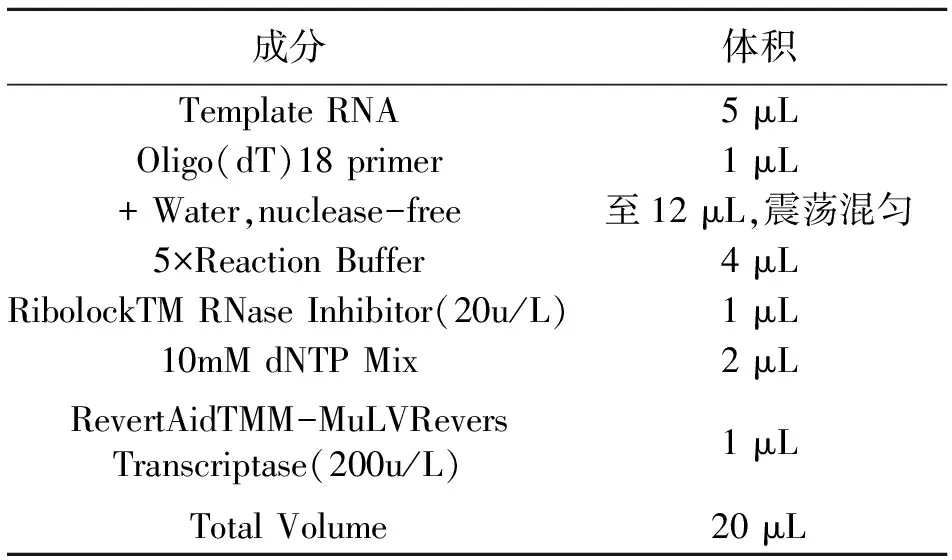
表1 反转录体系
2.3.3 反转录 取适量RNA反转录,反转录体系如表1。
2.3.4 应用primer premier 5.0软件设计细胞因子的引物序列 如表1和表2所示。根据PCR试剂盒的说明书,按照表3所示的反应体系检测细胞因子TNFα、IL-1β和IL-6基因的表达情况。

表2 细胞因子的引物序列
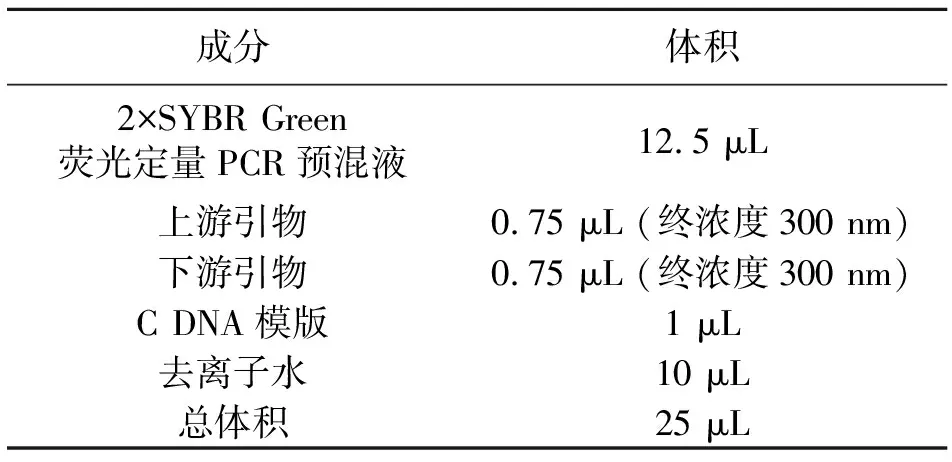
表3 qRT-PCR反应体系
2.4 免疫蛋白印迹
2.4.1 实验分组 空白组、LPS组、芹菜素组(10、20、40μM)组,每组设五个重复。
2.4.2 接种 4×105个/mL 的RAW264.7 细胞接于 6 孔细胞板中,每孔约有2 mL,37°C培养箱中培养24 h后,加入不同浓度芹菜素药物进行预处理1 h,LPS刺激细胞1 h,弃上清,用PBS进行清洗2到3次,加入蛋白裂解液200 μL进行裂解,用细胞刷收集细胞,5 min,12 000 p离心8 min,弃沉淀留上清,用BCA法测定蛋白浓度,最后加入相应的Loading Buffer和PBS于100℃煮沸10 min,分装并储存于-80℃冰箱。
2.4.3 配胶 清洗玻璃板,并固定于电泳架上,按配方配制5 mL 10%分离胶,摇匀后迅速灌入两块玻璃板之间,轻轻加入1 mL蒸馏水压平胶面,待胶凝固后,倒掉蒸馏水,配制5%的浓缩胶,迅速插入梳子,待其凝固。
2.4.4 上样 将电泳缓冲液加入电泳槽内,小心缓慢拔出梳子,然后将适量的蛋白样品缓慢加入到梳孔内,注意不要产生气泡,安装好电泳装置,接通电源。
2.4.5 跑胶 浓缩胶,恒压80 V,20 min;分离胶,恒压120 V,80 min,条带为一狭窄条带。
2.4.6 转膜 提前将剪好的滤纸放入转膜缓冲液内,剪下适应大小的PVDF膜放入甲醇内活化后,放入转膜缓冲液中。胶、PVDF膜与滤纸大小一致,按如下顺序:滤纸-PVDF膜-凝胶-滤纸依次放在转膜仪上,注意每层不可留有气泡,接通电源,进行转膜。
2.4.7 封闭 转膜结束,将PVDF膜放入5%脱脂乳或3%BSA中进行封闭,室温摇床封闭2~3 h。
2.4.8 一抗孵育 用TBST稀释一抗,使用cell signaling抗体按1∶1 000比例稀释,取出PVDF膜放入稀释好的一抗溶液中,4℃孵育过夜。
2.4.9 洗膜 TBST溶液洗膜三次,每次5 min。
2.4.10 二抗孵育 按1∶50 000比例TBST稀释二抗,取出PVDF膜放入稀释好的二抗溶液中,室温孵育2 h。
2.4.11 洗膜 TBST溶液洗膜三次,每次5 min。
2.4.12 显影 配制ECL工作液:在避光的容器中按A液:B液=1∶1的比例配制,在PVDF膜上滴加适量的ECL工作液,显影适当时间拍照,保存。
2.5 数据处理及统计
将以上实验结果进行方差分析,其结果用Means±SEM形式表示。数据差异性均采用方差分析和Student′s检验进行分析。P<0.05 和P<0.01 分别代表差异显著和差异极显著。
3 结果
3.1 芹菜素对 RAW264.7 细胞的活性影响
MTT 法检测不同浓度的芹菜素对细胞活性的影响,如图1所示,与空白对照组相比,芹菜素在0-40 μM范围对细胞活性影响较小,表明以上三个药物浓度对RAW264.7细胞没有毒性反应。

图1 MTT法检测芹菜素对RAW264.7细胞的毒性作用
3.2 芹菜素对LPS诱导的细胞因子TNF-α、IL-6和IL-1β的影响
ELISA方法和qRT-PCR方法检测芹菜素对LPS诱导炎性细胞因子TNF-α、IL-6和IL-1?水平的影响。结果显示LPS刺激组的三种细胞因子与空白对照组相比显著上升,而芹菜素在10~40 μM范围内能够剂量依赖性地降低三种细胞因子的产生。
3.3 芹菜素对LPS刺激的RAW264.7细胞NF-κB信号转导通路的影响
LPS刺激细胞后,western blot结果显示(图3),磷酸化的IκB、p65水平呈明显上升趋势。芹菜素在10~40 μM范围内能够剂量依赖性地降低IκB 、p65的磷酸化水平。

图2 实时荧光定量检测细胞因子基因水平表达情况

图3 Western Blot 检测RAW264.7细胞NF-kB信号通路激活情况
3.4 芹菜素对LPS刺激的RAW264.7细胞MAPKs信号转导通路的影响
如图所示,细胞被LPS刺激后,磷酸化ERK1/2、p38和JNK的水平呈现出显著上升。相比之下,芹菜素在10~40 μM范围内能够剂量依赖性地降低JNK、ERK1/2 和p38 的磷酸化水平。结果可以说明芹菜素对MAPKs 信号通路的激活起到了抑制的作用。
4 讨论
炎症是组织器官对损伤因子所产生的一种防御性反应。主要表现为红、肿、热、痛等机能障碍。革兰氏阴性菌的细胞壁的成分当中主要是LPS,LPS是引起炎症反应的炎症的主要成分。主要表现为,刺激动物机体产生炎性细胞因子。炎性细胞因子对机体会产生严重的病理学反应。前人已有研究,LPS刺激炎性细胞因子产生 TNF-α、IL-1β 和 IL-6等,细胞因子之间有相互协同作用。这些炎性细胞因子会引起强烈的炎症反应,会对机体产生极大的损害。炎症反应中最早出现的是TNF-α,可促使IL-1分泌, IL-1对机体的损伤和感染产生应答并刺激其他炎性因子的产生,对炎症发生过程起着重要的作用,IL-6在急性期炎症发生过程中起到重要作用。

图4 Western Blot 检测RAW264.7细胞MAPK信号通路激活情况
研究发现,LPS可以被TLR4信号通路识别,并激活下游的NF-κB 和 MAPKs信号通路来调控炎症细胞因子基因水平的表达。p65与IκB以二聚体、无活性的形式存在于细胞质内,在受到LPS刺激时,其二聚体发生解离,p65分子从细胞质转移至细胞核内,启动炎性细胞因子基因的转录,如TNF-α、IL-1β 和 IL-6。炎性细胞因子的产生与MAPKs信号通路也具有密切的关系,LPS刺激后,能够导致MAPKs信号通路中的ERK1/2,JNK 和 p38 的磷酸化水平上升。本实验通过检测芹菜素对 LPS 激活的 NF-κB 和 MAPKs表达来寻找其抗炎的机理。从实验的数据中可以发现,芹菜素确实抑制了NF-κB 和 MAPKs 的激活。通过实验结果我们可以的出下面的结论,芹菜素的抗炎作用很大程度上是因为抑制了NF-κB 和 MAPKs 的激活,所以抑制了炎症反应的出现。
5 结论
芹菜素对RAM.264.7细胞没有毒害作用。芹菜素在10~40 μM范围内能够剂量依赖性地降低TNF-α、IL-1β和IL-6等细胞因子的产生。芹菜素能明显抑制RAM.264.7细胞中NF-κB和MAPKs信号通路的激活。
参考文献:
[1] 隋海霞, 徐海滨, 荫士安. 芹菜素的生物学作用[J]. 国外医学 (卫生学分册), 2008(2):10..
[2] 历强, 马建仓, 赵军等. 芹菜素的药理学研究进展[J]. 国外医学: 中医中药分册, 2003, 25(3): 147-149.
[3] 杨爱东, 李文雯, 王利霞等. 加味小青龙汤对内毒素致急性损伤大鼠肺组织TLR4 mRNA表达的影响[J]. 中华中医药杂志, 2011(12): 2997-3000.
[4] 钱桂生. 全身炎症反应综合征、急性肺损伤与急性呼吸窘迫综合征[J]. 解放军医学杂志, 1999(5): 313-316.
[5] 詹妮, 卢丹, 李平亚. 中草药的抗炎作用成分及其机制[J]. 中国医药指南, 2010(20):224-226.
[6] 崔蓉, 孟宪丽, 王平等. 黄芩水提取物对急性肺损伤大鼠的保护作用及其与胆碱能抗炎通路的相关性研究[J]. 中草药, 2012,(2):321-326.

