超声诊断胎儿右肺动脉异常起源1例
马秋萍,欧阳春艳
1.广州医科大学研究生学院,广东广州 511442;2.广州医科大学附属广东省妇幼保健院超声诊断科,广东广州 511442;
1 病例简介
女,28岁,主诉:妊娠28周+行常规产前超声检查。孕期TORCH检查阴性。超声示:四腔心基本对称,心胸面积比正常,房室连接及心室与大动脉连接正常,左、右心室流出道可见,肺动脉分叉未见显示,主肺动脉直接延续为左肺动脉与动脉导管,可见右肺动脉起源于升主动脉(图1A、B)。超声提示胎儿右肺动脉异位起源于升主动脉,胎儿循环阻力未见明显异常。出生后心脏CT示:左位心,心房正位,心室右袢,主动脉正位。右肺动脉起自升主动脉(于主动脉瓣上4.8 mm),动脉导管未闭,卵圆孔未闭(图1C、D)。手术结果:术中见胸腺发育良好,心包无粘连,心房正位,心室右袢,升主动脉位于肺动脉右后方,主肺动脉位于左前,右肺动脉发自升主动脉右后壁,右冠状动脉上方,左肺动脉起始部一粗大的动脉导管(直径约4 mm)与降主动脉相连。
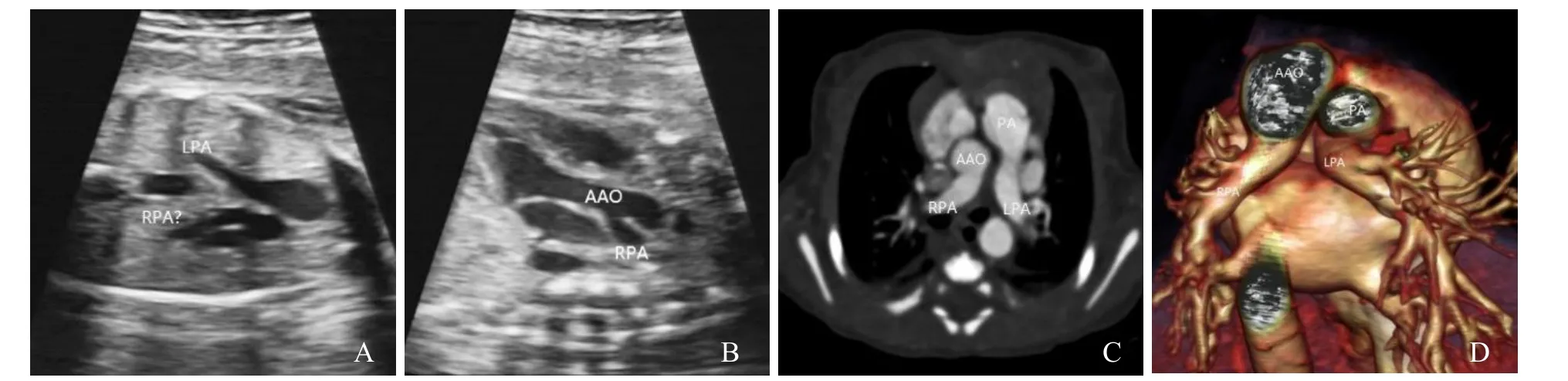
图1 女,28岁,右肺动脉异常起源。正常肺动脉分叉未见显示,主肺动脉直接延续为左肺动脉与动脉导管(A);左心室流出道切面可见升主动脉分出一支异常血管,为右肺动脉(B);心脏CT增强扫描示正常肺动脉分叉未显示,可见左肺动脉起自主肺动脉,右肺动脉起自升主动脉(C);心脏血管三维重建(D);LPA:左肺动脉;RPA:右肺动脉;AAO:升主动脉;RPA:右肺动脉;PA:主肺动脉
2 讨论
单侧肺动脉异常起源(anomalous origin of one pulmonary artery,AOPA)指一侧肺动脉分支起源于主动脉的任何部位,包括升主动脉、主动脉弓或降主动脉等部位,而另一侧肺动脉仍由肺动脉主干直接延续。本病发病率极低,仅占先天性心脏病总发病率的0.12%[1]。由Fraentzel于1868年首次描述,后续多数为个案或小样本量报道,并多见于儿童;产前报道更为少见[2]。AOPA的发病机制尚不明确。有学者认为右肺动脉起源异常是由于右侧第6动脉弓发育不完全或向左迁移延迟所致;左肺动脉起源异常则是由于左侧第6动脉弓缺如而第5动脉弓存在[3]。AOPA可根据异常起源的分支肺动脉分为右肺动脉起源异常和左肺动脉起源异常,前者约占85%。根据起源距离主动脉瓣和头臂干的距离分为近端型和远端型,其中前者起源位于升主动脉的后壁、左或右后侧壁,距主动脉瓣较近(1~3 cm),约占85%;远端型起源距离主动脉瓣较远,靠近头臂干起始处[4]。本病可单独存在或合并其他心内或心外畸形,常合并法洛四联症、主肺动脉窗、房室间隔缺损等其他先天性心脏病。
产前超声表现为胎儿正常肺动脉分叉消失,肺动脉主干与动脉导管及一侧肺动脉相延续,另一支肺动脉缺如。在左心室流出道及主动脉弓切面可见升主动脉近端发出一支异常血管,其血流频谱与升主动脉相似,向一侧肺野走行,与肺动脉主干无连续,为异常起源的肺动脉。
由于 AOPA一侧肺血管接受部分体循环的血液,而另一侧肺血管接受所有肺循环的血液,两侧肺血管床容易发生肺血管阻塞性疾病,早期诊断、及时手术治疗可以防止严重的肺动脉高压和肺部血管病变。而肺动脉高压的程度是决定是否手术及手术成败的关键。本例未合并其他心内及心外畸形,出生后及时手术,预后良好。
产前发现肺动脉异常起源主要依靠超声诊断。本病发病率低,如不合并其他畸形易漏诊。早发现、早诊断有助于选择合适的手术时机,降低围生儿的病死率。
[1] Vida VL, Sanders SP, Bottio T, et al. Anomalous origin of one pulmonary artery from the ascending aorta. Cardiol Young,2005,15(2): 176-181.
[2] Gerlis M, Anderson RH. Unusual origin and course of the left pulmary artery. Clin Anat, 2001, 14(5): 373-378.
[3] 姚维妙, 项小苗, 潘姣娥. 超声心动图诊断胎儿肺动脉异常起源的价值. 中华超声影像学杂志, 2015, 24(9): 814-815.
[4] JungaMJ, Yooa SJ. Prenatal diagnosis of anomalous origin of the right pulmonary artery from the ascending aorta. Cardiol Young, 2002, 12(2): 186-188.

