小麦根中NADP-脱氢酶系统关键酶活性与根系活力和产量的关系分析
周燕,杨习文,周苏玫,王言景,杨蕊,徐凤丹,梅晶晶,申冠宇,李秋杰,贺德先
(1河南农业大学农学院/河南粮食作物协同创新中心/省部共建小麦玉米作物学国家重点实验室,郑州 450002;2郑州师范学院,郑州 450002)
0 引言
【研究意义】氮肥的施用使我国粮食产量得以大幅度提升,但在作物生产实践中,由于缺乏对合理施肥的科学认识,我国过量施氮肥农田面积仍占33%[1]。过量及不合理施用氮肥,不仅导致诸多环境问题[2-3],还使小麦、玉米等作物表现出耐肥的特性,氮肥利用效率持续降低,目前只有 20%[1]。在保障国家粮食安全和不影响农民收入的前提下,逐步减氮增效,促进农业可持续发展已成为趋势。根系是植物摄取氮素的主要器官,氮肥减施首先会显著影响根系活力[4],而根系活力与地上部发育和产量形成关系密切[5-7]。因此,探索影响根系活力强弱的机制,以其调控根系生理功能显得尤为必要。【前人研究进展】根系活力的强弱不仅反映根系新陈代谢的能力[8],还与叶片光合速率呈极显著正相关[9],较强的根系活力有助于延缓地上部分衰老,促进光合产物的合成与转运,提高产量[10]。量化根系活力的方法很多,目前普遍采用改良TTC法测量根系活力[11]。根系活力不仅取决于品种间基因型差异[12],还受土壤水分[13-14]、肥力等条件制约[15]。合理施用氮肥可以提高根系活力,促进地上部对氮素的吸收与积累[16],有利于进行物质生产,获得更高的籽粒产量[17]。有研究表明,根系活力与产量呈极显著正相关关系,相关系数达0.9以上[18]。近年来研究多集中于通过栽培措施调控根系活力[13-15],而对于作物自身代谢调节研究甚少。另有研究认为脱氢酶活性与根系活力关系密切,将琥珀酸脱氢酶作为衡量根系活力的指标[19]。脱氢酶参与植物体内氧化还原反应需要一类重要辅酶NADPH参与。NADPH脱氢酶系统关键酶主要有 NADP-异柠檬酸脱氢酶(NADP-ICDH),NADP-苹果酸酶(NADP-ME),葡萄糖-6-磷酸脱氢酶(G6PDH)和6-磷酸葡萄糖酸脱氢酶(6PGDH),其中G6PDH和6PGDH是戊糖磷酸途径(pentose phosphate pathway,PPP)关键性的限速酶[20]。【本研究切入点】前人研究NADPH脱氢酶系统关键酶主要侧重于植物地上部光合途径和在逆境条件下酶的分子机制研究[20-23],对于小麦全生育时期,其在根系中活性动态变化和生理功能的研究甚少,尤其是关于根系活力与NADPH脱氢酶系统关键酶的关系研究迄今尚未见报道。【拟解决的关键问题】在黄淮平原典型农田,采用大田试验方法,探索小麦不同生育时期根中 NADP-ICDH,NADP-ME和(G6PDH+6PGDH)活性变化及酶活性与根系活力(改良TTC法)和产量的关系,以期为提高根系活力提供理论支持。
1 材料与方法
试验于 2015—2016年度在河南农业大学教科园区(郑州市惠济区毛庄镇)进行,供试土壤为砂壤土,有机质、全氮、碱解氮、有效磷和有效钾含量分别为17.8 g·kg-1,0.89 g·kg-1,57.9 mg·kg-1,24.4 mg·kg-1和154.8 mg·kg-1,pH 7.8;2016—2017 年度在河南省农业高新科技园(郑州市中牟县官渡镇)进行,供试土壤为黏土,有机质、全氮、碱解氮、有效磷和有效钾含量分别是 11.3 g·kg-1,0.75 g·kg-1,49.8 mg·kg-1,19.8 mg·kg-1和 134.5 mg·kg-1,pH 7.5。
1.1 供试材料
供试材料为黄淮平原区大面积推广应用的周麦27号(国审麦2011003)和矮抗58(国审麦2005008)。
1.2 试验设计与田间管理
大田试验采用裂区设计,主区为施氮水平,副区为品种。根据黄淮平原麦区高产田的氮肥施用现状(一般225 kg·hm-2或以上),主处理设6个水平,分别为 0(N0),135(N1),157.5(N2),180(N3),202.5(N4),225(N5)kg·hm-2。副处理为品种周麦27号(A1)和矮抗58(A2)。试验共计12个处理组合,小区面积为12 m2(4 m×3 m)。氮肥为尿素,不同处理总氮量的50%作底肥,播前整地时施入,50%于拔节期追施;磷、钾肥随同底氮一次施入,其中氯化钾 200 kg·hm-2、过磷酸钙 1 125 kg·hm-2。于2015年10月13日,2016年10月15日适墒播种,基本苗为240×104/hm2,行距20 cm,12行区,重复4次。2016年5月30日,2017年5月29日收获。为维持适宜土壤墒情,采用喷灌设施进行灌溉,两年度均于播种后灌溉,并在拔节期、孕穗期和灌浆期维持土壤相对含水量在70%—80%。其他栽培管理同一般高产田。
1.3 测定项目与方法
1.3.1 取样方法 分别在越冬期、返青期、拔节期、挑旗抽穗期、灌浆期、蜡熟期进行取样,测定根系活力及NADP-脱氢酶系统关键酶活性。试验选取有代表性、长势一致的麦行,以麦行为中心,向左右两侧(行间)各延伸10 cm,取长20 cm,宽20 cm,深25 cm土层样段,小心冲洗根部。将冲洗干净的根样装入冰盒中带回实验室,取一部分混合根样(取样后4—6 h)用于测定根系活力,另一部分用液氮冷冻,用以测定脱氢酶活性。
1.3.2 根系活力和 NADP-脱氢酶系统关键酶活性测定方法 根系活力测定:采用改良TTC法[11]。NADP-脱氢酶系统关键酶活性测定:选取0.5 g冷冻根样置于研钵中,迅速加入液氮和少许石英砂,再加入3 mL 50 mmol·L-1Hepes-Tris缓冲液(pH 7.8,含 3 mmol·L-1MgCl2,1 mmol·L-1EDTA,1 mmol·L-1PMSF 和1 mmol·L-1DTT),研磨成糊状,匀浆液在4℃和12 000 r/min条件下离心,上清液即为粗酶液,测定NADP-ICDH(EC 1.1.1.42),NADP-ME(EC 1.1.1.40),6PGDH(EC 1.1.1.44)和G6PDH(EC 1.1.1.49)酶活性[24]。1个酶活性单位为每分钟催化产生 1 nm NADPH所需酶量,总酶活性以3 min内生成的产物NADPH在340 nm处的吸光值表示。
1.3.3 测产 小麦成熟时每小区取1 m2植株,脱粒,风干,称重计产,重复3次。
1.4 统计分析方法
采用Microsoft Excel 2007进行数据处理、表格制作和绘图,SPSS 21进行方差分析。
2 结果
2.1 小麦不同生育时期 NADP-脱氢酶系统关键酶活性的动态变化
2.1.1 异柠檬酸脱氢酶(NADP-ICDH)活性的动态变化表1可以看出,氮肥减施条件下,不同品种NADP- ICDH活性变化范围为 0—180.06 nmol NADPH·min-1·g-1FW(均值为90.03 nmol NADPH·min-1·g-1FW)。随着生育时期的推进,不同处理间NADP-ICDH活性均呈先上升后下降的变化趋势,于返青期达最大值,挑旗抽穗后NADP-ICDH活性变化不明显。不同生育时期,氮肥减施对NADP-ICDH活性有明显调控效应,从供试品种的平均值来看,随着施氮量的逐步减少,NADP-ICDH活性变化规律不尽一致。越冬期,较常规施氮量水平 N5相比,减施氮至 N3水平,NADP-ICDH活性无明显差异,N0水平NADP-ICDH活性却显著提高,平均增幅达 48.74%;返青期,NADP-ICDH活性表现为随着施氮量的减少先下降后升高,与N5相比,N4—N0水平NADP-ICDH活性均显著降低,下降幅度分别为 15.79%,40.78%,36.72%,24.68%,14.17%;拔节和挑旗抽穗期,NADP-ICDH活性均随施氮量减少而降低,与N5相比,N4水平无显著差异,N3—N0水平NADP-ICDH活性明显降低,差异达显著水平。由此可见,小麦生育中、后期,根中NADP-ICDH活性对氮肥施用量反应较为敏感,但将常规施氮肥减至N4水平,仍能维持较高活性。
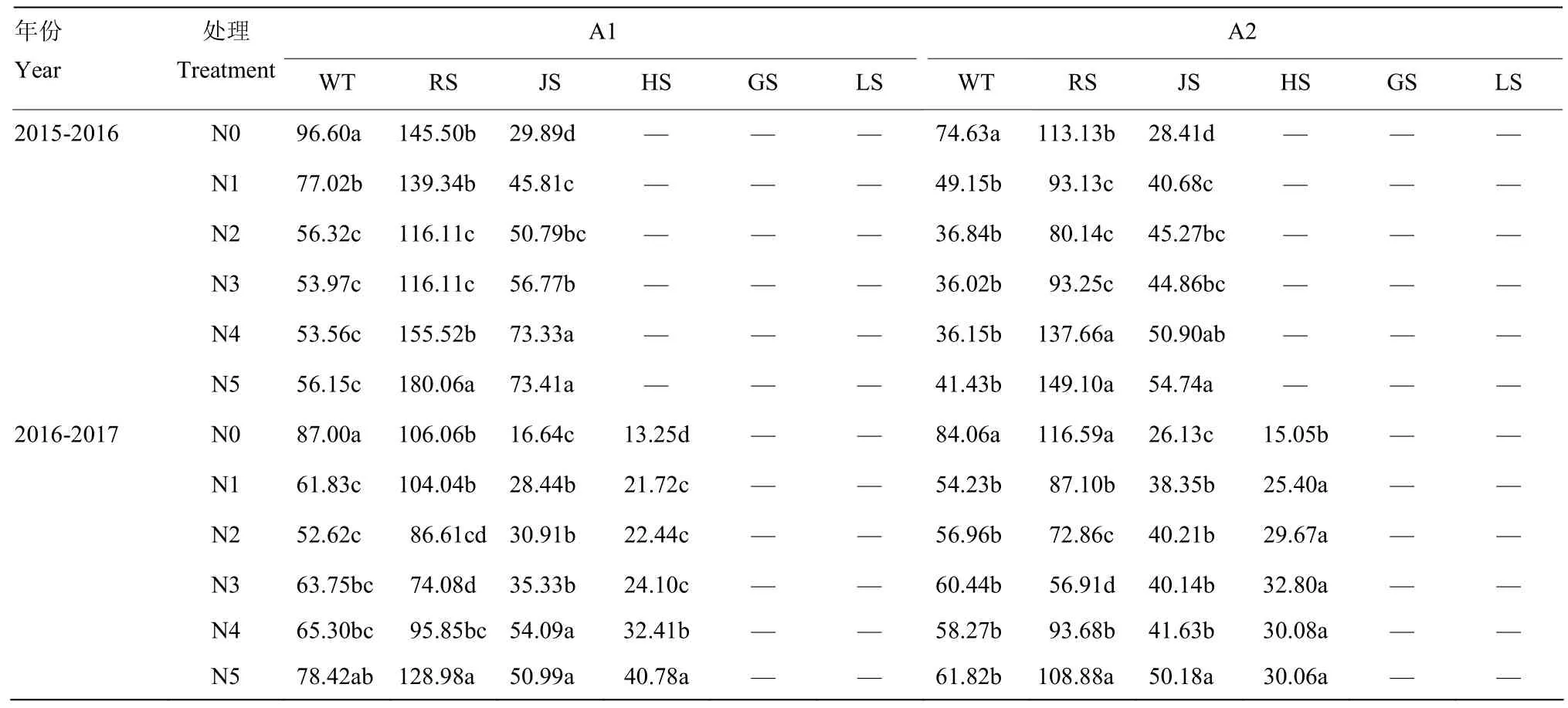
表1 不同施氮量下小麦根中NADP-ICDH活性Table 1 NADP-ICDH activity in wheat roots under different nitrogen application rates (nmol NADPH·min-1·g-1 FW)
2.1.2 NADP-苹果酸酶(NADP-ME)活性的动态变化表2可以看出,氮肥减施条件下,不同品种NADP-ME活性变化范围为 0—267.91 nmol NADPH·min-1·g-1FW(均值为 133.96 nmol NADPH·min-1·g-1FW)。随着生育时期的推进,NADP-ME活性呈先上升后下降的变化趋势,返青期达最大值,挑旗抽穗后NADP-ME活性变化不明显。不考虑品种间的差异,氮肥减施对NADP-ME活性的影响达显著水平。越冬期,与常规施氮水平 N5相比,2015—2016年度,减施氮至 N2水平,NADP-ME活性变化不明显,N1、N0水平显著升高;2016—2017年度,减施氮至N2水平,NADP-ME活性显著降低,N1、N0水平未达显著性差异。返青期,NADP-ICDH活性表现为随着施氮量的减少先下降后升高,与N5相比,N4—N0水平NADP-ICDH活性均显著降低,下降幅度分别为 13.66%,31.45%,31.30%,23.19%,19.24%。拔节和挑旗抽穗期,NADP-ME活性表现为随着施氮量的减少而降低,与N5相比,减施氮至N3水平NADP-ME未达显著性差异,N2—N0水平NADP-ME活性显著降低。表明施用氮肥有效提高小麦生育中、后期NADP-ME活性,但氮肥由 N5水平逐步减施到 N3水平对 NADP-ME活性影响较小。
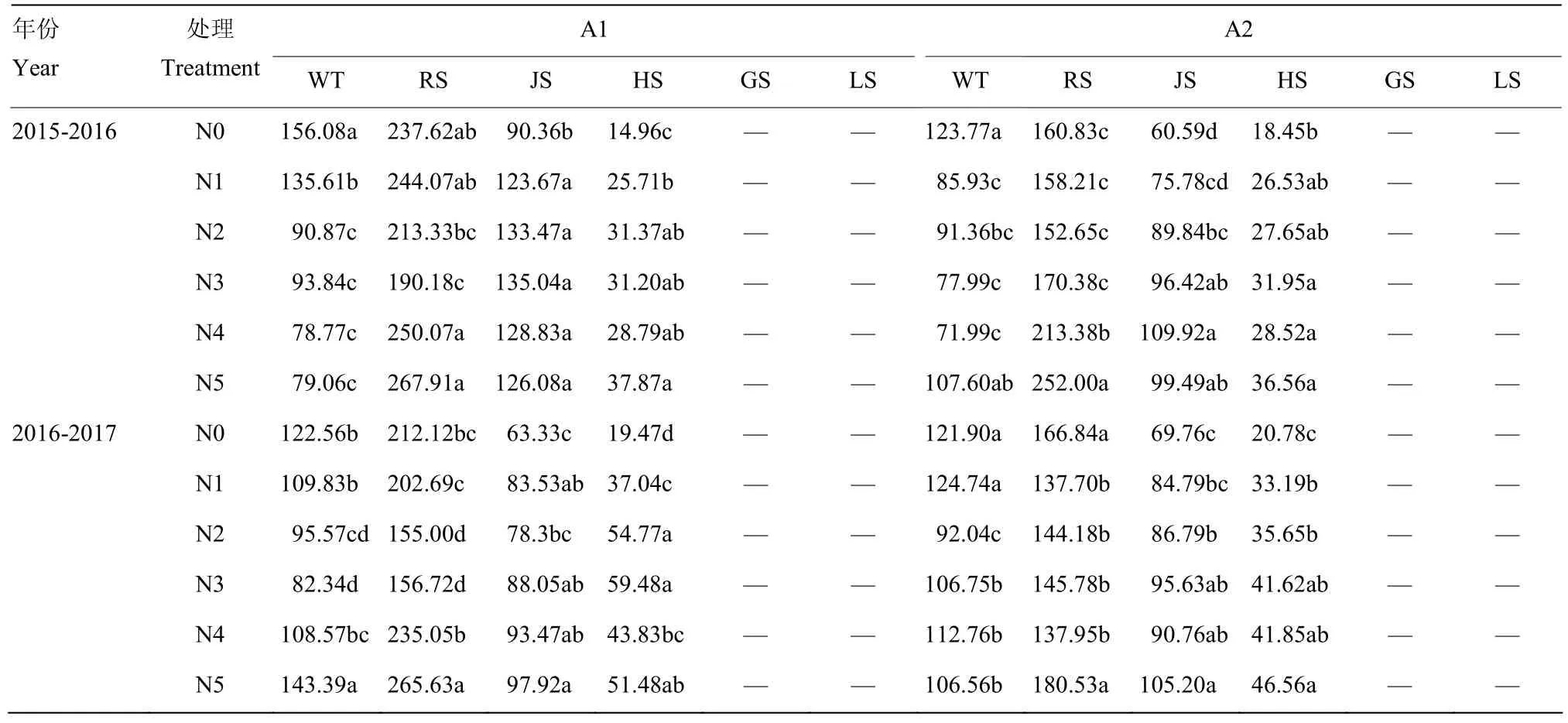
表2 不同施氮量下小麦根中NADP-ME活性Table 2 NADP-ME activity in wheat roots under different nitrogen application rates (nmol NADPH·min-1·g-1 FW)
2.1.3 戊糖磷酸途径总脱氢酶(G6PDH+6PGDH)活性的动态变化 表3可以看出,氮肥减施条件下,不同品种戊糖磷酸途径总脱氢酶活性变化范围为 0—735.53 nmol NADPH·min-1·g-1FW(均值为 367.76 nmol NADPH·min-1·g-1FW)。随着生育时期的推进,(G6PDH+6PGDH)不同处理间活性变化趋势一致,越冬期—返青期迅速升高,返青期—拔节期维持较高水平,拔节后迅速降低,蜡熟后变化不明显。N5—N2处理(G6PDH+6PGDH)活性于拔节期达最大值,N1、N0处理于返青期达最大值。越冬期,与N5相比,减施氮肥至 N4水平(G6PDH+6PGDH)活性变化不明显,N1、N0水平酶活性显著提高,平均增幅分别达54.25%,46.52%;返青期,不考虑品种间的差异,随着施氮量的减少(G6PDH+6PGDH)活性先降低后升高,与N5相比,减施氮水平N4—N1下酶活性降低,N5水平显著高于N3、N2水平;拔节—挑旗抽穗,与N5相比,N4—N1(G6PDH+6PGDH)活性显著降低,其中N4处理仅次于N5处理,平均降幅为11.46%;挑旗抽穗后,氮肥对(G6PDH+6PGDH)活性影响较小。由此说明,不论常规施氮还是减量施氮,在小麦生育前、中期,根中(G6PDH+6PGDH)活性均维持在较高水平;在生育后期,减施氮肥显著降低(G6PDH+6PGDH)活性,但N4水平降低幅度最小。
2.2 小麦不同生育时期根系活力(改良TTC法)的动态变化
由图1可以看出,氮肥减施条件下,不同品种根系活力变化范围为 0—350.70 μg TTC·g-1FW·h-1。随着生育时期的推进,根系活力均呈“高-低-高-低”变化,于越冬期和拔节期达较高水平。不同生育时期两品种间根系活力的变化趋势均表现为随着施氮量的减少而降低。氮肥减施对不同生育时期的影响程度存在较大差异,挑旗抽穗后不同氮肥处理对根系活力的影响均小于挑旗抽穗以前;越冬和拔节期不同处理间根系活力下降幅度明显高于返青和抽穗期,与 N5相比,越冬期和拔节期N4—N0水平根系活力平均下降幅度为8.07%,16.88%,36.42%,39.37%,61.73%。由此可见,氮肥对根系活力调控较大,与常规施氮(N5)相比,减施氮到 N4水平根系活力减幅较小,N3—N0水平根系活力明显降低。
2.3 不同施氮量下小麦产量及其构成因素的变化
表4可以看出,氮肥减施对小麦产量及其构成因素具有明显的调控效应。与常规施氮量N5相比,两年度减施氮水平单位面积穗数变化不尽一致,2015—2016年度,减施氮至N1水平穗数未达显著性差异,N0水平穗数显著降低,降低幅度为30.86%;2016—2017年度,减施氮至N4水平对穗数影响不明显,N3—N0水平穗数显著降低,降低幅度分别为10.34%,11.99%,14.03%,28.14%。与N5相比,氮肥减施至N2水平对穗粒数影响较小,N1、N0水平穗粒数显著降低,降低幅度分别达9.43%,12.69%。与N5相比,减施氮至N1水平千粒重无明显差异,N0水平千粒重显著增加,平均增加3.8 g。施氮水平N5—N1较不施氮水平N0籽粒产量有不同程度的提高,平均增产幅度为42.98%。进一步分析两年平均值可知,N5处理下籽粒产量最高,达9 238.02 kg·hm-2,N4处理次之,较N5处理降低0.3%。
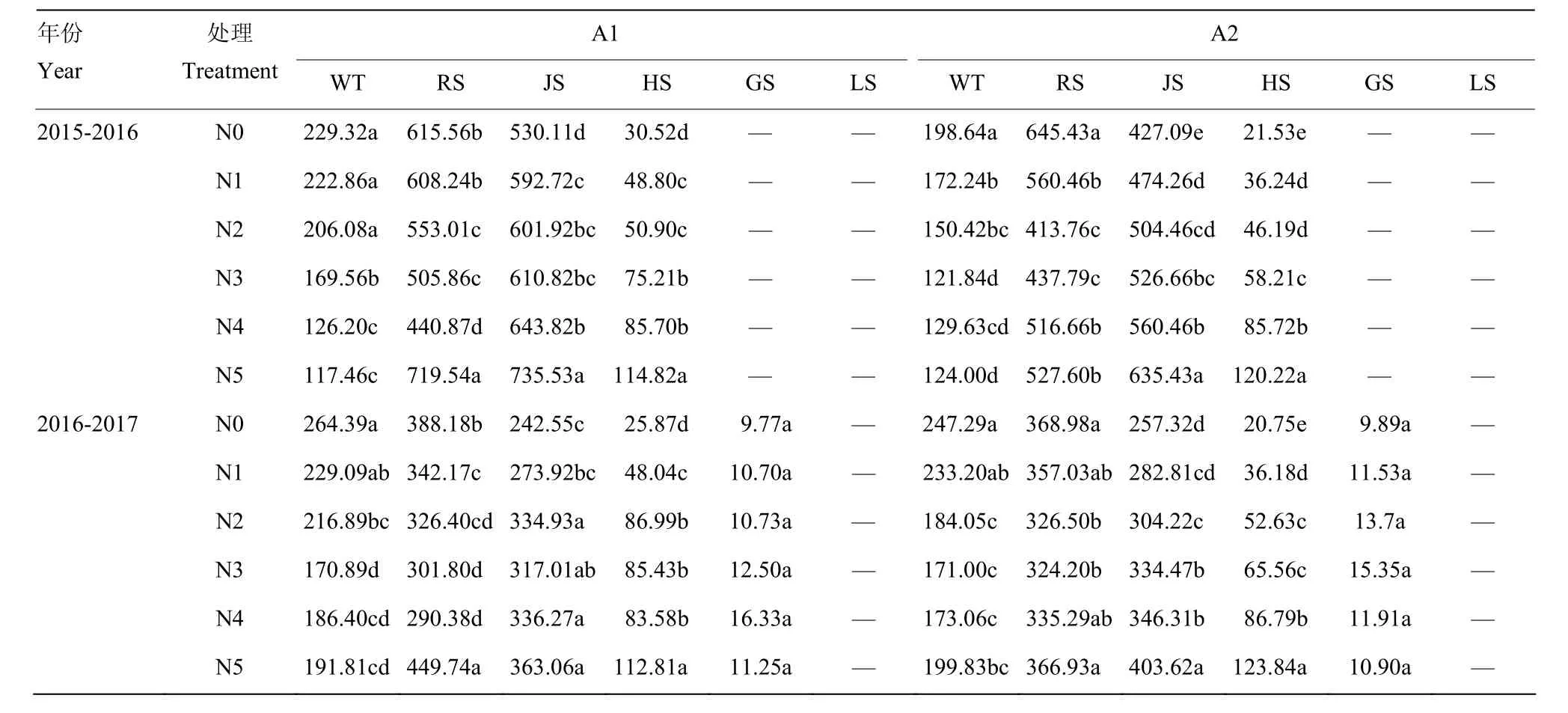
表3 不同施氮量下小麦根中(G6PDH+6PGDH)活性Table 3 (G6PDH+6PGDH) activity in wheat roots under different nitrogen application rates (nmol NADPH·min-1·g-1 FW)
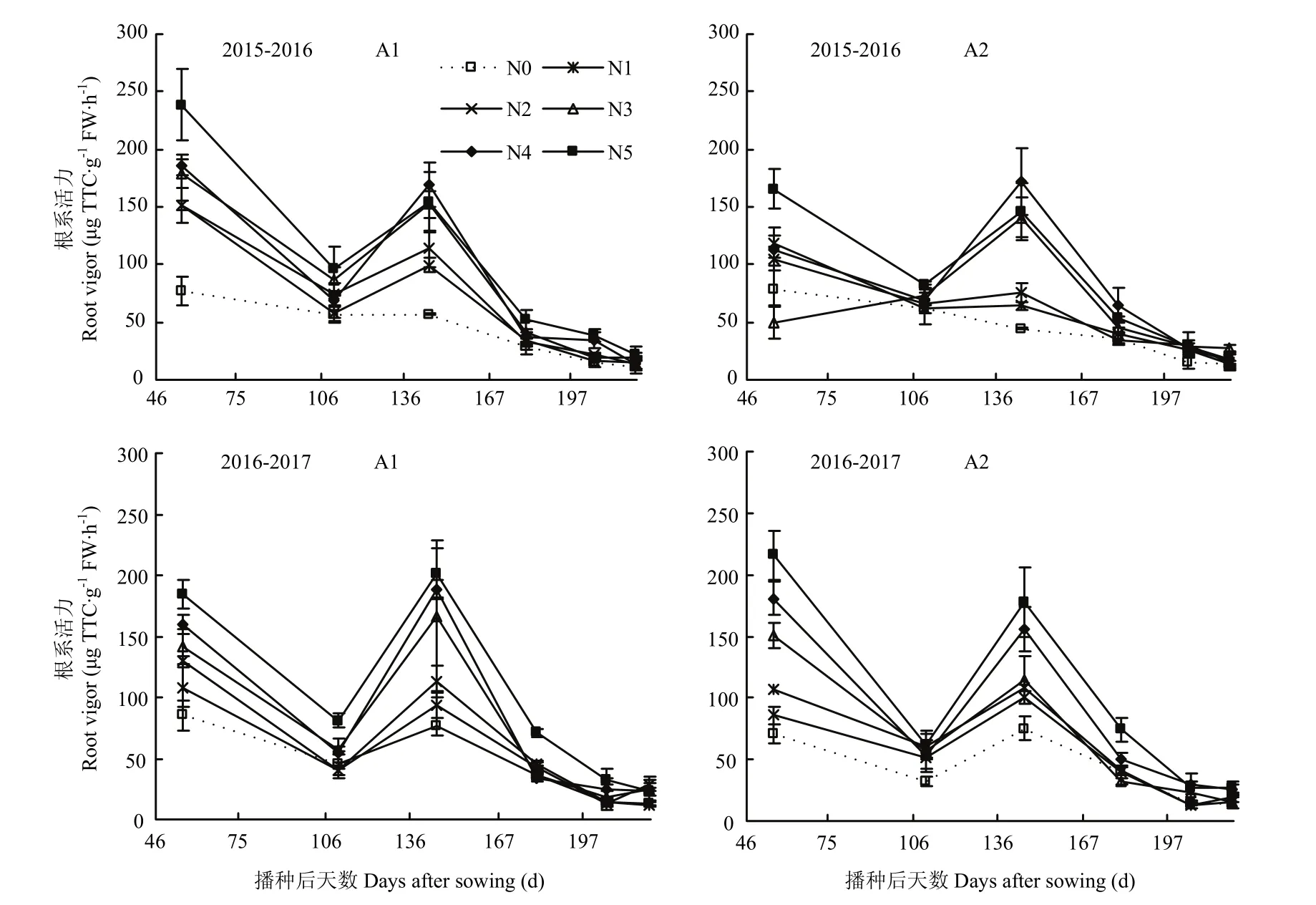
图1 小麦全生育期根系活力(改良TTC法)的动态变化Fig. 1 Dynamics of wheat root vigor (by improved TTC method) during the growing period
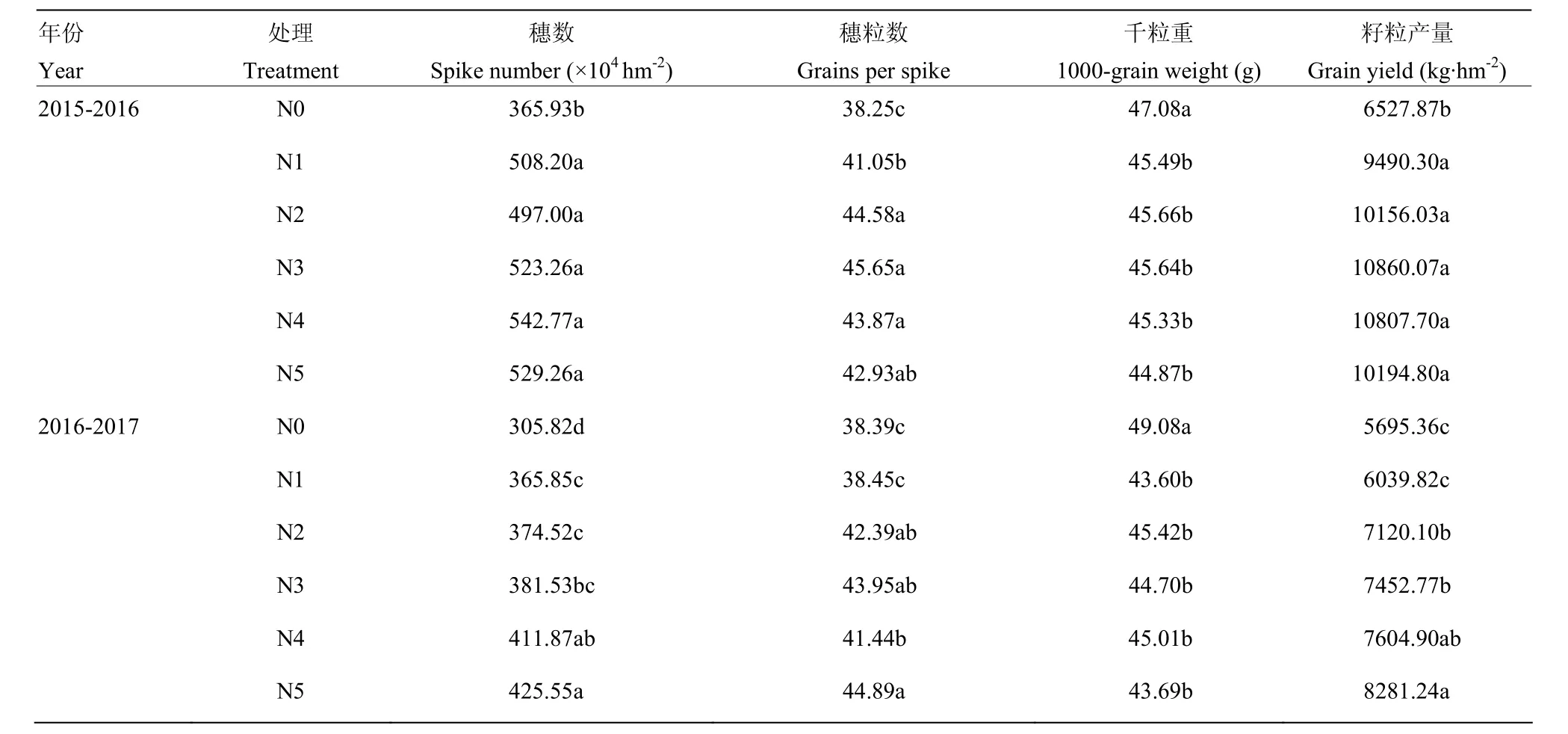
表4 不同施氮量下小麦产量及其构成因素的变化Table 4 Changes of wheat yield and its components under different nitrogen application rates
2.4 小麦根系活力(改良TTC法)、NADP-脱氢酶系统关键酶活性与产量的关系分析
2.4.1 根系活力与 NADP-脱氢酶系统关键酶活性的相关性 由表5可知,两年度均表现为小麦根中NADP-脱氢酶系统关键酶活性在越冬期与根系活力呈负相关关系,返青—灌浆期与根系活力呈正相关关系。生育中后期(拔节期和挑旗抽穗期)NADP-ICDH,NADP-ME和(G6PDH+6PGDH)活性均与根系活力呈极显著正相关关系;挑旗抽穗以后 NADP-ICDH,NADP-ME活性不明显;灌浆期(G6PDH+6PGDH)活性与根系活力呈极显著正相关关系。表6表明在小麦越冬—挑旗抽穗,NADP-ICDH,NADP-ME和(G6PDH+6PGDH)活性之间均呈极显著正相关关系。说明在小麦生长发育期间,NADPH再生系统中NADP-ICDH,NADP-ME和(G6PDH+6PGDH)之间密切相关。
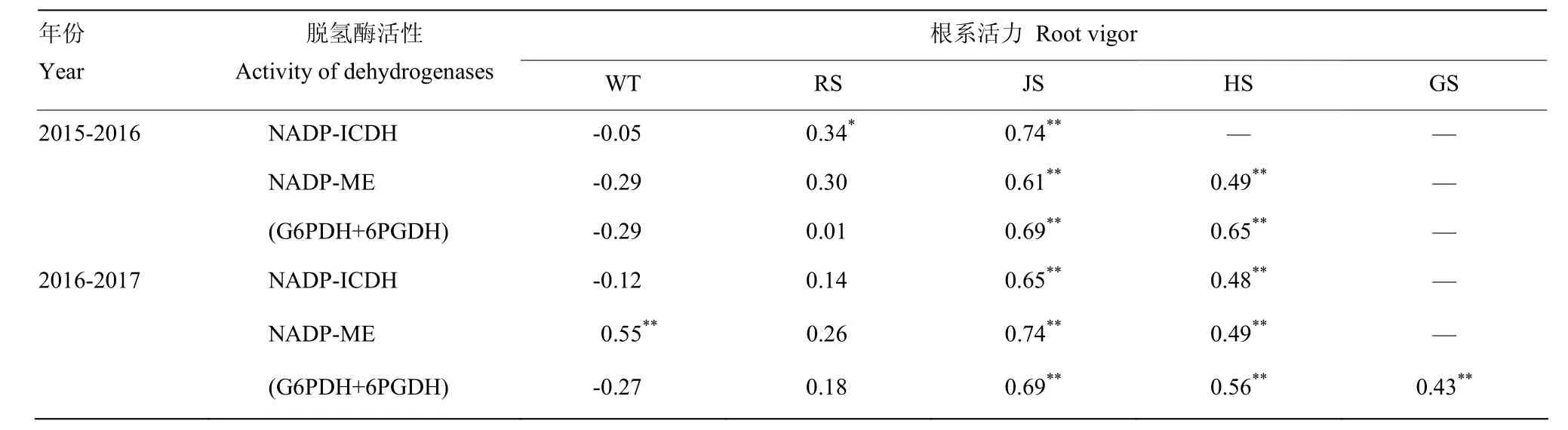
表5 小麦不同生育时期根系活力与根中NADP-脱氢酶系统关键酶活性的相关关系Table 5 Correlation between root vigor and activity of key enzymes in NADP-dehydrogenase system in wheat roots at different growth stages
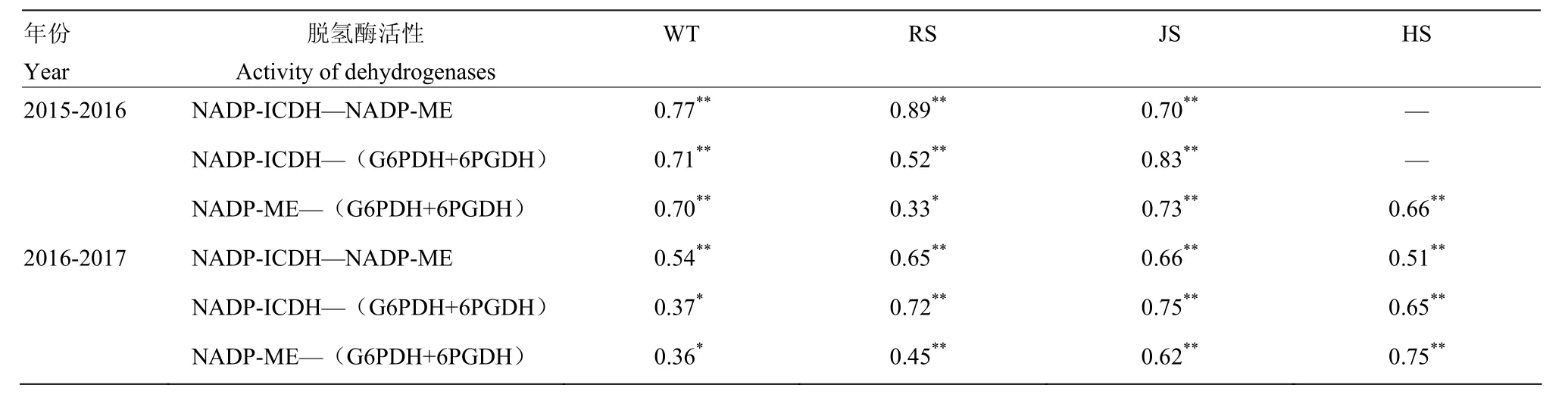
表6 小麦不同生育时期根中NADP-脱氢酶系统关键酶活性间的相关关系(r)Table 6 Correlation between activity of key enzymes in NADP-dehydrogenase system in wheat roots at different growth stages (r)
2.4.2 根系活力和根中NADP-脱氢酶系统关键酶活性与产量的相关分析 由表7可知,两年度根系活力均与产量在不同生育时期之间呈正相关关系,拔节—蜡熟期达极显著正相关。NADP-ICDH,NADP-ME,(G6PDH+6PGDH)活性与产量在越冬—返青期间呈负相关关系,返青以后呈正相关关系。2015—2016年度NADP-ICDH,NADP-ME,(G6PDH+6PGDH)在越冬期与产量达极显著负相关;于拔节和挑旗抽穗期达极显著正相关。
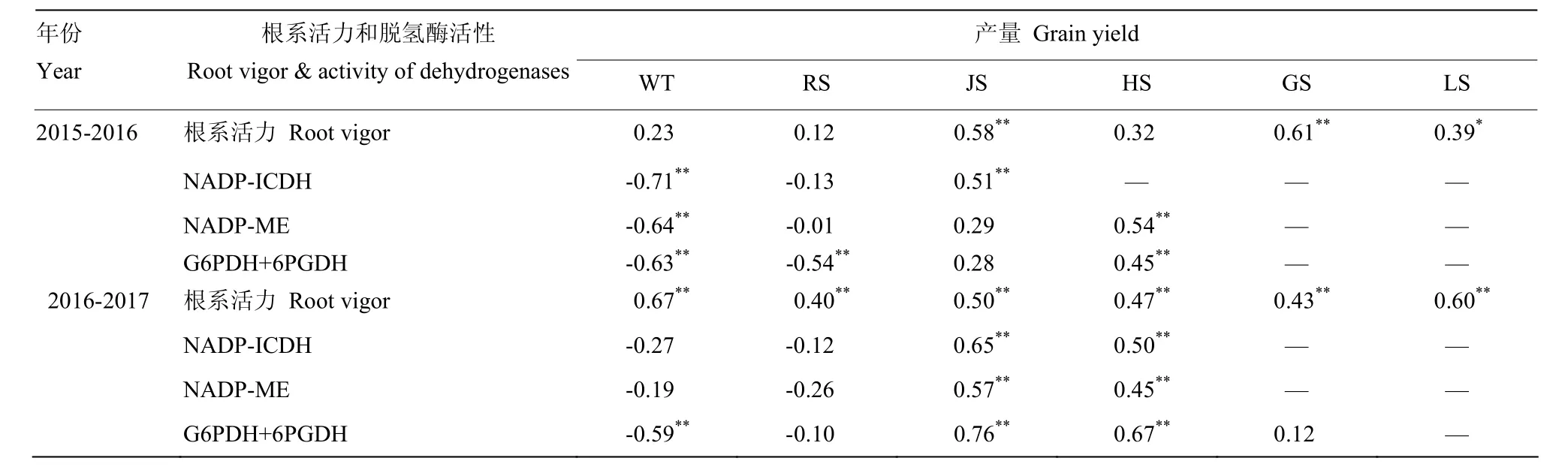
表7 小麦不同生育时期根系活力和根中NADP-脱氢酶系统关键酶活性与产量的相关关系(r)Table 7 Correlation between root vigor, activity of key enzymes in NADP-dehydrogenase system in wheat roots at different growth stages with grain yield (r)
2.4.3 根系活力和根中NADP-脱氢酶系统关键酶活性与产量的通径分析 为了进一步明确小麦根中 NADP-脱氢酶系统中的关键酶 NADP-ME,(G6PDH+6PGDH),NADP-ICDH和根系活力对产量的作用方式和影响程度,在拔节期和挑旗抽穗期,对 NADPME,(G6PDH+6PGDH),NADP-ICDH 和根系活力与产量进行通径分析(表8)。两年度NADP-ICDH在拔节期对产量有较大的(0.62,0.25)正向直接作用,对产量的影响达极显著水平(0.51**,0.64**);挑旗抽穗期(G6PDH+6PGDH)对产量有较大的(0.18,0.62)正向直接作用,对产量的影响达极显著水平(0.45**,0.67**)。氮肥减施条件下,两年度拔节期小麦根中 NADP-脱氢酶系统关键酶活性和根系活力与产量的关系不尽一致。2015—2016年度,根系活力对产量具有较大的正向直接作用(0.55),虽然通过戊糖磷酸途径脱氢酶(G6PDH+ 6PGDH)有较大的负向间接作用(-0.39),但被NADP-ICDH较大的正向间接(0.46)作用所抵消,使根系活力对产量的影响达极显著水平(0.58**);2016—2017年度,根系活力对产量具有较大的负向直接作用(-0.26),但被NADP-ME,(G6PDH+ 6PGDH),NADP-ICDH较大的正向间接作用(0.20,0.13,0.45)所抵消,并且使根系活力对产量的影响达极显著水平(0.50**)。挑旗抽穗期根系活力对产量均具有较小的直接作用(-0.01,0.04),但是被 NADP-ME和(G6PDH+6PGDH)较大的正向间接作用(0.21,0.12;0.39)所增强(除第二年度,NADP-ME对产量间接作用较小(-0.02)),使根系活力对产量的影响增强或达显著水平(0.32,0.46**)。可见,小麦根系中NADP-ME和(G6PDH+6PGDH)活性对根系活力影响较大。
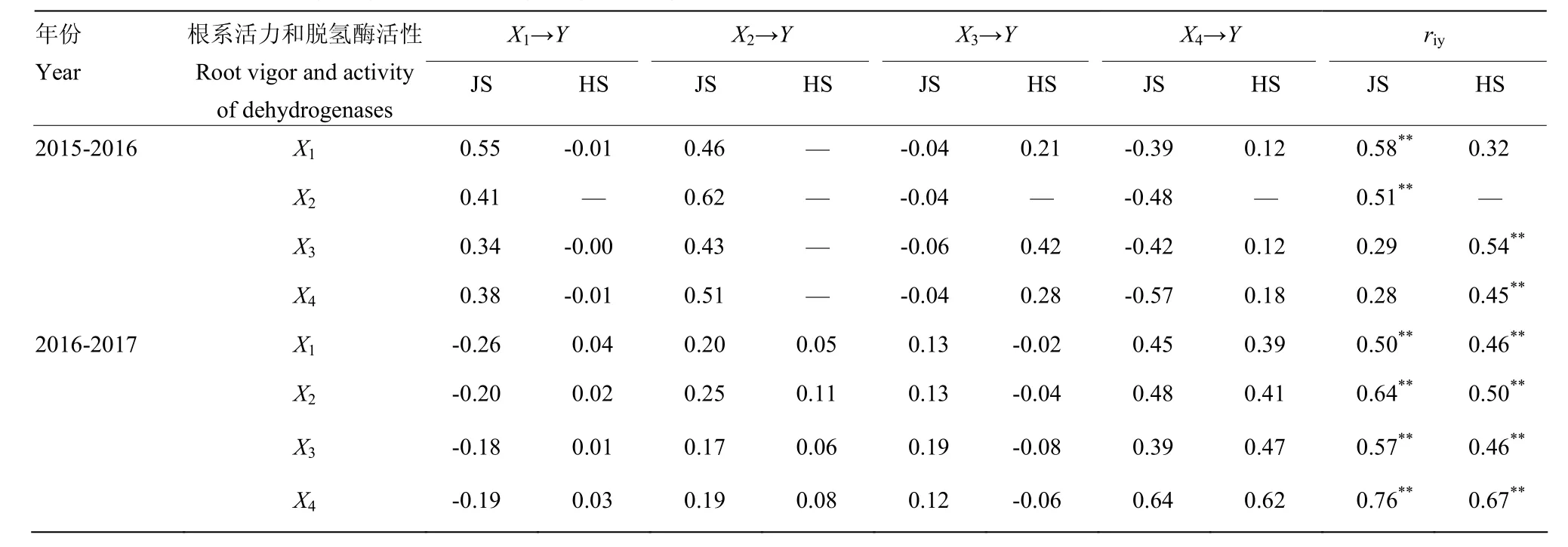
表8 小麦拔节和挑旗抽穗期根系活力和根中NADP-脱氢酶系统关键酶活性(Xi)与产量(Y)关系的通径分析(riy)Table 8 Path analysis (riy) on relationships between root vigor, activity of key enzymes in NADP-dehydrogenase system (Xi) in roots at jointing stage and heading stage with grain yield (Y) in wheat
3 讨论
3.1 不同生育时期小麦根中 NADP-脱氢酶系统关键酶活性的变化及其相互关系
小麦根中NADP-脱氢酶系统关键酶不仅是碳代谢过程中的关键酶,还参与逆境条件下防御应激反应[21,25]。本研究中,NADP-ME,NADP-ICDH 和(G6PDH+6PGDH)活性于返青前表现为减施氮肥(N4—N1)处理低于不施氮肥(N0)处理。前人于盐胁迫条件下发现,随着胁迫时间的增加,小麦根系中G6PDH表达量先增加后降低[26]。本研究结果显示,根中(G6PDH+6PGDH)活性于返青后随着施氮量的减少呈下降趋势。除此之外,根中 NADP-ME和NADP-ICDH活性也于返青后表现出相同的变化趋势。这可能是由于返青前温度较低,较高的 NADP-脱氢酶系统关键酶活性可以减缓氮肥减施对根系的影响,有利于小麦安全越冬;返青后,温度回升,小麦地上部营养器官快速生长发育,这种受到氮肥减施影响的自身调节不能长时间维持。本试验结果表明,于返青后,较常规施氮处理N5相比,N4处理中NADP-ICDH和 NADP-ME活性未达显著性差异,(G6PDH+6PGDH)活性也仅次于N5处理。综上所述,小麦根中 NADP-脱氢酶系统关键酶活性于生育中、后期对氮肥施用水平反应较为灵敏,氮肥减施对返青后NADP-脱氢酶系统关键酶影响较大,但就本试验条件而言,适当将氮肥由常规施氮225 kg·hm-2(N5)减至202.5 kg·hm-2(N4)水平,对NADP-脱氢酶系统关键酶活性影响较小。
在逆境条件下(低温胁迫,干旱胁迫,盐胁迫),小麦中NADP-ME和G6PDH都会作出防御应答响应,以维持自身正常生长[26-27]。本研究表明,氮肥减施条件下,不同生育时期NADP-脱氢酶系统关键酶活性变化规律基本一致,NADP-ICDH、NADP-ME与(G6PDH+6PGDH)三者相互之间均呈显著或极显著正相关。由此可知,在小麦生长发育过程中,NADP-ICDH、NADP-ME与(G6PDH+6PGDH)三者之间密切相关。
3.2 减施氮肥对小麦根系活力的影响
有研究表明,随着施氮量增多,根系活力升高,表现为N225>N120>N0[28]。本试验条件下,两年度不同处理根系活力均为 N5(225 kg·hm-2)最高,N0(0 kg·hm-2)最低,且将施氮量由 225 kg·hm-2逐步减至 0 kg·hm-2过程中各氮肥处理(N4—N1)根系活力也呈逐步递减趋势。前人研究表明,根系主要分布在耕作层(0—20 cm)中,适宜的施氮量明显促进根系生长,扩大根群,增加根量,而减施氮肥则大幅度降低0—20 cm土层中根质量密度[29-31]。由此可见,减施氮肥条件下0—20 cm土层中根质量密度下降,土壤中新生根系的量减少,单位面积下新老根比例减小,引起耕层土壤中根系活力降低。
3.3 小麦根系活力(改良TTC法),NADP-脱氢酶系统关键酶和产量的关系
有研究表明在小麦分蘖期、拔节期和孕穗期,较强根系活力显著提高单株成穗数、穗粒数和千粒重[32]。本研究发现,N5、N4水平下,根系活力均维持在较高水平,籽粒产量也较高且两处理间差异未达显著水平,就整个生育期而言,拔节期—蜡熟期根系活力与产量达极显著正相关(表7)。类似的研究发现,水稻和大麦根中脱氢酶活性于孕穗期与产量呈极显著正相关关系[33]。本试验条件下,NADP-脱氢酶系统关键酶活性在拔节挑旗抽穗期与产量同样呈显著或极显著正相关关系(表7),并且其与根系活力在小麦生育中、后期也达极显著正相关(表5)。综上所述,施肥量为N5、N4水平时,有利于小麦生育中、后期根中NADP-脱氢酶系统关键酶活性增强,促进提高根系活力。较强的根系可以吸收更多的水分和养分并向地上部转移,提高籽粒产量[17]。本文进一步分析结果又显示,NADP-ME和(G6PDH+6PGDH)对根系活力有较大的正向间接作用,使根系活力对产量的影响达显著水平(表8)。综合看来,NADP-脱氢酶系统关键酶活性对籽粒产量的直接影响和通过作用于根系活力对产量的间接影响均较大,其中 NADP-ME和(G6PDH+6PGDH)活性对产量和根系活力的影响更大(表8)。这可能与氮肥减施减弱了根中 NADP-脱氢酶系统关键酶活性有关,而NADPH合成量减少影响到根系呼吸代谢活动。鉴于此,在小麦生产实践中可以通过栽培措施和分子育种手段,促进 NADP-ME和戊糖磷酸途径总脱氢酶(G6PDH+6PGDH)在根中的高表达以促进NADPH合成,进一步提高小麦根系活力。
4 结论
与常规施氮水平N5(225 kg·hm-2)相比,减施氮肥至N4(202.5 kg·hm-2)水平,小麦根中NADP-脱氢酶系统关键酶活性和根系活力影响较小;两处理间穗数、穗粒数、千粒重差异均未达到显著水平;籽粒产量较N5处理仅降低0.3%,未达显著性差异。所以综合考虑 NADP-脱氢酶系统关键酶活性和根系活力变化及籽粒产量表现,氮肥施用量减至 N4水平是实现减氮不减产的最佳施氮量。NADP-脱氢酶系统关键酶活性与采用改良“TTC法”测定的根系活力密切相关,其中NADP-ME和G6PDH+6PGDH活性对根系活力的影响最大。在黄淮平原典型农田,氮肥用量由高产田目前的常规量 225 kg·hm-2减至 202.5 kg·hm-2甚至更低用量时,可通过分子育种手段和有效栽培措施实现NADP-ME和(G6PDH+6PGDH)在根中的高表达以提高小麦根系活力,进而实现逐步减氮不减活性,促进植株正常发育和产量形成。
[1]巨晓棠, 谷保静. 我国农田氮肥施用现状、问题及趋势. 植物营养与肥料学报, 2014, 20(4): 783-795.JU X T, GU B J. Status-quo, problem and trend of nitrogen fertilization in China.Journal of Plant Nutrition and Fertilizer, 2014,20(4): 783-795. (in Chinese)
[2]HE P, LI S T, JIN J Y, WANG H T, LI C J, WANG Y L, CUI R Z.Performance of an optimized nutrient management system for double-cropped wheat-maize rotations in North-Central China.Agronomy Journal, 2009, 101(6): 1489-1496.
[3]张丽娟, 马友华, 王桂苓, 孙丽, 朱小红, 汪丽婷. 农业面源污染中农田氮污染危害及其防治措施. 农业环境与发展, 2010, 27(4):48-52.ZHANG L J, MA Y H, WANG G L, SUN L, ZHU X H, WANG L T.Pollution of farmland nitrogen pollution in agricultural non-point source pollution and its control measures.Agro-Environment &Development, 2010, 27(4): 48-52. (in Chinese)
[4]张均. 不同施氮水平对不同品质类型小麦根系发育的影响及特殊根毛的研究[D]. 河南: 河南农业大学, 2008.ZHANG J. Effects of different nitrogen levels on root development of wheat with different quality traits and studies on special root hairs[D].Henan: Henan Agriculture University, 2008. (in Chinese)
[5]徐晴, 许甫超, 董静, 秦丹丹, 李梅芳. 小麦氮素高效育种研究进展. 麦类作物学报, 2016, 36(1): 44-50.XU Q, XU F C, DONG J, QIN D D, LI M F. Research advances on nitrogen use efficiency (NUE) in wheat (Tritium aestivumL.) breeding.Journal of Triticeae Crops, 2016, 36(1): 44-50. (in Chinese)
[6]HUANG J, HUANG Z, JIA X, HU R, XIANG C. Long-term reduction of nitrogen fertilizer use through knowledge training in rice production in China.Agricultural Systems, 2015, 135: 105-111.
[7]马元喜. 小麦的根. 北京: 中国农业出版社, 1999.MA Y X.The Root of Wheat. Beijing: China Agriculture Press, 1999.(in Chinese)
[8]刘小刚, 张富仓, 杨启良, 李志军. 玉米叶绿素、脯氛酸、根系活力对调亏灌溉和氮肥处理的响应. 华北农学报, 2009, 24(4):106-111.LIU X G, ZHANG F C, YANG Q L, LI Z J. Response of chlorophyll,proline and root activity of maize to regulated deficit irrigation and N fertilization treatment.Acta Agriculturae Boreali-Sinica, 2009, 24(4):106-111. (in Chinese)
[9]魏道智, 宁书菊, 林文雄. 小麦根系活力变化与叶片衰老的研究.应用生态学报, 2004, 15(9): 1565-1569.WEI D Z, NING S J, LIN W X. Relationship between wheat root activity and left senescence.Chinese Journal of Applied Ecology,2004, 15(9): 1565-1569. (in Chinese)
[10]王飞飞, 张善平, 邵立杰, 李耕, 陈晓璐, 刘鹏, 赵秉强, 董树亭,张吉旺, 赵斌. 夏玉米不同土层根系对花后植株生长及产量形成的影响. 中国农业科学, 2013, 46(4): 4007-4017.WANG F F, ZHANG S P, SHAO L J, LI G, CHEN X L, LIU P, ZHAO B Q, DONG S T, ZHANG J W, ZHAO B. Effect of root in different soil layers on plant growth and yield formation after anthesis in summer maize.Scientia Agricultura Sinica,2013, 46(4): 4007-4017.(in Chinese)
[11]胡敏, 贺德先. 小麦根系活力的昼夜变化及最佳取样和测定时间.麦类作物学报, 2011, 31(6): 1094-1098.HU M, HE D X. Study on diurnal fluctuations of physiological activity of roots and the optimal time to sample and determine their activity in wheat (Triticum aestivumL.).Journal of Triticeae Crops,2011, 31(6): 1094-1098. (in Chinese)
[12]熊淑萍, 吴克远, 王小纯, 张捷, 杜盼, 吴懿鑫, 马新明. 不同氮效率基因型小麦根系吸收特性与氮素利用差异的分析. 中国农业科学, 2016, 49(12): 2267-2279.XIONG S P, WU K Y, WANG X C, ZHANG J, DU P, WU Y X, MA X M. Analysis of root absorption characteristics and nitrogen utilization of wheat genotypes with different N efficiency.Scientia Agricultura Sinica, 2016, 49(12): 2267-2279. (in Chinese)
[13]左文博, 吴静利, 杨奇, 张嘉楠, 刘桂茹. 干旱胁迫对小麦根系活力和可溶性糖含量的影响. 华北农学报, 2010, 25(6) :191-193.ZUO W B, WU J L, YANG Q, ZHANG J N, LIU G R. Study on the influence of root of different wheat varieties under drought stress.Acta Agriculturae Boreali-Sinica, 2010, 25(6): 191-193. (in Chinese)
[14]张素瑜, 王和洲, 杨明达, 王静丽, 贺德先. 水分与玉米秸秆还田对小麦根系生长和水分利用效率的影响. 中国农业科学, 2016,49(13): 2484-2496.ZHANG S Y, WANG H Z, YANG M D, WANG J L, HE D X.Influence of returning corn stalks to field under different soil moisture contents on root growth and water use efficiency of wheat (Triticum aestivumL.).Scientia Agricultura Sinica, 2016, 49(13): 2484-2496.(in Chinese)
[15]熊明彪, 罗茂盛, 田应兵, 宋光煜, 曹叔尤. 小麦生长期土壤养分与根系活力变化及其相关性研究. 土壤通报, 2005(5): 700-703.XIONG M B, LUO M S, TIAN Y B, SONG G Y, CAO S Y.Dynamics of soil nutrition and wheat root activities during wheat growth.Chinese Journal of Soil Science, 2005(5): 700-703. (in Chinese)
[16]王秀波, 上官周平. 干旱胁迫下氮素对不同基因型小麦根系活力和生长的调控. 麦类作物学报, 2017, 37(6): 820-827.WANG X B, SHANG G Z P. Effect of nitrogen on root vigor and growth in different genotypes of wheat under drought stress.Journal of Triticeae Crops, 2017, 37(6): 820-827. (in Chinese)
[17]程乙, 王洪章, 刘鹏, 董树亭, 赵久然, 王荣焕, 张吉旺, 赵斌, 李耕, 刘月娥. 品种和氮素供应对玉米根系特征及氮素吸收利用的影响. 中国农业科学, 2017, 50(12): 2259-2269.CHENG Y, WANG H Z, LIU P, DONG S T, ZHAO J R, WANG R H,ZHANG J W, ZHANG B, LI G, LIU Y E. Effect of different maize varieties and nitrogen supply on root characteristics and nitrogen uptake and utilization efficiency.Scientia Agricultura Sinica, 2017,50(12): 2259-2269. (in Chinese)
[18]黄国勤, 黄小洋, 张兆飞, 刘隆旺, 章秀福, 高旺盛. 免耕对水稻根系活力和产量性状的影响. 中国农学通报, 2005, 21(5): 170-173.HUANG G Q, HUANG X Y, ZHANG Z F, LIU L W, ZHANG X F,GAO W S. Effect of no-tillage on the root activity and yield characters in rice.Chinese Agricultural Science Bulletin. 2005, 21(5): 170-173.(in Chinese)
[19]张雄. 用“TTC”法(红四氮唑)测定小麦根和花粉的活力及其应用.植物生理学通讯, 1982(3): 48-50.ZHANG X. Determination and application of wheat roots and pollen by "TTC" method (Tetrazolium Red).Plant Physiology Communications,1982(3): 48-50. (in Chinese)
[20]BOUTHOUR D, KALAI T, CHAFFEI H C, GOUIA H, CORPAS F J.Differential response of NADP-dehydrogenases and carbon metabolism in leaves and roots of two durum wheat (Triticum durumDesf.) cultivars (Karim and Azizi) with different sensitivities to salt stress.Journal of Plant Physiology, 2015, 179: 56-63.
[21]GAJEWSKA E, NIEWIADOMSKA E, TOKARZ K, SLABA M,SKLODOWKA M. Nickel-induced changes in carbon metabolism in wheat shoots.Journal of Plant Physiology, 2013, 170(4): 369-377.
[22]DRINCOVICH M F, CASATI P, ANDREO C S. NADP-malic enzyme from plants: A ubiquitous enzyme involved in different metabolic pathways.FEBS Letters, 2001, 490(1/2): 1-6.
[23]罗璇, 郭彤, 胡银岗. 小麦和谷子 C4光合途径关键酶活性及其与光合和蒸腾的关系. 麦类作物学报, 2014, 34(8): 1083-1091.LUO X, GUO T, HU Y G. Comparative study on the activities of the key enzymes involved in C4 photosynthesis pathway and their correlations with photosynthetic and transpiration rate in wheat and foxtail millet.Journal of Triticeae Crops, 2014, 34(8): 1083-1091. (in Chinese)
[24]FU Z Y, ZHANG Z B, LIU Z H, HU X J , XU P. The effects of abiotic stresses on the NADP-dependent malic enzyme in the leaves of the hexaploid wheat.Biologia Plantarum, 2011, 55(1): 196-200.
[25]刘增辉, 邵宏波, 初立业, 张正斌. 干旱、盐、温度对植物体NADP-苹果酸酶的影响和机理. 生态学报, 2010, 30(12): 3334-3339.LIU Z H, SHAO H B, CHU L Y, ZHANG Z B. The effect and the mechanism of drought, salt and temperature on NADP-malic enzymes in plants.Acta Ecologica Sinica,2010, 30(12): 3334-3339. (in Chinese)
[26]NEMOTO Y, SASAKUMA T. Specific expression of glucose-6-phosphate dehydrogenase (G6PDH) gene by salt stress in wheat(Triticum aestivumL.).Plant Science, 2000, 158(1/2): 53-60.
[27]刘增辉. 小麦 NADP-苹果酸酶与逆境关系的初步研究[D]. 山东:青岛科技大学, 2010.LIU Z H. Preliminary study on the relation of NADP-malic enzyme and stresses[D]. Shandong: Qingdao University of Science &Technology, 2010. (in Chinese)
[28]熊淑萍, 王静, 王小纯, 丁世杰, 马新明. 耕作方式及施氮量对砂姜黑土区小麦氮代谢及籽粒产量和蛋白质含量的影响. 植物生态学报, 2014, 38(7): 767-775.XIONG S P, WANG J, WANG X C, DING S J, MA X M. Effects of tillage and nitrogen addition rate on nitrogen metabolism, grain yield and protein content in wheat in lime concretion black soil region.Chinese Journal of Plant Ecology, 2014, 38(7): 767-775. (in Chinese)
[29]苗果园, 高志强, 张云亭, 尹钧, 张爱良. 水肥对小麦根系整体影响及其与地上部相关的研究. 作物学报, 2002, 28(4): 445-450.MIAO G Y, GAO Z Q, ZHANG Y T, YIN J, ZHANG A L. Effect of water and fertilizer to root system and its correlation with tops in wheat.Acta Agronomica Sinica, 2002, 28(4): 445-450. (in Chinese)
[30]董桂春, 陈琛, 袁秋梅, 羊彬, 朱正康, 曹文雅, 仲军, 周娟, 罗刚,王熠, 黄建晔, 王余龙. 氮肥处理对氮素高效吸收水稻根系性状及氮肥利用率的影响. 生态学报, 2016, 36(3): 642-651.DONG G C, CHEN C, YUAN Q M, YANG B, ZHU Z K, CAO W Y,ZHONG J, ZHOU J, LUO G, WANG Y, HUANG J Y, WANG Y L.The effect of nitrogen fertilizer treatments on root traits and nitrogen use efficiency inindicarice varieties with high nitrogen absorption efficiency.Acta Ecologica Sinica, 2016, 36(3): 642-651.(in Chinese)
[31]邱喜阳, 王晨阳, 王彦丽, 朱云集, 郭天财. 施氮量对冬小麦根系生长分布及产量的影响. 西北农业学报, 2012, 21(1): 53-58.QIU X Y, WANG C Y, WANG Y L, ZHU Y J, GUO T C. Effects of nitrogen application rate on root system distribution and grain yield of winter wheat cultivars.Acta Agriculturae Boreali-Occidentalis Sinica,2012, 21(1): 53-58. (in Chinese)
[32]周广生, 梅芳竹, 陈艳华. 冬小麦根系活力与产量性状关系的研究.华中农业大学学报, 2001, 20(6): 531-534.ZHOU G S, MEI F Z, CHEN Y H. Studies on relations between root vigor of winter wheat and its yield characters.Journal of Huazhong Agricultural University, 2001, 20(6): 531-534. (in Chinese)
[33]何念祖, 倪吾钟. 作物根系脱氢酶活性与作物生长的关系. 土壤通报, 1995, 26(7): 55-56.HE N Z, NI W Z. Relationship between crop root dehydrogenase activity and crop growth.Chinese Journal of Soil Science, 1995, 26(7):55-56. (in Chinese)

