壳聚糖对蛋种鸡血清中脂类物质及脂肪细胞因子含量的影响
刘志友 李胤豪 闫素梅* 史彬林 赵启龙 张鹏飞
(1.内蒙古农业大学动物科学学院,内蒙古自治区动物营养与饲料科学重点实验室,呼和浩特 010018; 2.赤峰市农牧科学研究院,赤峰 024031)
鸡蛋是鸡胚发育所需营养物质的唯一来源,其所含能量是鸡胚生长发育的第一限制性因素。鸡蛋中的蛋白质主要用于组织生长,而蛋黄中的脂质则是胚胎发育的主要能量来源。蛋种鸡脂质代谢活跃,以此满足蛋黄脂质沉积的需要。因此,有效调节蛋种鸡的脂质代谢对改善机体健康、提高其生产性能具有重要的意义。
血清中脂类物质及脂肪细胞因子含量是反映动物脂质代谢的重要指标。研究表明壳聚糖及其衍生物因含有氨基和羟基等具有生物活性的功能基团,在动物饲粮中适量添加后具有调节脂质代谢的功效[1]。目前有关壳聚糖对禽类脂质代谢影响的相关报道较少。Zhou等[2]发现,饲粮中添加0.14%或0.28%的壳聚糖可以降低肉仔鸡的腹脂率,提高血液中高密度脂蛋白胆固醇(HDL-C)的含量,并且改善胸肌的肉质,降低胸肌中总饱和脂肪酸的含量,增加单不饱和脂肪酸的含量。Kobayashi等[3]报道,高脂饲粮中添加0.5%的壳聚糖对鸡的生长性能无显著影响,但可以降低腹脂率及小肠内脂肪酶的活性。然而,也有一些不同的研究结果。Keser等[4]在肉鸡饲粮中添加0.025%壳聚糖后发现,壳聚糖仅降低了血液中低密度脂蛋白胆固醇(LDL-C)的含量,对生长性能及血液中总胆固醇(TC)、HDL-C、甘油三酯(TG)的含量并无显著影响。鉴于不同研究者所得结论不尽一致,且添加量存在差异,尤其是针对蛋种鸡的研究报道甚少,本试验拟通过在基础饲粮中添加不同水平的壳聚糖,研究其对蛋种鸡血清中脂类物质及脂肪细胞因子含量的影响,探讨壳聚糖对蛋种鸡脂质代谢的影响,为深入研究壳聚糖对蛋种鸡脂质代谢的影响机制并改善其脂质代谢提供理论依据。
1 材料与方法
1.1 试验动物、饲粮组成与饲养管理
试验选择26周龄健康海兰褐蛋种鸡450只,根据体重和产蛋率相近的原则,随机分为5组,每组6个重复,每个重复15只鸡。对照组饲喂不添加壳聚糖的基础饲粮,4个试验组分别饲喂在基础饲粮中添加250、500、1 000和2 000 mg/kg壳聚糖的试验饲粮。试验所用壳聚糖由山东济南海德
贝海洋生物工程有限公司提供,脱乙酰度84.15%,黏度45 cps。试验期为56 d。基础饲粮参照NRC(1994)蛋种鸡营养需要配制,其组成及营养水平见表1。蛋种鸡采用有窗封闭鸡舍3层立体笼养,试验期间自由采食、自由饮水,每天光照16 h。各组鸡舍环境条件及饲养管理均保持一致,定期消毒,按常规免疫程序进行免疫。
1.2 样品采集与指标测定
1.2.1 样品采集与处理
在试验第28天和第56天,每个重复随机选取1只鸡,翅静脉采血4 mL/只,1 000×g离心10 min,收集上清液,置于-20 ℃冰箱中保存备用。采血后处死,取肝脏并用预冷的生理盐水冲洗表面血渍后,置于-20 ℃冰箱中保存备用。
1.2.2 测定指标与方法
采用单试剂甘油磷酸氧化酶-过氧化物酶(GPO-PAP)法测定血清中TG、TC含量,双试剂直接法测定血清中HDL-C、LDL-C含量,比色法测定血清和肝脏中游离脂肪酸(FFA)含量,酶联免疫法测定血清中瘦素(LEP)、脂联素(ADP)含量,放射免疫法测定血清中极低密度脂蛋白(VLDL)含量。上述指标均用试剂盒测定,试剂盒购于南京建成生物工程研究所,具体测定过程按照试剂盒说明书进行。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:Mn 50 mg,Fe 25 mg,Cu 2.5 mg,Zn 50 mg,I 1.0 mg,Se 0.15 mg,VA 7 715 IU,VD 2 755 IU,VE 8.8 IU,VK 2.2 mg,VB110.55 mg,VB28.0 mg,VB624.41 mg,VB12120.01 mg,烟酸 nicotinic acid 19.8 mg,叶酸 folic acid 0.28 mg,生物素 biotin 2 mg,泛酸钙 calcium pantothenate 50 mg。
2)代谢能为计算值,其余为实测值。ME was a calculated value, while the others were measured values.
1.3 数据统计与分析
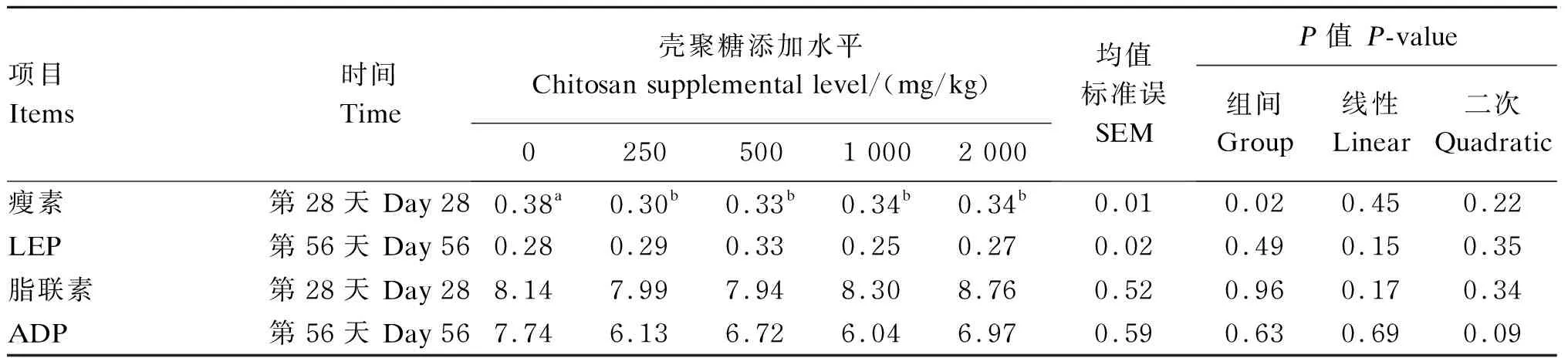
试验数据采用SAS 9.1.3软件进行单因素方差分析(one-way ANOVA)以及一次线性和二次曲线回归分析。P≤0.05表示组间差异或回归关系显著,0.05 由表2可知,试验第28天时,与对照组相比,250、500和1 000 mg/kg壳聚糖组蛋种鸡血清中TG含量显著降低(P≤0.05),其中以500 mg/kg壳聚糖组最低,但2 000 mg/kg壳聚糖组与对照组差异不显著(P>0.05);随着壳聚糖添加水平的升高,血清中TG含量呈现显著的二次曲线变化(R2=0.839 9,P<0.01)。试验第56天时,250 mg/kg壳聚糖组血清中TG含量显著低于对照组(P≤0.05),500 mg/kg壳聚糖组也有降低的趋势,但与对照组差异不显著(P>0.05)。除试验第56天时250 mg/kg壳聚糖组与对照组差异不显著(P>0.05)外,试验第28天和第56天时各壳聚糖组血清中TC含量均显著低于对照组(P≤0.05),且随着壳聚糖添加水平的升高,试验第28天和第56天时蛋种鸡血清中TC含量均呈现显著的线性下降(第28天:R2=0.649 0,P<0.01;第56天:R2=0.568 4,P<0.01)。试验第28天时,250 mg/kg壳聚糖组血清中HDL-C含量显著高于对照组(P≤0.05),而500、1 000和2 000 mg/kg壳聚糖组则与对照组没有显著差异(P>0.05);随着壳聚糖添加水平的升高,血清中HDL-C含量呈现显著的二次曲线变化(R2=0.855 5,P<0.01)。试验第56天时,各壳聚糖组蛋种鸡血清中HDL-C含量与对照组均没有显著差异(P>0.05)。试验第28天时,250 mg/kg壳聚糖组血清中LDL-C含量显著低于对照组和2 000 mg/kg壳聚糖组(P≤0.05);试验第56天时,各壳聚糖组血清中LDL-C含量均显著低于对照组(P≤0.05)。试验第28天时,500 mg/kg壳聚糖组蛋种鸡血清中VLDL含量显著低于其他组(P≤0.05),250 mg/kg壳聚糖组显著低于1 000和2 000 mg/kg壳聚糖组(P≤0.05);随着壳聚糖添加水平的升高,血清中VLDL含量呈现显著的二次曲线变化(R2=0.407 7,P<0.01)。试验第56天时,各壳聚糖组蛋种鸡血清中VLDL含量均低于对照组,但是差异均未达到显著水平(P>0.05)。 试验第28天时,250、500和1 000 mg/kg壳聚糖组蛋种鸡血清中FFA含量显著低于对照组(P≤0.05),且随壳聚糖添加水平的升高,血清中FFA含量呈显著的二次曲线变化(R2=0.359 2,P=0.04);试验第56天时,250和500 mg/kg壳聚糖组蛋种鸡血清中FFA含量显著低于对照组和其他壳聚糖组(P≤0.05)。试验第28天时,250和500 mg/kg壳聚糖组肝脏FFA含量显著低于对照组(P≤0.05),其中以250 mg/kg壳聚糖组最低,1 000、2 000 mg/kg壳聚糖组则与对照组无显著差异(P>0.05);试验第56天时,250 mg/kg壳聚糖组肝脏FFA含量显著低于对照组(P≤0.05),其他壳聚糖组则与对照组无显著差异(P>0.05)。 表2 饲粮添加壳聚糖对蛋种鸡血清脂类物质含量与肝脏FFA含量的影响 续表2项目Items时间Time壳聚糖添加水平 Chitosan supplemental level/(mg/kg)02505001 0002 000均值标准误SEMP值 P-value组间 Group线性Linear二次Quadratic低密度脂蛋白胆固醇LDL-C/(mmol/L)第28天 Day 281.43a1.22b1.26ab1.36ab1.40a0.050.030.240.12第56天 Day 561.45a1.30b1.28b1.30b1.31b0.030.020.250.35极低密度脂蛋白VLDL/(mmol/L)第28天 Day 280.59ab0.45bc0.29c0.63a0.66a0.07<0.01<0.01<0.01第56天 Day 560.630.430.460.560.50a0.040.150.480.34游离脂肪酸FFA/(μmol/L)第28天 Day 28708.74a440.13bc276.70c450.92bc597.63ab65.21<0.010.170.04第56天 Day 56685.01a399.68c450.36bc619.74ab676.38a54.190.010.630.23肝脏脂肪酸 Liver FFA/(μmol/g prot)第28天 Day 2891.02a55.48c67.64bc75.21ab78.56ab5.450.010.940.41第56天 Day 56140.72a92.63b106.63ab135.81a133.78a11.000.030.240.44 同行数据肩标不同小写字母表示差异显著(P≤0.05),相同或无字母表示差异不显著(P>0.05)。下表同。 In the same row, values without the same small letter superscripts mean significant difference (P≤0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below. 由表3可知,试验第28天时,与对照组相比,饲粮添加250、500、1 000和2 000 mg/kg壳聚糖均显著降低了血清中LEP含量(P≤0.05)。试验第56天时,饲粮添加250、500、1 000和2 000 mg/kg壳聚糖对蛋种鸡血清LEP含量无显著影响(P>0.05)。试验第28天和第56天时,饲粮添加250、500、1 000和2 000 mg/kg壳聚糖对蛋种鸡血清中ADP含量均未产生显著影响(P>0.05)。 表3 饲粮添加壳聚糖对蛋种鸡血清中脂肪细胞因子含量的影响 血清中TG、TC、HDL-C、LDL-C等脂类物质的含量是动物机体脂质代谢健康水平的重要指示剂。TG含量过高时凝血发生几率增高,促使动脉粥样硬化的形成和发展,同时导致脂肪肝和肥胖症等相关并发症。TC含量过高,易累积在动脉壁上,从而导致动脉粥样硬化。本研究结果表明,饲粮添加壳聚糖可不同程度降低蛋种鸡血清中TG、TC和LDL-C含量,增加HDL-C含量,提示壳聚糖的添加有利于改善蛋种鸡血清的脂质代谢健康水平。关于壳聚糖调节脂质代谢的机制最早提出的是脂质结合机制,壳聚糖氨基所带正电荷促使其与脂肪酸和胆汁酸等阴离子物质结合,导致肠道脂质吸收中断及胆汁酸的排泄,同时为了弥补粪便损失,肝脏中的TC加速转化为胆汁酸[5],因此,壳聚糖表现出降脂、降胆固醇的作用。HDL-C具有逆向转运胆固醇至肝脏的作用,引起动物血浆中HDL-C含量升高。LDL-C是血液中胆固醇的主要载体,转运胆固醇到外周组织,并调节这些部位的胆固醇从头合成,促进脂肪沉积。此外,壳聚糖被认为是胰脂肪酶的竞争性抑制剂,可降低脂质和胆固醇的吸收[6]。因此,壳聚糖可降低蛋种鸡血清中TG和TC含量,但其确切的机制需要进一步深入研究。本研究结果还表明,壳聚糖对蛋种鸡血清中TG和TC含量的降低效果与剂量相关。饲粮添加壳聚糖(250、500和1 000 mg/kg)对血清TG含量的降低作用较大;试验第28天时,依据回归方程得出壳聚糖添加水平为967.18 mg/kg时,蛋种鸡血清中TG含量最低。而随着壳聚糖添加水平的升高,壳聚糖线性降低蛋种鸡血清中TC含量。此外,250和500 mg/kg壳聚糖调节血清HDL-C和LDL-C含量的能力优于1 000和2 000 mg/kg壳聚糖,提示低剂量壳聚糖对蛋种鸡脂质代谢的调节作用优于高剂量;试验第28天时,依据回归方程得出壳聚糖添加水平为734.61 mg/kg时,蛋种鸡血清中HDL-C含量最高。 肝脏是禽类脂质合成的主要场所。肝脏内TG的合成与分解失去平衡,则会导致TG在肝细胞内的过度沉积,进而诱发脂肪肝,造成产蛋率下降。相对于从头合成以及饲粮来源的脂肪酸,FFA可直接纳入VLDL-TG[7]。Koutsari等[8]证明,FFA是VLDL-TG的主要脂肪酸来源。其他研究也证明,FFA是肝脏TG合成的主要脂肪酸来源[9]。因此,肝脏TG过剩的关键点是肝脏中脂肪酸可利用度增加。在本研究中,饲粮添加壳聚糖降低了蛋种鸡肝脏FFA含量,导致可合成TG总量减少,从而适当限制蛋种鸡肝脏内因产蛋需求所造成的TG过度合成,防止TG在肝细胞内大量沉积。同时,动物肝脏吸收FFA的能力与其在血液中的含量成正比[10]。在本研究中,饲粮添加壳聚糖降低了蛋种鸡血清中FFA含量。血清中FFA含量的下降会影响肝脏对FFA的吸收,这也是造成蛋种鸡肝脏FFA含量下降的原因。此外,FFA酯化形成TG可以防止细胞内脂肪酸沉积所引起的肝损伤或功能障碍。非脂肪细胞和组织慢性暴露于高含量的脂肪酸所引发的不良影响被称为“脂毒性”[11]。脂肪酸不能被酯化是造成“脂毒性”的主要原因。因此,饲粮添加壳聚糖降低蛋种鸡血清和肝脏中FFA的含量,除限制TG在肝脏内的过度沉积外,还可以减轻FFA的细胞毒性,防止肝损伤,提升蛋种鸡的脂质代谢健康水平。此外,本研究结果显示,试验第28天时,饲粮添加250、500和1 000 mg/kg壳聚糖可显著降低血清FFA含量,依据回归方程得出壳聚糖添加水平为856.67 mg/kg时,血清FFA含量最低。此外,250和500 mg/kg壳聚糖对试验第56天时血清和肝脏中FFA含量的降低效果优于2 000 mg/kg壳聚糖。这说明壳聚糖对蛋种鸡血清和肝脏中FFA含量的降低作用与其添加剂量有关,低剂量组的调节作用较好,高剂量组调节作用减弱。 脂类物质在体内的运输主要通过VLDL和乳糜微粒等脂蛋白颗粒来完成,VLDL含量升高能够保证母鸡性成熟后旺盛的产蛋脂质需求,同时高VLDL含量也容易诱发脂肪肝,影响蛋鸡产蛋性能。血液中脂蛋白含量是脂类物质在血液中的“出现率”和“清除率”之间相互平衡的结果。安光全[12]发现,随着血清VLDL含量的增大,蛋鸡的产蛋量呈现先增高后降低的变化趋势;血清VLDL含量小于400 mg/mL时,与产蛋量呈显著的正相关,血清VLDL含量大于400 mg/mL时,与产蛋量呈显著的负相关。陈媛媛[13]也得出了相似的结论。本实验室前期研究结果显示,250和500 mg/kg壳聚糖组产蛋率分别为94.14%和95.19%,对照组、1 000和2 000 mg/kg壳聚糖组产蛋率分别为90.52%、93.06%和93.30%[14],与本研究得出的血清VLDL含量变化规律相反,提示不同剂量壳聚糖可能通过调节蛋种鸡血清VLDL含量影响其产蛋性能;但在试验第56天时,饲粮添加壳聚糖对蛋种鸡血清VLDL含量的影响未产生显著效果,可能是由于蛋种鸡进入产蛋高峰期,血清中VLDL含量需要保持在高水平,进而满足产蛋脂质需求,确切的机理需要进一步研究。此外,壳聚糖对蛋种鸡血清VLDL含量的调节存在剂量效应,试验第28天时,依据回归方程得出,壳聚糖添加水平为652.56 mg/kg时蛋种鸡血清VLDL含量最低。由此可见,壳聚糖对蛋种鸡血清TG、VLDL、HDL-C、FFA含量的调节作用呈剂量效应,同时根据上述指标的回归分析结果获得壳聚糖的适宜添加水平依次为967.18、652.56、734.61和856.67 mg/kg。这些结果说明,壳聚糖添加剂量在652.56~967.18 mg/kg时对蛋种鸡血清TG、HDL-C、VLDL和FFA含量有较好的调节效果,也进一步说明添加高剂量的壳聚糖对蛋种鸡脂质代谢的调节作用减弱,但壳聚糖的添加剂量究竟为多少更有利于调节脂质代谢,今后还需要进一步在500~1 000 mg/kg剂量之间增加剂量组以更深入地探讨。 LEP是一种由白色脂肪细胞合成和分泌的肥胖基因编码的多肽类激素,其最主要、最基本的作用是调节脂肪代谢、降低机体内脂肪沉积。LEP抵抗小鼠表现出高胆固醇血症、高TC血症、肝脏脂肪变性和脂肪耐受受损等症状[15]。肥胖老鼠和肥胖人类的血清LEP含量与体脂量成正比,同时血清LEP含量与TC、TG、VLDL、LDL-C含量呈正相关,而与HDL-C含量呈负相关[15-16]。发生LEP抵抗的小鼠肝脏LEP信号缺乏,血浆脂蛋白异常重塑,VLDL-TG含量升高[15]。鉴于肝脏在脂质代谢中的关键作用,因此研究者认为血脂异常风险的增加是由肝脏LEP抵抗造成的。在本研究中,饲粮添加不同水平的壳聚糖均可显著降低蛋种鸡血清中LEP含量,说明壳聚糖对蛋种鸡血清TC、TG、VLDL、LDL-C和HDL-C含量的调节作用与LEP有关。此外,高含量的LEP刺激TG水解及脂肪酸的释放和氧化,并降低总脂肪酸的摄取。LEP通过提高甘油三酯脂肪酶和激素敏感酯酶活性刺激脂解作用的增加,释放FFA[17]。Jaubert等[18]研究发现,LEP刺激一氧化氮的生成,进而抑制甘油的合成,减少脂肪酸再酯化的机会。William等[19]在LEP条件下孵育脂肪细胞,采用放射性标记技术测定培养细胞中的脂肪酸流入(脂肪酸合成TG)和脂肪酸流出(细胞内脂肪酸氧化和FFA释放),结果显示TG水解率增加了123%(以FFA释放量来衡量),脂肪酸净流出增加了30%。在本研究中,各壳聚糖组蛋种鸡血清和肝脏FFA含量不同程度地低于对照组,这可能与LEP有一定关系。现有研究结果显示,LEP通过抑制固醇调节元件结合蛋白1和过氧化物酶体增殖剂激活受体γ及其调控的脂肪生成酶类的活性及mRNA表达来降低脂质生成,通过上调脂肪分解酶类和脂肪酸氧化酶类的活性来促进脂解作用及脂肪酸氧化[15,17-19]。因此,LEP在壳聚糖调控蛋种鸡脂质代谢过程中的重要作用及其机理的研究需要进一步深入探讨。 ① 饲粮添加壳聚糖可降低蛋种鸡血清中TG、TC、LDL-C、FFA含量和肝脏FFA含量,增加血清HDL-C含量,改善蛋种鸡体内脂质代谢的健康水平。 ② 饲粮添加壳聚糖对蛋种鸡血清LEP含量也有一定的降低效果。 ③ 饲粮壳聚糖添加水平在652.56~967.18 mg/kg时对蛋种鸡血清TG、LDL-C、VLDL和FFA含量有较好的调节效果。 [1] LIU J N,ZHANG J L,XIA W S.Hypocholesterolaemic effects of different chitosan samplesinvitroandinvivo[J].Food Chemistry,2008,107(1):419-425. [2] ZHOU T X,CHEN Y J,YOO J S,et al.Effects of chitooligosaccharide supplementation on performance,blood characteristics,relative organ weight,and meat quality in broiler chickens[J].Poultry Science,2009,88(3):593-600. [3] KOBAYASHI S,TERASHIMA Y,ITOH H.Effects of dietary chitosan on fat deposition and lipase activity in digesta in broiler chickens[J].British Poultry Science,2002,43(2):270-273. [4] KESER O,BILAL T,KUTAY H C,et al.Effects of chitosan oligosaccharide and/or beta-glucan supplementation to diets containing organic zinc on performance and some blood indices in broilers[J].Pakistan Veterinary Journal,2012,32(1):15-19. [5] TRIVEDI V R,SATIA M C,DESCHAMPS A,et al.Single-blind,placebo controlled randomised clinical study of chitosan for body weight reduction[J].Nutrition Journal,2015,15:3. [6] CHOI C R,KIM E K,KIM Y S,et al.Chitooligosaccharides decreases plasma lipid levels in healthy men[J].International Journal of Food Sciences and Nutrition,2012,63(1):103-106. [7] LAMBERT J E,RAMOS-ROMAN M A,BROWNING J D,et al.Increaseddenovolipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease[J].Gastroenterology,2014,146(3):726-735. [8] KOUTSARI C,MUNDI M S,ALI A H,et al.Systemic free fatty acid disposal into very low-density lipoprotein triglycerides[J].Diabetes,2013,62(7):2386-2395. [9] BARROWS B R,TIMLIN M T,PARKS E J.Spillover of dietary fatty acids and use of serum nonesterified fatty acids for the synthesis of VLDL-triacylglycerol under two different feeding regimens[J].Diabetes,2006,54(9):2668-2673. [10] JACOME-SOSA M M,PARKS E J.Fatty acid sources and their fluxes as they contribute to plasma triglyceride concentrations and fatty liver in humans[J].Current Opinion in Lipidology,2014,25(3):213-220. [11] SCHAFFER J E.Lipotoxicity:when tissues overeat[J].Current Opinion in Lipidology,2003,14(3):281-287. [12] 安光全.鸡HMGCR基因多态性与血清VLDL浓度和繁殖性状的关联研究[D].硕士学位论文.雅安:四川农业大学,2010:66-70. [13] 陈媛媛.VLDL相关基因的多态性及血清VLDL浓度对肉种母鸡繁殖性能的影响[D].硕士学位论文.雅安:四川农业大学,2011:55-60. [14] 赵启龙.壳聚糖对蛋种鸡产蛋性能、免疫和抗氧化功能及相关血清生化指标的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2015:10-12. [15] HUYNH F K,NEUMANN U H,WANG Y,et al.A role for hepatic leptin signaling in lipid metabolism via altered very low density lipoprotein composition and liver lipase activity in mice[J].Hepatology,2013,57(2):543-554. [16] MURTADHA N A,SARHAT E R.Relationship between leptin and lipid profile in obese females in tikrit province[J].International Journal of Current Microbiology and Applied Sciences,2016,5(5):493-501. [17] HARRIS B S.Direct and indirect effects of leptin on adipocyte metabolism[J].Biochimica et Biophysica Acta,2014,1842(3):414-423. [18] JAUBERT A M,PENOT G,NIANG F,et al.Rapid nitration of adipocyte phosphoenolpyruvate carboxykinase by leptin reduces glyceroneogenesis and induces fatty acid release[J].PLoS One,2012,7(7):e40650. [19] WILLIAM W N,Jr,CEDDIA R B,CURI R.Leptin controls the fate of fatty acids in isolated rat white adipocytes[J].Journal of Endocrinology,2002,175(3):735-744.2 结 果
2.1 壳聚糖对蛋种鸡血清中脂类物质含量及肝脏FFA含量的影响


2.2 饲粮添加壳聚糖对蛋种鸡血清中脂肪细胞因子含量的影响
3 讨 论
4 结 论

