犬高温环境代谢特征下血常规、血液流变学和血清生化指标的变化
贺绍君 丁金雪 李 静 刘德义
(安徽科技学院动物科学学院,滁州 233100)
近年来,我国夏季“热波”天气频现,平均气温屡创新高,严重危害人类和动物的健康。犬在多方面与人类生活密切相关,其健康科学饲养日益受到重视。从生理特点上讲,犬全身几乎无汗腺、散热能力较差,对高温的抵抗能力低于其他动物[1]。为适应高温环境,犬通常通过改变自身营养物质代谢来更好地适应外部环境。然而,当超过机体抵抗热环境的能力之后,犬只表现为生活质量、免疫力下降,甚至发生日射病或热射病[2]。此外,工作犬在炎热的野外或狭窄的空间执行任务时也极易遭遇高温的影响,降低工作能力。应激对机体产生的影响与应激时间、应激源类别和强度、机体敏感性等因素密切相关。其中,超短期应激时机体表现以一过性剧烈反应后迅速缓解为特征,而长期应激则以持续性机体全身适应性变化为特征。目前关于犬在高温环境下体内多种物质代谢变化的研究已有相关报道,其相关研究主要集中于夏季长期慢性应激下或者急性超短期(<2 h)高温环境下机体的相关变化,对于急性短期(>2 h)高温环境下机体营养物质代谢发生适应性变化后,犬血常规、血液流变学及血清生化指标的变化规律仍不清楚[3-4]。血液是机体运输生命营养物质、气体和体液调节物质的承担者,血常规、血液流变学及血清生化指标是综合反映机体组织和器官代谢变化和生理功能的重要指标[5]。因此,本试验通过系统研究急性短期高温环境下机体营养物质适应性代谢改变后,犬血液学相关指标的变化,揭示急性短期高温的具体影响,为临床上采取针对性血液学营养改进措施防控高温环境对犬的危害提供思路。
1 材料与方法
1.1 试验动物及处理
选择蚌埠地区健康[体温=(39.26±0.10) ℃,脉搏=(105.17±8.40)次/min,呼吸数=(38.0±8.49)次/min]以及年龄、体重相近的中华田园犬6条,平均体重4.5 kg,年龄1.5~2.5岁,饲喂通用型犬粮(粗蛋白质≥26%;粗脂肪≥14%;粗纤维≤5.0%;粗灰分≤10%;赖氨酸≥1.0%;钙≥1.3%;总磷≥1.0%;食盐≤1.2%;水分≤10%)。
正式试验前1周将试验犬转入犬舍,(28±1) ℃适应性饲养。整个试验过程中试验犬均饲喂通用型犬粮,单笼饲养,自由采食和饮水。采用工业暖风机(吉毅IFH04-30A)加热犬舍。试验在07:00开始,经15 min犬舍内温度升至(35±1) ℃,持续16 h时,关闭暖风机,自然降温16 h。整个试验期间犬舍维持相对湿度60%~70%。
1.2 样本采集及指标测定
分别在急性短期高温环境暴露0(开始时)、3(早期)、8(中期)、16(晚期)、降温16 h(恢复期)颈静脉采乙二胺四乙酸二钠(EDTA-Na2)抗凝血0.5 mL用迈瑞BC-2800Vet血常规分析仪测定红细胞、白细胞、血小板等血常规相关指标,采肝素钠抗凝血4 mL用美医林MEN-C90血流变分析仪测定血液黏度、红细胞特性,另采2 mL非抗凝血于4 ℃冰箱放置12 h后3 000 r/min离心10 min,收集血清,用迈瑞BS-200生化分析仪测定血清中肌酸激酶(creatine kinase,CK)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine transaminase,ALT)、γ-谷氨酰转移酶(γ-glutamyl-transferase,γ-GT)、碱性磷酸酶(alkaline phosphatase,ALP)、乳酸脱氢酶(lactic dehydrogenase,LDH)的活性以及直接胆红素、间接胆红素、尿素、肌酐、尿酸的含量。
1.3 数据处理
试验结果采用PASW statistics 18.0软件进行平均值、标准差以及单因素方差分析,以平均值±标准差表示试验结果。各时间点试验数据采用单因素重复测量方差分析方法进行多重比较。P<0.05表示差异显著。
2 结果与分析
2.1 急性短期高温环境对犬血常规指标的影响
2.1.1 急性短期高温环境对犬红细胞相关指标的影响
从表1可以看出,整个试验过程中红细胞计数、红细胞压积、红细胞分布宽度均未发生显著变化(P>0.05)。与试验开始(0 h)时相比,各试验时间点犬血红蛋白浓度显著降低(P<0.05),而各试验时间点之间无显著变化(P>0.05)。与试验开始时相比,各试验时间点平均红细胞体积无显著变化(P>0.05),但暴露16 h、降温16 h时比暴露3、8 h时显著增加(P<0.05)。与试验开始时相比,暴露16 h时平均红细胞血红蛋白量、平均红细胞血红蛋白浓度显著降低(P<0.05)。

表1 急性短期高温环境对犬红细胞相关指标的影响

续表1项目 Items高温环境暴露时间 Exposure time in high-temperature environment/h03 8 16 降温16 h时Temperature reduction for 16 h参考区间 Reference intervals平均红细胞血红蛋白浓度MCHC/(g/L)330.17±3.07a328.50±5.14ab328.17±2.74ab325.67±2.57b 328.33±1.87ab310~340红细胞分布宽度 RDW/%13.40±0.7314.58±0.6414.55±0.6913.50±0.5014.27±0.6512~21
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same small letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.1.2 急性短期高温环境对犬白细胞相关指标的影响
从表2可以看出,与试验开始时相比,暴露8、16 h时白细胞计数显著增加(P<0.05),暴露3、8 h以及降温16 h时淋巴细胞计数、单核细胞计数显著降低(P<0.05),各试验时间点粒细胞计数均显著升高(P<0.05)。各试验时间点间比较发现,暴露3、8 h以及降温16 h时白细胞计数、淋巴细胞计数、单核细胞计数、粒细胞计数均无显著差异(P>0.05)。与试验开始时相比,各试验时间点淋巴细胞百分比及单核细胞百分比显著降低(P<0.05),粒细胞百分比显著升高(P<0.05)。
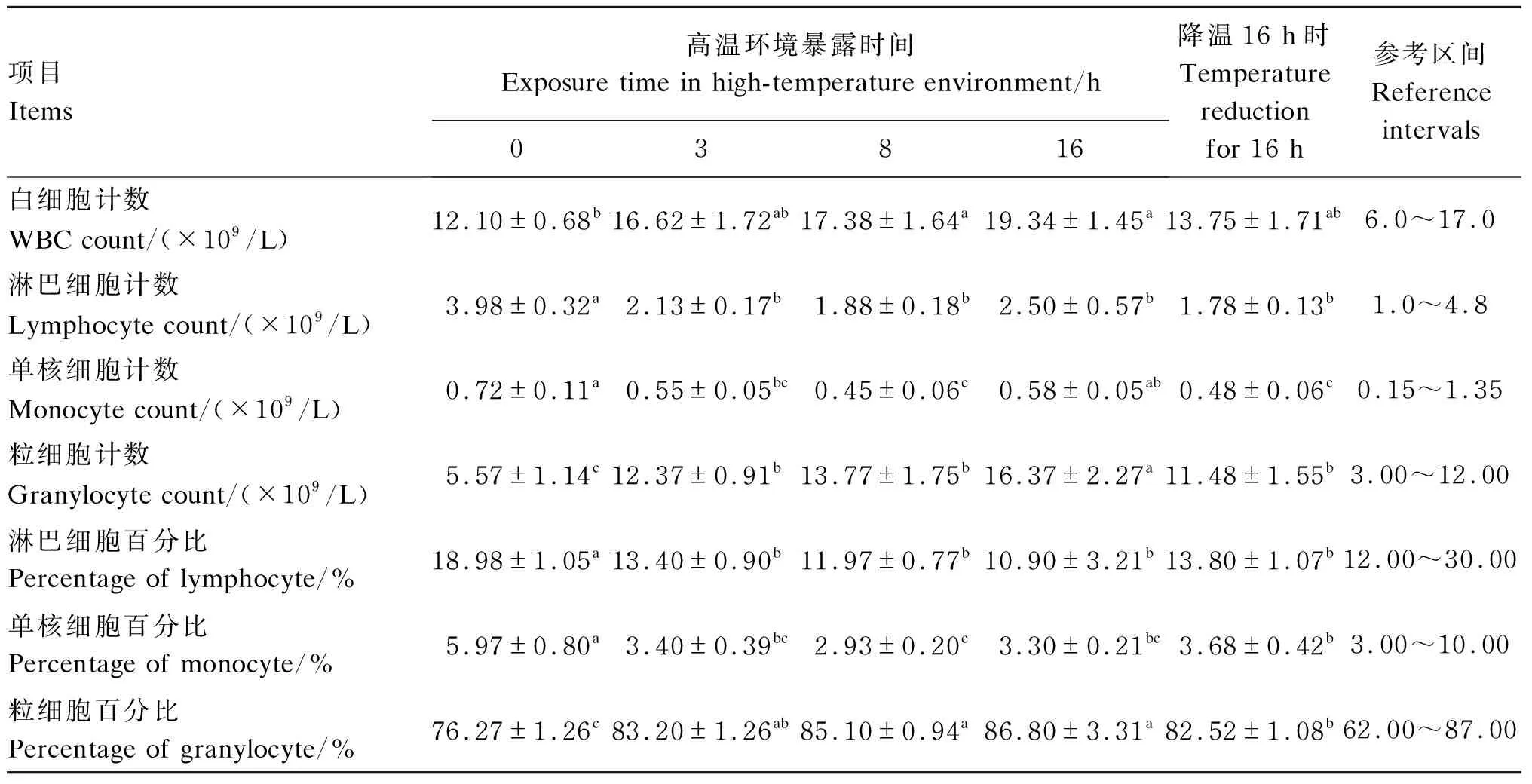
表2 急性短期高温环境对犬白细胞相关指标的影响
2.1.3 急性短期高温环境对犬血小板相关指标的影响
从表3可以看出,与试验开始时相比,暴露16 h时血小板计数显著降低(P<0.05),而平均血小板体积、血小板分布宽度以及血小板压积3个指标未发生显著变化(P>0.05)。各试验时间点间比较发现,暴露3、8 h时血小板计数及血小板压积显著高于暴露16 h时(P<0.05)。
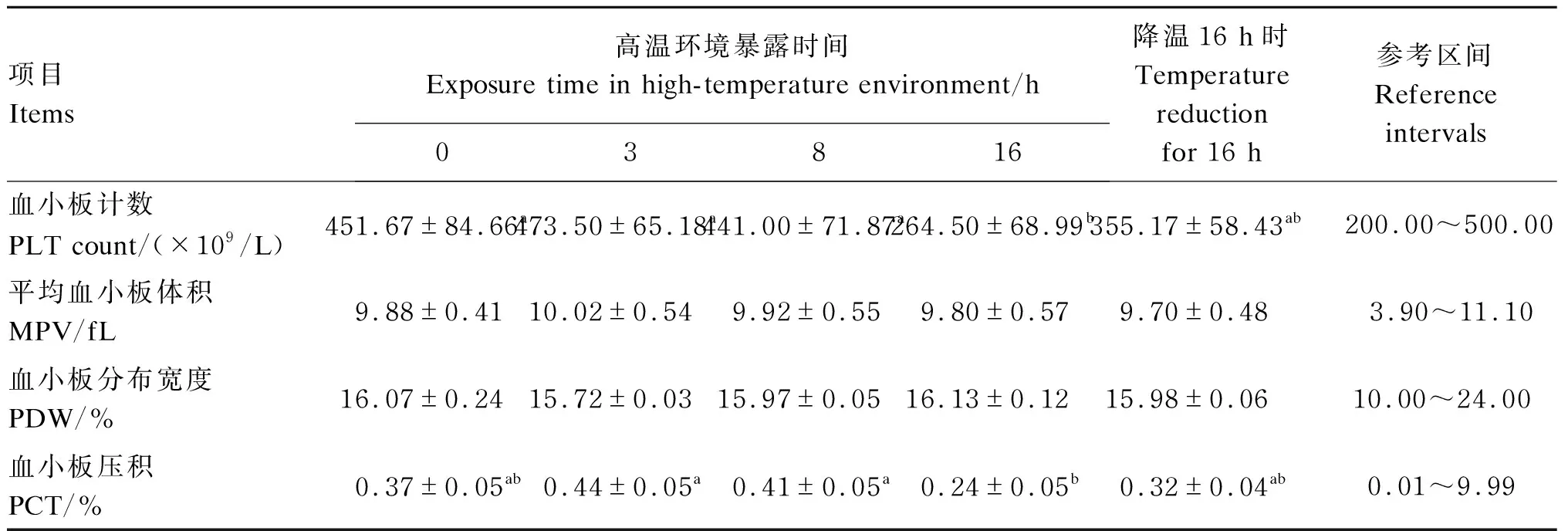
表3 急性短期高温环境对犬血小板相关指标的影响
2.2 急性短期高温环境对犬血液流变学指标的影响
2.2.1 急性短期高温环境对犬全血黏度相关指标的影响
从表4可以看出,与试验开始时相比,暴露8 h时低切、中切全血黏度显著升高(P<0.05),暴露16 h以及降温16 h时低切、中切、高切全血黏度显著降低(P<0.05)。各试验时间点间比较发现,暴露16h以及降温16h时低切、中切、高切全血黏度显著低于暴露3、8 h时(P<0.05)。与试验开始时相比,低切、中切、高切全血还原黏度在暴露3、8 h时均显著升高(P<0.05)。各试验时间点间比较发现,暴露3、8 h时低切、中切、高切全血还原黏度显著高于暴露16 h和降温16 h时(P<0.05)。从低切、中切、高切全血相对黏度结果来看,其变化规律与低切、中切、高切全血还原黏度变化规律相同。
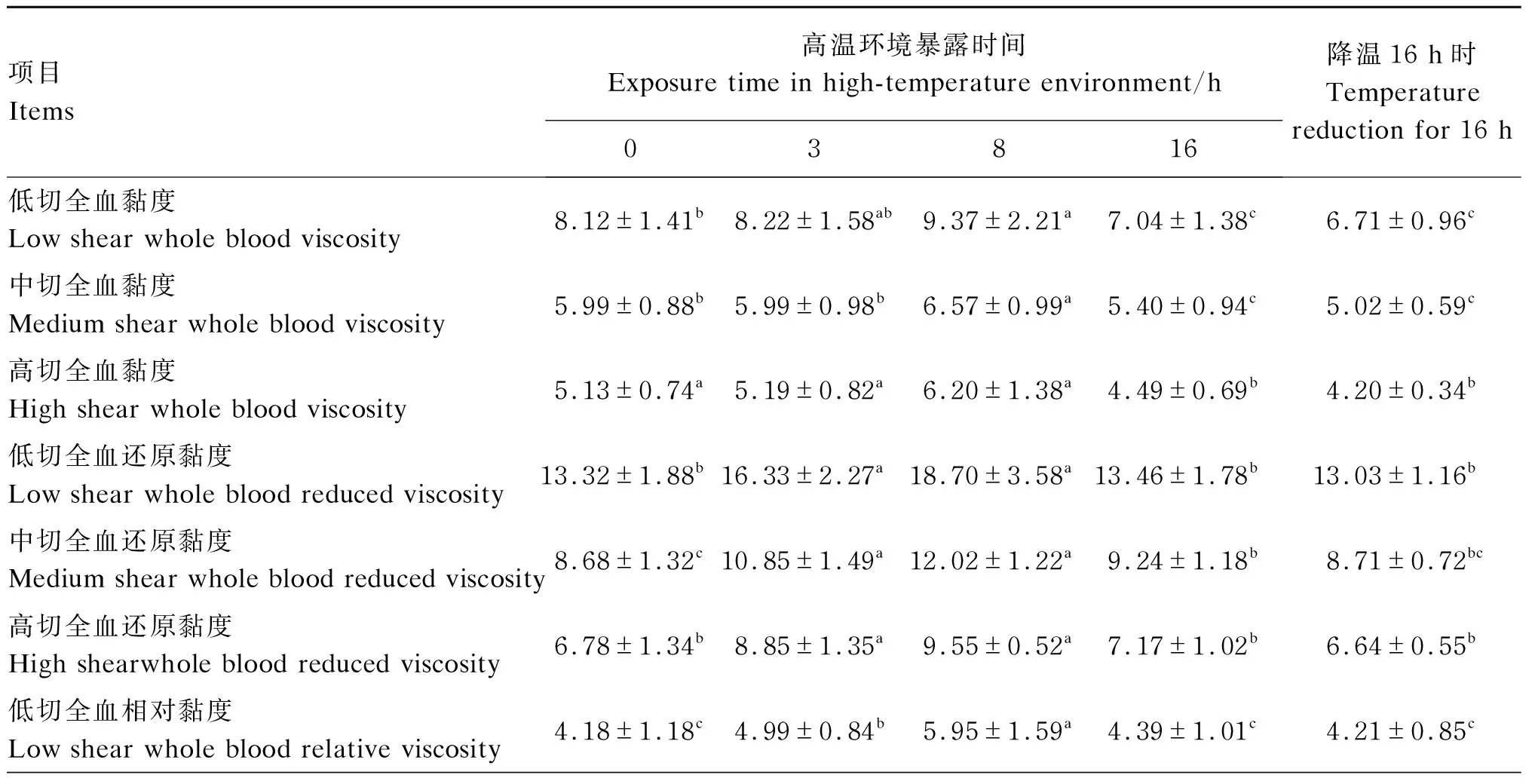
表4 急性短期高温环境对犬全血黏度相关指标的影响

续表4项目 Items高温环境暴露时间 Exposure time in high-temperature environment/h03816降温16 h时Temperature reduction for 16 h中切全血相对黏度 Medium shear whole blood relative viscosity3.07±0.79c3.64±0.51b4.16±0.76a3.34±0.70bc3.15±0.58c高切全血相对黏度 High shear whole blood relative viscosity2.63±0.68c3.15±0.40b3.50±0.51a2.80±0.51c2.63±0.40c
2.2.2 急性短期高温环境对犬红细胞物理特性的影响
从表5可以看出,与试验开始时相比,暴露3、8、16 h时红细胞刚性指数显著增加(P<0.05)。暴露16 h和降温16 h时红细胞刚性指数显著低于暴露3、8h时(P<0.05)。与试验开始时相比,各试验时间点红细胞变形指数显著增加(P<0.05),同时暴露3、8 h时显著高于暴露16 h和降温16 h时(P<0.05)。与试验开始时相比,各试验时间点红细胞电泳指数显著增加(P<0.05)。整个试验过程红细胞聚集指数未发生显著变化(P>0.05)。

表5 急性短期高温环境对犬红细胞物理特性的影响
2.3 急性短期高温环境对犬血清生化指标的影响
从表6可以看以出,与试验开始时相比,血清AST活性在暴露3、8 h时略有上升,但差异不显著(P>0.05)。与暴露3、8 h时相比,暴露16 h和降温16 h时血清AST活性显著降低(P<0.05)。与试验开始时相比,暴露16 h时血清γ-GT活性显著降低(P<0.05),暴露8、16 h时血清总胆红素和直接胆红素含量均显著升高(P<0.05),暴露8、16 h以及降温16 h时血清ALP、CK活性显著降低(P<0.05),且暴露16 h和降温16 h时血清CK活性还显著低于暴露3、8 h时(P<0.05)。与试验开始时相比,暴露16 h血清尿素含量显著增加(P<0.05),暴露16 h和降温16 h时血清肌酐含量显著降低(P<0.05),暴露8、16 h以及降温16 h时血清尿酸含量显著降低(P<0.05),暴露16 h和降温16 h时血清LDH活性显著降低(P<0.05)。此外,降温16 h时血清尿素、尿酸含量以及LDH活性较暴露3、8 h时显著降低(P<0.05)。
3 讨 论
3.1 急性短期高温环境对犬血常规指标的影响
红细胞是动物体内氧气输入和二氧化碳输出的主要载体,红细胞内的血红蛋白在这一过程中发挥了重要作用。高温环境下,犬体内营养物质代谢会发生显著改变,进而影响到机体内环境。本试验结果表明,急性短期高温环境对犬血液中红细胞计数与红细胞压积无显著影响,但显著降低了犬血液中血红蛋白浓度,在高温暴露3 h时血红蛋白浓度下降至最低值。急性短期高温环境对犬单位体积内红细胞数量(即红细胞计数)无显著影响主要是由于机体在短时间内通过动员代偿能力维持了红细胞生成、释放、存贮与消亡的动态平衡[6]。本试验中,犬血液中血红蛋白浓度降低说明了急性短期高温环境虽然对红细胞计数和红细胞压积无显著影响,但降低了红细胞的质量,影响红细胞正常携氧能力的发挥。平均红细胞体积在暴露3、8 h时显著低于暴露16 h和降温16 h时,说明急性短期高温环境加剧了水分从口腔的蒸发,引起体内缺水,导致红细胞有失水趋势,引进平均红细胞体积在暴露3 h时达到最小值;但在暴露16 h时,在渴欲中枢调节下,犬大量饮水,导致红细胞吸水体积显著增加[7],表现为平均红细胞体积在暴露16 h时达到最大值。整个试验过程中红细胞分布宽度未发生显著变化,说明急性短期高温环境对红细胞大小的均匀度无显著影响,非同质性红细胞无显著增加。本试验还研究了自然降温16 h后各红细胞相关指标的变化,发现自然降温对各红细胞相关指标无显著恢复作用。
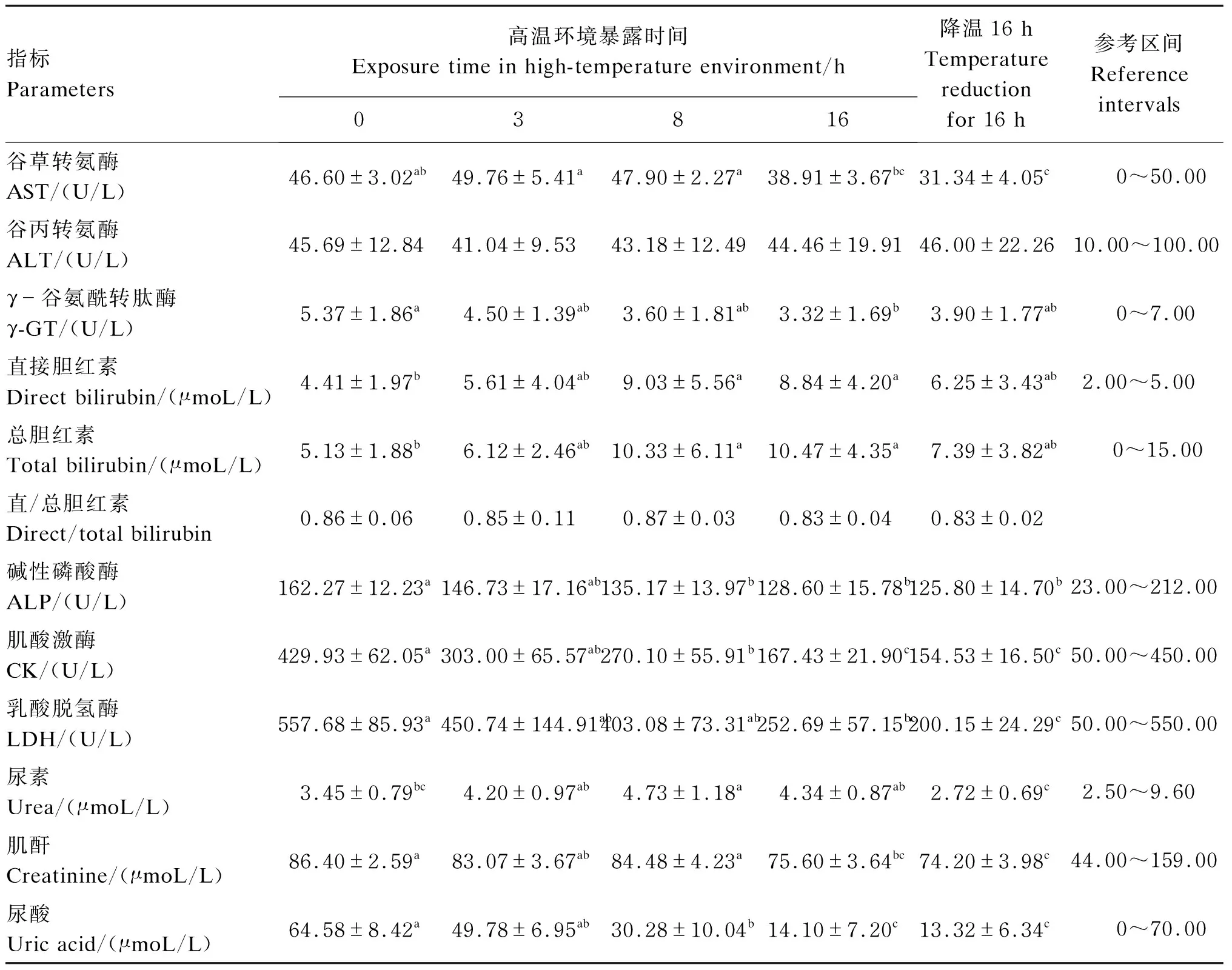
表6 急性短期高温环境对犬血清生化指标的影响
白细胞是体内主要起非特异防御保护作用的具有免疫功能的细胞。本试验结果表明急性短期高温环境显著增加了犬血液中单位体积内白细胞和粒细胞的数量(即白细胞计数和粒细胞计数),在暴露16 h时达到最大值,此与犬抵御外界高温环境刺激,启动机体积极的非特异性防御反应有关[8]。本试验结果还显示急性短期高温环境显著降低了犬血液中单位体积内淋巴细胞和单核细胞的数量(即淋巴细胞计数和单核细胞计数),在暴露8 h时达到最小值,这些白细胞变化规律与机体在应激状态下分泌大量的皮质激素密切相关[4,9],但具体的作用机制需要进一步研究。自然降温16 h时,粒细胞、淋巴细胞、单核细胞这3种细胞的百分比均有一定程度的恢复,说明发生急性短期高温环境危害时,及时远离或去除高温应激原对恢复非特异性免疫功能有一定的作用。
血小板在体内主要发挥凝血功能。本试验结果显示急性短期高温环境16 h时显著降低了血液血小板含量和压积,而血小板体积和分布宽度在这一急性高温环境中未发生显著变化。其降低的血小板数量和压积与急性高温环境下导致机体特别肠道表现出血性炎症,而血小板通过聚集发挥凝血作用消耗,而此时对血小板本身的大小和均匀度无显著影响。试验结果还显示,血小板含量和压积在试验开始第16 h时达到最低值,自然降温16 h后这2个指标均有明显的恢复,进一步提示及时去除高温环境应激原对血液指标恢复有显著的作用。
3.2 急性短期高温环境对犬血液流变学指标的影响
血液流变学是通过血液流动性、凝滞性和黏度的变化,推测机体血液循环状态及可能引起这一变化的血液成分。本试验中,急性短期高温环境下暴露8 h时全血黏度、还原黏度及相对黏度的高切、中切、低切值均比试验开始时显著增加,而暴露16 h时比暴露8 h时显著降低。试验早期(暴露3 h时)全血黏度增加主要是因为机体早期以积极适应性为主,以改变机体的代谢为主,同时机体存在失水,表现为全血黏度增加。试验后期(暴露16 h时)由于高温环境刺激动物饮水增加,摄入的水分进入血液循环后稀释血液,表现为全血黏度下降。全血黏度降低有利于更好地满足组织灌注量,增加血液循环的有效性,充盈体表微循环,提高暴露在急性短期高温环境下机体的散热能力[10-11]。此外,与试验开始时相比,全血黏度、还原黏度、相对黏度分别在暴露8、3 h时显著升高,推测急性短期高温环境可能通过影响红细胞的特性和血浆成分影响全血黏度。
衡量红细胞膜柔韧度的指标之一是红细胞刚性指数,其值越大,红细胞变性能力越小,在血液高切变率下全血黏度升高越显著。红细胞在外界作用下自身形态改变称为红细胞变形性。本试验结果表明,急性短期高温环境显著增加了红细胞刚性指数,尽管红细胞变形指数显著增加在一定程度上缓解了由于红细胞刚性指数增加引起的全血黏度增加,但两者的净效应表明急性短期高温环境可以通过增加红细胞的刚性来升高全血黏度[12]。急性短期高温环境下,犬红细胞电泳指数、红细胞聚集指数在试验持续8 h以后无显著变化,说明急性短期高温环境导致全血黏度增加并不单纯由红细胞表面所带负电荷多少决定[13]。值得提出的是,上述各指标在暴露8 h时达到最大值,但自然降温16 h后,各指标并未发生明显的恢复,说明急性短期高温环境对犬血液流变学指标的影响相对比较持久。
3.3 急性短期高温环境对犬血清生化指标的影响
急性短期高温环境使动物机体进入应激状态,造成机体组织器官细胞的功能发生改变[14]。血清生化指标可以反映机体相应组织器官营养代谢功能情况。正常情况下,细胞内酶受细胞膜屏障的保护作用存于细胞内部,血清中仅含有因细胞衰老裂解后释放进入血液的少量的酶。损伤的机体细胞膜通透性增大,其细胞内含有的包括酶类的物质释放入血液,引起血清酶活性上升。本试验结果表明,急性短期高温环境暴露3、8 h对血清AST、ALT、γ-GT活性均未产生显著影响,说明急性短期高温环境对动物肝脏功能无显著影响;血清中总胆红素和直接胆红素含量均显著升高,且整个试验过程中直/总胆红素的值无显著变化,表明本试验条件下急性短期高温环境对肝实质细胞的功能有显著影响,但对肝脏细胞的破坏仍然处于一个较低的水平,此结果与秦海斌等[3]的报道不同,其原因可能与热暴露的时间和程度相关。与试验开始时相比,暴露16 h时血清AST和γ-GT活性显著降低,其原因主要是由于急性短期高温环境下犬血清中乳酸含量升高,大量消耗烟酰胺腺嘌呤二核苷酸(NADH),影响AST、γ-GT的活性[15]。此外,暴露16 h时,在急性短期高温环境下犬已经由积极应对期进入了疲劳应对期,结合血清ALP、LDH活性变化规律说明此时机体的全身活动包括肝脏细胞的活动都处在低水平,犬通过降低活动适应外界环境。通过自然降温16 h后,这些指标虽有一定的恢复,但变化均不显著,提示这些指标的恢复需要更多的时间才能完成。
血清中ALP主要存在于机体骨骼、肠道、肝脏等组织中。本试验结果表明,35 ℃高温环境能引起血清ALP活性显著降低。血清ALP活性降低会导致机体钙吸收障碍,骨组织钙化不全,引起动物骨骼发育异常,易发生骨折。CK是动物心脏、肌肉及脑等组织的细胞浆和线粒体中的酶,是负责细胞内能量运转、肌肉收缩、ATP再生的重要激酶。本试验结果表明,急性短期高温环境下,犬血清CK活性在暴露8 h后显著下降,结合血清AST、LDH活性以及肌酐含量变化情况,这一方面说明急性短期高温环境并未严重破坏心肌、肌肉细胞的完整性,另一方面表明急性短期高温环境使疲劳应对期细胞的代谢活性降低,这与肝脏功能状态的变化一致。
蛋白质在机体内代谢后在肝脏通过鸟氨酸循环合成尿素的形式排出体外,排泄路径以肾脏为主。本试验结果表明,急性短期高温环境下暴露8 h时血清尿素含量显著升高,其主要原因是急性高温环境下机体加强了蛋白质的分解代谢,此时虽然肝脏鸟氨酸循环合成能力较低,但此时肾脏的排泄功能降低,最终导致血清中尿素含量升高[3]。通过自然降温16 h后,血清尿素含量即发生显著改善,说明急性短期高温环境对蛋白质代谢的影响恢复相对较快。急性短期高温环境下犬血清尿酸含量逐渐降低,其原因:一方面,热应激环境下犬肝脏功能发生改变,导致机体内嘌呤氧化酶的活性降低,嘌呤氧化成尿酸数量降低,进而引起血液中尿酸含量降低;另一方面,肾脏功能损伤导致尿酸排泄异常也可引起血清尿酸含量的变化[16-17]。
上述各指标中,血清直接胆红素和尿素含量在暴露8 h时达到最大值,而血清ALP、CK、LDH活性和尿酸含量等指标在暴露16 h时达到最小值,且自然降温16 h仅对血清γ-GT活性及胆红素、尿素含量等少数指标有显著的恢复作用,这反映了急性短期高温环境对犬机体各器官或组织的影响程度并不一致,且各器官组织在热应激后的恢复能力也不尽相同。
4 结 论
① 急性短期高温环境下犬血液中红细胞、白细胞及血小板部分相关指标发生了显著变化,其中包括血红蛋白浓度、淋巴细胞计数及血小板计数,上述3个指标分别在暴露3、8、16 h时下降至最低值,表明急性短期高温环境降低了犬红细胞运输氧气、白细胞非特异性免疫及血小板凝血等方面的功能。
② 急性短期高温环境增加了犬全血黏度,改变了红细胞的物理特性,各血液流变学指标均在暴露8 h时达到最大值,自然恢复16 h后各指标均未完全恢复至正常水平,影响了血液在体内的循环流动性。
③ 急性短期高温环境改变了犬血清中部分酶的活性及血清尿酸、尿素、肌酐等物质的含量,其中血清ALP、CK、LDH活性在暴露16 h时达到最低值,且自然恢复16 h后部分指标并未完全恢复至正常水平,表明急性短期高温环境影响了犬肝脏、肾脏、心脏等重要器官的功能。
④ 整个试验过程中除白细胞计数、粒细胞计数、血清直接胆红素含量变化超过了正常生理指标范围外,其余指标均在生理值区间内波动,说明机体对急性短期高温环境有一定的适应和抵抗能力。
[1] GAO J H,SUN Y Z,LIU Q Y,et al.Impact of extreme high temperature on mortality and regional level definition of heat wave:a multi-city study in China[J].Science of the Total Environment,2015,505:535-544.
[2] 朱骞,秦海斌,孙钦伟,等.犬热应激过程中hsp70和免疫相关细胞因子的变化[J].动物医学进展,2016,37(1):29-33.
[3] 秦海斌,朱骞,张汇东,等.热应激对拉布拉多犬生理、激素、血液生化指标的影响[J].动物医学进展,2015,36(4):41-45.
[4] 赵恩军,华修国,张斌,等.冷热刺激对犬血清皮质醇、促肾上腺皮质激素及血液生理指标的影响[J].畜牧兽医学报,2003,34(5):457-460.
[5] LOMBARDI G,LANTERI P,COLOMBINI A,et al.Stability of haematological parameters and its relevance on the athlete’s biological passport model[J].Sports Medicine,2011,41(12):1033-1042.
[6] MAZZULLO G,RIFICI C,CACCAMO G,et al.Effect of different environmental conditions on some haematological parameters in cow[J].Annals of Animal Science,2014,14(4):947-954.
[7] JOHNSON R J,STENVINKEL P,JENSEN T,et al.Metabolic and kidney diseases in the setting of climate change,water shortage,and survival factors[J].Journal of the American Society of Nephrology,2016,27(8):2247-2256.
[8] QUINTEIRO-FILHO W M,RIBEIRO A,FERRAZ-DE-PAULA V,et al.Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J].Poultry Science,2010,89(9):1905-1914.
[9] 伍勇,焦云根,张昕,等.紫外线联合臭氧及高温诱导人外周血淋巴细胞凋亡作用的研究[J].心脏杂志,2012,24(6):743-745,752.
[10] GAGNON D,ROMERO S A,NGO H,et al.Plasma hyperosmolality improves tolerance to combined heat stress and central hypovolemia in humans[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2017,312(3):R273-R280.
[11] GANIO M S,BROTHERS R M,SHIBATA S,et al.Effect of passive heat stress on arterial stiffness[J].Experimental Physiology,2011,96(9):919-926.
[12] WALTZ X, BAILLOT M, CONNES P,et al.Effects of hydration level and heat stress on thermoregulatory responses, hematological and blood rheological properties in growing pigs[J].PLoS One,2014,9(7):e102537.
[13] JUNG J M,YANG Y,LEE D H,et al.Effect of dielectric barrier discharge treatment of blood plasma to improve rheological properties of blood[J].Plasma Chemistry and Plasma Processing,2012,32(1):165-176.
[14] CRAMER M N,JAY O.Biophysical aspects of human thermoregulation during heat stress[J].Autonomic Neuroscience,2016,196:3-13.
[15] WHEELOCK J B,RHOADS R P,VANBAALE M J,et al.Effects of heat stress on energetic metabolism in lactating Holstein cows[J].Journal of Dairy Science,2010,93(2):644-655..
[16] 李桦,杨梅梅,屈倩,等.绿茶多酚对热应激肉鸡血生化指标和抗氧化能力的影响[J].中国兽医学报,2016,36(5):801-803,813.
[17] BAUMGARD H L,RHOADS R P,Jr.Effects of heat stress on postabsorptive metabolism and energetics[J].Annual Review of Animal Biosciences,2013,1(1):311-337.

