早期断奶羔羊饲喂不同中性洗涤纤维水平饲粮对羔羊育肥期生长性能、血清学指标和屠宰性能的影响
解 彪 张乃锋 崔 凯 王世琴 吕小康 张春香 刁其玉*
(1.山西农业大学动物科技学院,太谷 030801;2.中国农业科学院饲料研究所,农业部 饲料生物技术重点开放实验室,北京 100081)
代谢印记是指早期营养调控能够改变后期的生理表现的一种表观遗传学反应[1]。当前,对婴儿新生阶段的营养干预能通过程序化改变敏感组织和细胞的表观性状并影响到长期的产出已经得到共识[2-3]。有关研究表明,早期婴儿肠道内定植的微生物能够对后期生理、代谢及免疫产生影响[4]。在动物营养研究中,幼龄反刍动物早期饲喂策略[5]、营养水平[6-7]、饲粮结构[8]与后期生产性能有密切的相关关系,早期营养或代谢程序化对其后续生长和健康具有终生影响[9]。进一步了解和掌握早期营养调控对羔羊后期育肥的长期效应,对于制订和完善羔羊的科学培育和育肥策略具有重要意义。早期断奶技术不仅显著缩短了羔羊哺乳期和母羊繁殖间隔,而且促进了羔羊的生长发育[10-12]。早期断奶羔羊饲喂苜蓿可提高断奶前后生长性能及断奶后瘤胃发育和胴体重[13]。饲粮中性洗涤纤维(NDF)水平、来源等对羔羊生长发育的调控效果已有研究[14-16]。本团队前期研究表明,饲粮NDF水平不低于20%时,能够提高早期断奶羔羊的生长性能、屠宰性能以及心脏、肝脏等器官的重量[17]。然而,饲粮NDF水平调控早期断奶羔羊生长发育的长期效应目前仍不清楚。因此,本试验在羔羊哺乳期饲喂不同NDF水平饲粮,研究其对羔羊育肥期生长性能、血清学指标和屠宰性能的影响,以期探究早期饲粮NDF营养调控羔羊生长的长期效应,为羔羊育肥策略提供新思路及理论依据。
1 材料与方法
1.1 试验时间与地点
本试验于2016年11月至2017年4月在江苏海伦羊业有限公司进行。
1.2 试验设计
本试验采用单因素试验设计,选取体重[(6.10±0.10) kg]接近的(18±2)日龄湖羊公羔100只,随机分为4组,每组5个重复,每个重复5只。试验配制4种饲粮,对照组饲粮不添加粗饲料(NDF水平为10%,10N组),其余3组饲粮通过添加苜蓿使得NDF水平分别为15%(15N组)、20%(20N组)、25%(25N组)。试验预试期3 d,21~90日龄各组羔羊饲喂不同NDF水平的饲粮,90日龄后所有羔羊统一饲喂NDF水平为30%的全混合日粮(TMR)至150日龄,其中在换料时有7 d的过渡期。
1.3 试验饲粮
90日龄前以苜蓿为主要NDF来源配制饲粮,4种饲粮等能等氮。90日龄后以羊草、苜蓿、大豆秸秆为NDF来源配制饲粮。羔羊代乳品和预混料均由北京精准动物研究中心提供,其他原料由试验羊场提供。试验饲粮组成及营养水平见表1。试验饲粮制成颗粒料形式饲喂。
1.4 饲养管理
所有试验羔羊均打耳号,免疫程序按羊场正规程序进行,每隔半个月对羊舍消毒1次(0.5%百毒杀、0.1%新洁尔灭)。羔羊于18日龄开始由随母哺乳逐渐过渡为饲喂代乳粉,同时饲喂颗粒料。在21日龄正式开始试验,代乳粉按体重的1%饲喂至60日龄,具体饲喂参照祁敏丽等[18]试验中的方法进行,全期颗粒料自由采食,颗粒料和代乳粉每天饲喂2次(06:00和16:00)。羔羊60日龄后停喂液体饲料,完全饲喂颗粒料,至90日龄后,所有羔羊饲喂相同TMR至150日龄,其中换料时有7 d过渡期。

表1 试验饲粮组成及营养水平(干物质基础)

续表1项目 Items中性洗涤纤维水平 NDF level/%1015202530磷酸氢钙 CaHPO41.401.201.051.200.50食盐 NaCl0.600.600.600.600.50预混料 Premix1)1.001.001.001.001.00合计 Total100.00100.00100.00100.00100.00营养水平 Nutrient levels2)代谢能 ME/(MJ/kg)11.3311.3311.3311.339.83干物质 DM86.8687.0585.1785.6194.75粗蛋白质 CP19.6319.4619.9418.8314.01粗脂肪 EE2.815.667.378.072.54粗灰分 Ash4.734.924.845.514.32中性洗涤纤维 NDF14.6418.4022.4124.9727.12钙 Ca1.671.671.671.530.72总磷 TP0.740.770.760.750.41
1)预混料为每千克饲粮提供The premix provided the following per kg of diet:VA 12 000 IU,VD 2 000 IU,VE 30 IU,Cu 12 mg,Fe 64 mg,Mn 56 mg,Zn 60 mg,I 1.2 mg,Se 0.4 mg,Co 0.4 mg。
2)营养水平除代谢能外均为实测值。Nutrient values were all measured values except ME.
1.5 测定指标与方法
1.5.1 试验饲粮常规营养成分测定
总能使用Parr-6400氧弹式量热仪测定;粗蛋白质含量使用KDY-9830全自动凯氏定氮仪测定;干物质、粗脂肪、NDF、酸性洗涤纤维(ADF)、钙、总磷含量或水平等指标参考《饲料分析及饲料质量检测技术》[19]测定。
1.5.2 生长性能
羔羊90、120和150日龄晨饲前记录体重,每天准确记录投料量,每5 d记录剩料量,计算各阶段的体重、平均干物质采食量、平均日增重和料重比。
1.5.3 血清学指标
在150日龄时每组随机挑选6只接近平均体重的羔羊进行颈静脉采血,1 040×g离心10 min,分离得到的血清-20 ℃保存,用于检测血清学指标。使用日立7160全自动生化仪测定血清中葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(UN)、尿酸(UA)、肌酐(Cre)的含量并计算白球比(A/G),采用酶联免疫吸附试验法测定血清中胰岛素(INS)、β-羟丁酸(BHBA)、生长激素(GH)、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)的含量。
1.5.4 屠宰性能和组织器官发育指标
在150日龄时每组选取健康、体重接近该组平均体重的羔羊6只,禁食、禁水16 h后,静脉放血致死。屠宰前称量屠宰羔羊体重即为宰前活重(live weight before slaughter,LWBS),解剖后称量胴体、头、蹄、皮毛、心脏、肝脏、脾脏、肺脏、肾脏重,计算屠宰率和组织器官发育指标。
1.6 数据处理
试验数据采用Excel 2007进行初步整理,采用SPSS 19.0统计软件的ANOVA程序进行单因素方差分析,差异显著时用Duncan氏法进行多重比较,并采用线性和二次回归来分析饲粮NDF水平的影响。以P<0.05作为差异显著的判断标准,以0.05≤P<0.10作为有变化趋势的判断标准。
2 结果与分析
2.1 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期生长性能的影响
2.1.1 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期体重的影响
由表2可知,随着饲粮NDF水平的提高,羔羊90、120和150日龄体重均线性增加(P=0.003、P<0.001、P=0.034)。在90日龄时,15N组、20N组和25N组羔羊体重均显著高于10N组(P<0.05);在120日龄时,20N组和25N组羔羊体重均显著高于10N组(P<0.05),其余各组间差异不显著(P>0.05);在150日龄时,25N组体重最高,10N组体重最低,15N组、20N组和25N组羔羊体重较10N组有升高的趋势(P=0.079)。
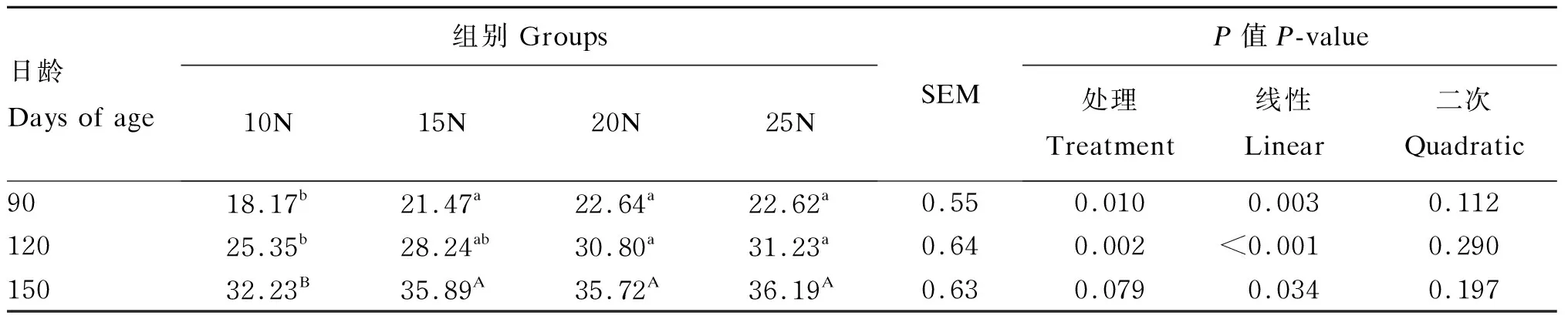
表2 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期体重的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示有变化趋势(0.05≤P<0.10)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean variation trend (0.05≤P<0.10). The same as below.
2.1.2 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期平均日增重的影响
由表3可知,随着饲粮NDF水平的提高,羔羊90~120日龄阶段平均日增重线性增加(P=0.006),而120~150日龄阶段平均日增重则线性降低(P<0.001)。在90~120日龄阶段,20N组和25N组羔羊平均日增重显著高于10N组和15N组(P<0.05);在120~150日龄阶段,20N组和25N组羔羊平均日增重显著低于10N组和15N组(P<0.05);就整个采样期(90~150日龄阶段)而言,羔羊平均日增重各组间差异不显著(P>0.05)。

表3 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期平均日增重的影响
2.1.3 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期平均干物质采食量的影响
由表4可知,随着饲粮NDF水平的提高,羔羊90~120日龄阶段平均干物质采食量线性增加(P=0.025)。在90~120日龄阶段,20N组平均干物质采食量显著高于10N组(P<0.05),其余各组间无显著差异(P>0.05)。尽管在120~150日龄阶段,随着饲粮NDF水平的提高平均干物质采食量线性增加(P<0.001),但是各组间无显著差异(P>0.05)。就整个采样期而言,羔羊平均干物质采食量各组间差异不显著(P>0.05)。
2.1.4 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期料重比的影响
由表5可知,在90~120日龄阶段,羔羊料重比各组间差异不显著(P>0.05);在120~150日龄阶段,随着饲粮NDF水平的提高,料重比线性增加(P=0.025),且以15N组最低,25N组最高,但组间差异不显著(P>0.05)。就整个采样期而言,羔羊料重比各组间差异不显著(P>0.05)。
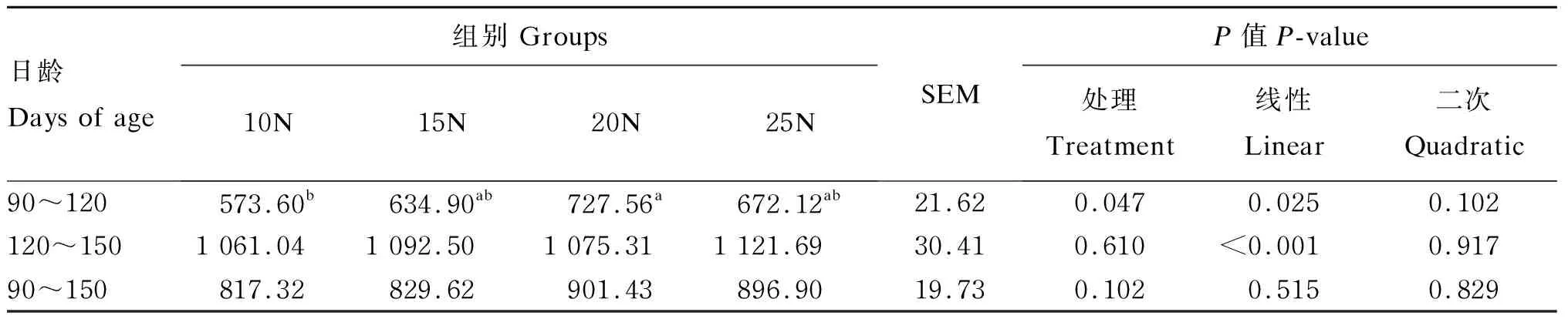
表4 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期平均干物质采食量的影响
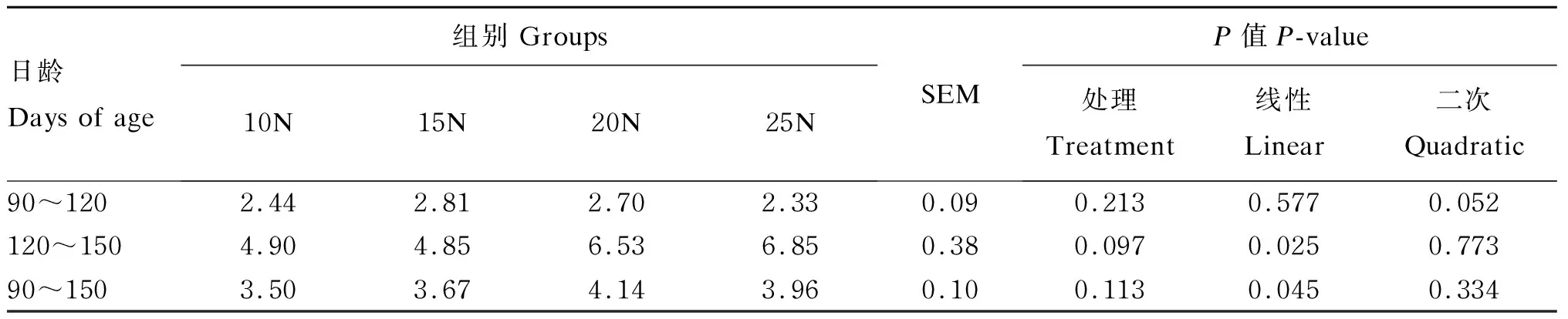
表5 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期料重比的影响
2.2 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期血清学指标的影响
由表6可知,随着饲粮NDF水平的提高,羔羊血清TP、ALB和BHBA含量均线性增加(P=0.046、P=0.006、P=0.003)。20N组羔羊血清TP含量显著高于10N组(P<0.05),其余各组间差异不显著(P>0.05)。20N组和25N组羔羊血清ALB含量显著高于10N组(P<0.05),其余各组间差异不显著(P>0.05)。25N组羔羊血清BHBA含量显著高于10N组和15N组(P<0.05),其余各组间差异不显著(P>0.05)。早期断奶羔羊饲喂不同NDF水平饲粮对150日龄羔羊血清GLU、GLB、UN、UA、Cre、INS、GH和IGF-Ⅰ含量及A/G均无显著影响(P>0.05)。
2.3 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期屠宰性能的影响
由表7可知,随着饲粮NDF水平的提高,羔羊宰前活重和胴体重线性增加(P=0.034、P=0.015)。宰前活重各组间差异不显著(P>0.05),胴体重以25N组最高,10N组最低,20N组和25N组胴体重较10N组有增加的趋势(P=0.061)。此外,屠宰率各组间无显著差异(P>0.05)。
2.4 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期组织器官发育的影响
由表8可知,随着饲粮NDF水平的提高,头的重量和占宰前活重的比例分别有线性增加和下降趋势(P=0.096、P=0.083),其中头的重量各组间差异不显著(P>0.05),头占宰前活重的比例20N组显著低于10N组(P<0.05)。15N组羔羊蹄的重量较10N组有增加趋势(P=0.070),蹄占宰前活重的比例随着饲粮NDF水平的提高有降低趋势(P=0.090),但是各组间无显著差异(P>0.05)。随着饲粮NDF水平的提高,心脏的重量线性增加(P=0.034),肺脏和肾脏占宰前活重的比例线性降低(P=0.038、P=0.026),但各组间均无显著差异(P>0.05)。
3 讨 论
3.1 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期生长性能的影响
本试验结果表明,早期断奶羔羊饲喂不同NDF水平饲粮影响120日龄羔羊体重及90~120日龄阶段羔羊的平均日增重和平均干物质采食量。20N组和25N组羔羊120日龄体重分别较10N组提高了21.50%和23.17%。这可能因为是在21~90日龄阶段,10N组饲粮含少量的NDF(大量易发酵碳水化合物),而20N组和25N组饲粮NDF水平适中,有助于调控瘤胃发酵速率,提高瘤胃液pH,维持适宜的瘤胃内环境[13],提高营养物质的消化率;加之,饲粮中的粗饲料有利于移除瘤胃壁死亡细胞,防止瘤胃角化不全和瘤胃乳头的凝集[20],进而促进瘤胃上皮对营养物质的吸收功能。这种早期完善的瘤胃结构和功能为90日龄后高生长性能的发挥奠定了基础。此外,羔羊统一饲喂后初期,即90~120日龄阶段,20N组和25N组的平均干物质采食量仍显著高于10N组,这也是由于早期20%和25%NDF水平饲粮更有利于瘤胃的充分发育,最总导致了采食量的增加。陈玲等[21]研究了湖羊的生长发育规律并建立了最优生长发育模型,累积生长曲线表明3~7月龄湖羊的生长开始呈递减趋势,7月龄之后趋于平缓;此外,实测体重也发现湖羊7月龄后平均日增重出现明显降低。对比本试验与上述试验实测及最优模型结果发现,湖羊均在体重达约30 kg后增长速度出现明显下降。这就表明,20N组和25N组120~150日龄阶段生长速度较90~120日龄阶段出现明显的下降可能是湖羊自身生长发育规律所致。而10N组和15N组在120~150日龄阶段平均日增重与90~120日龄阶段相比变化较小,这一现象主要是21~90日龄阶段饲喂低NDF水平饲粮导致。因为大量易发酵碳水化合物引起发酵产物的快速积累,进而致使瘤胃液pH降低,出现乳头角化不全和瘤胃上皮黏膜结块现象[22],最终使瘤胃上皮对营养物质的吸收受到影响[23];90日龄后经适宜的NDF水平饲粮饲喂一段时间,瘤胃的结构和功能逐步完善。瘤胃结构和功能上的“补偿发育”促进了采食,最终表现为120~150日龄阶段有相对稳定的平均日增重。本试验中,尽管各组羔羊料重比在各个日龄阶段均差异不显著,但是在120~150阶段,料重比表现出随着饲喂饲粮NDF水平的提高而线性增加。这也可能是由于20N组和25N组羔羊的生长发育进入稳定区所致。另外,本试验中15N组、20N组和25N组羔羊150日龄时体重分别较10N组提高了11.36%、10.83%和12.29%。这也表明,从生长性能看,早期断奶羔羊饲喂NDF水平为15%、20%和25%的饲粮均可有效促进150日龄前的生长性能。

表6 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期血清学指标的影响

表7 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期屠宰性能的影响
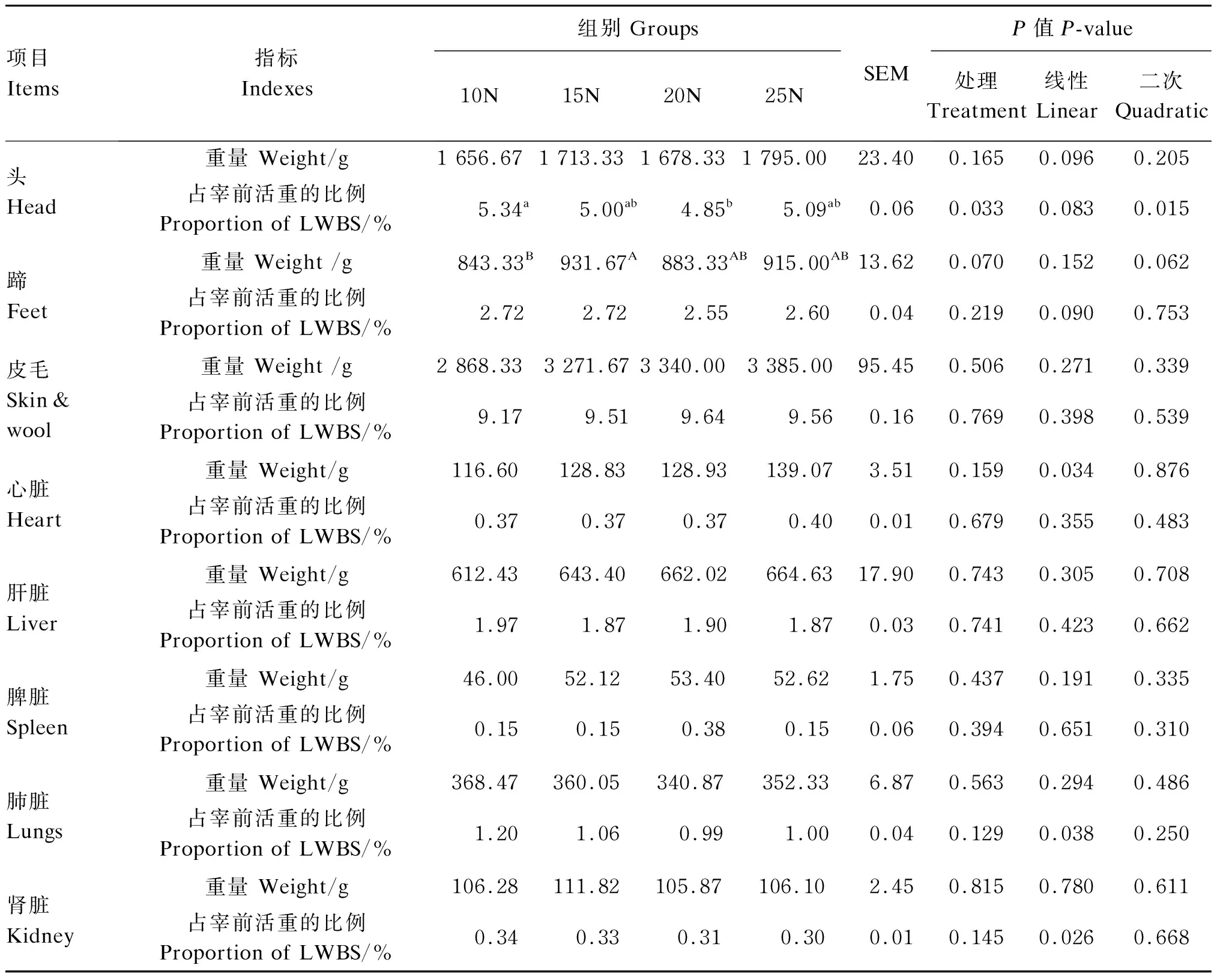
表8 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期组织器官发育的影响
综上所述,早期断奶羔羊饲喂NDF水平不低于20%的饲粮促进了羔羊90~120日龄阶段的生长性能;120日龄后,饲喂低DNF水平饲粮后羔羊才以较快的速度生长,但是从整个试验期的生长性能来看,以饲喂NDF水平为15%、20%和25%的饲粮效果较佳。
3.2 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期血清学指标的影响
血液生化指标能够反映机体的新陈代谢机能和相关器官的健康状况[24]。血清TP由ALB和GLB两部分组成。TP与机体免疫力和代谢水平相关,其含量升高有利于提高免疫力和代谢水平,促进动物健康快速生长。ALB主要功能是维持血浆渗透压和作为营养物质载体,此外其本身也是机体蛋白质的一个来源。本试验结果显示,20N组血清TP含量显著高于10N组,这主要是由血清ALB含量造成的。羔羊150日龄时,20N组和25N组血清ALB含量显著高于10N组,这表明早期断奶羔羊饲喂不同NDF水平饲粮影响了150日龄阶段的血清ALB含量,同时说明早期饲喂NDF水平为20%和25%的饲粮时更有利于羔羊后期的生长。另外,羔羊90日龄时,尽管血清ALB含量差异不显著,但是有随NDF水平提高而增加的趋势。关于,早期断奶羔羊饲喂不同NDF水平饲粮对90和150日龄血清ALB含量影响的原因有待蛋白质消化代谢的数据解释或进一步研究。
瘤胃上皮细胞中丁酸代谢途径主要是生成酮体[25-26],因此血清BHBA含量在一定程度可以衡量瘤胃表皮丁酸转化为BHBA的代谢能力及瘤胃上皮的发育程度。早期断奶幼畜血清BHBA含量受饲喂策略[27]、饲粮结构[28]和断奶时间[29]的影响。Deelen等[30]研究表明早期断奶幼畜血清BHBA含量与采食量呈正相关。本试验在90日龄时也发现了高水平的NDF饲粮促进了血清BHBA含量和平均干物质采食量的提高。因此,血清BHBA含量的提高是由于高水平NDF饲粮促进干物质采食量还是由于促进瘤胃表皮丁酸的代谢及瘤胃表皮的发育还有待进一步验证。但是,在150日龄时,可以发现随着饲粮NDF水平的提高,血清BHBA含量呈线性增加,并且25N组显著高于10N组;同时,120~150日龄阶段各组间平均干物质采食量差异不显著。这就表明,这一阶段血清BHBA含量排除了采食量的影响,所以推测早期饲喂高NDF水平饲粮很有可能是由于促进了丁酸的代谢及瘤胃表皮的发育,并且这种效应具有持续性和长期效应。
3.3 早期断奶羔羊饲喂不同NDF水平饲粮对羔羊育肥期屠宰性能和组织器官发育的影响
本试验中,在90日龄时15N组、20N组和25N组羔羊胴体重分别比10N组提高14.40%、24.68%和28.45%,在150日龄时分别提高11.03%、14.68%和15.38%,胴体重差距的缩小与生长性能指标相对应,这是由于10N组饲喂正常NDF水平饲粮后生长速率加快,而20N组和25组在试验后期进入了生长发育的平台期,因此导致了胴体重差异的缩小。尽管胴体重差距在缩小,但是早期断奶羔羊饲喂低NDF水平饲粮还是降低了屠宰性能,影响羔羊的产肉。在90日龄时头占宰前活重的比例最高而蹄的重量最低,在150日龄时可以发现同样的现象,其原因有待进一步研究。早期断奶羔羊饲喂高NDF水平饲粮促进了心脏、肝脏和脾脏的发育,而在150日龄时各组间差异基本消失。这表明,当统一饲喂一段时间后,这些器官和相应功能均达到一致水平。
4 结 论
本试验条件下,早期断奶羔羊饲喂较高NDF水平(20%和25%)的饲粮提高了羔羊育肥期的生长性能。早期较快的生长对羔羊育肥期生长性能有促进作用,但是这种促生长作用持续性仅为1个月,在育肥后期反而生长强度降低,表明饲粮适宜NDF水平不能仅根据羔羊早期的性状确定,从长期的生长表现探究饲粮NDF水平更加科学。
致谢:
感谢贾鹏、樊庆山和芦伟同学在屠宰试验过程中给予的帮助,同时也感谢南京农业大学李奉哲、冯旭和郑健同学在羔羊称重和采血等方面给予的帮助。
[1] LUCAS A.Programming by early nutrition in man[J].CIBA Foundation Symposium,1991,156:38-50.
[2] HOCHBERG Z,FEIL R,CONSTANCIA M,et al.Child health,developmental plasticity,and epigenetic programming[J].Endocrine Reviews,2010,32(2):159-224.
[3] EWIEDMEIER J,AJOSS-MOORE L,HLANE R,et al.Early postnatal nutrition and programming of the preterm neonate[J].Nutrition Reviews,2011,69(2):76-82.
[4] FAITH J J,GURUGE J L,CHARBONNEAU M,et al.The long-term stability of the human gut microbiota[J].Science,2013,341(6141):1237439.
[5] MOALLEM U,WERNER D,LEHRER H,et al.Long-term effects of ad libitum whole milk prior to weaning and prepubertal protein supplementation on skeletal growth rate and first-lactation milk production[J].Journal of Dairy Science,2010,93(6):2639-2650.
[6] SOBERON F,RAFFRENATO E,EVERETT R W,et al.Preweaning milk replacer intake and effects on long-term productivity of dairy calves[J].Journal of Dairy Science,2012,95(2):783-793.
[7] 侯生珍,吕凯,王志有,等.蛋白水平及Lys/Met配比对早期断奶藏羔羊肌肉组织学形态的影响[J].山东农业大学学报,2013(4):543-549.
[8] CASTELLS L,BACH A,TERRÉ M.Short-and long-term effects of forage supplementation of calves during the preweaning period on performance,reproduction,and milk yield at first lactation[J].Journal of Dairy Science,2015,98(7):4748-4753.
[9] STEELE M A,MALMUTHUGE N,GUAN L L.Dietary factors influencing the development of the ruminant gastrointestinal tract[J].Chemosphere,2015,41(7):1007-1010.
[10] 柴建民,王海超,刁其玉,等.断奶时间对羔羊生长性能和器官发育及血清学指标的影响[J].中国农业科学,2015,48(26):4979-4988.
[11] 郭江鹏,郝正里,李发弟,等.早期断奶对舍饲肉用羔羊消化器官发育的影响[J].畜牧兽医学报,2013,44(7):1078-1089.
[12] 王彩莲,郝正里,李发弟,等.0~56日龄放牧羔羊消化道的解剖特点和瘤胃功能变化[J].畜牧兽医学报,2010,41(4):417-424.
[13] YANG B,HE B,WANG S S,et al.Early supplementation of starter pellets with alfalfa improves the performance of pre- and postweaningHulambs[J].Journal of Animal Science,2015,93(10):4984-4994.
[14] 赵新德,于满满,姜雨轩,等.不同日粮组成对羔羊生长性能的影响[J].黑龙江畜牧兽医,2017(19):128-131.
[15] 吕佳颖.粗饲料来源对育肥羔羊生产性能和瘤胃微生物区系的影响[D].硕士学位论文.兰州:兰州大学,2017.
[16] 张立涛.25-50 kg杜寒杂交F1代肉用绵羊日粮NDF适宜水平的研究[D].硕士学位论文.北京:中国农业科学院,2013.
[17] 解彪,张乃峰,崔凯,等.不同中性洗涤纤维水平饲粮对早期断奶羔羊生长性能、血清指标、屠宰性能和组织器官发育的影响[J].动物营养学报,2018,30(3):963-972.
[18] 祁敏丽,马铁伟,刁其玉,等.饲粮营养限制对断奶湖羊羔羊生长、屠宰性能以及器官发育的影响[J].畜牧兽医学报,2016,47(8):1601-1609.
[19] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[21] 陈玲,吕晓阳,王庆增,等.湖羊生长发育曲线模型预测及趋势分析[J].中国畜牧兽医,2014,41(12):239-243.
[23] HINDERS R G,OWEN F G.Relation of ruminal parakeratosis development to volatile fatty acid absorption[J].Journal of Dairy Science,1965,48(8):1069-1073.
[24] PICCIONE G,CASELLA S,LUTRI L,et al.Reference values for some haematological,haematochemical,and electrophoretic parameters in the Girgentana goat[J].Turkish Journal of Veterinary and Animal Sciences,2014,34(2):197-204.
[25] KHAN M A,BACH A,WEARY D M,et al.Invitedreview:transitioning from milk to solid feed in dairy heifers[J].Journal of Dairy Science,2016,99(2):885-902.
[26] LANE M A,BALDWIN R L V,JESSE B W.Sheep rumen metabolic development in response to age and dietary treatments[J].Journal of Animal Science,2000,78(7):1990-1996.
[27] OMIDI-MIRZAEI H,KHORVASH M,GHORBANI G R,et al.Effects of the step-up/step-down and step-down milk feeding procedures on the performance,structural growth,and blood metabolites of Holstein dairy calves[J].Journal of Dairy Science,2015,98(11):7975-7981.
[28] NEMATI M,AMANLOU H,KHORVASH M,et al.Effect of different alfalfa hay levels on growth performance,rumen fermentation,and structural growth of Holstein dairy calves[J].Journal of Animal Science,2016,94(3):1141-1148.
[29] ECKERT E,BROWN H E,LESLIE K E,et al.Weaning age affects growth,feed intake,gastrointestinal development,and behavior in Holstein calves fed an elevated plane of nutrition during the preweaning stage[J].Journal of Dairy Science,2015,98(9):6315-6326.
[30] DEELEN S M,LESLIE K E,STEELE M A,et al.Validation of a calf-side β-hydroxybutyrate test and its utility for estimation of starter intake in dairy calves around weaning[J].Journal of Dairy Science,2016,99(9):7624-7633.

