能量限饲对肉鸡生长性能、血清免疫球蛋白含量、 外周血T淋巴细胞亚群和血脂水平的影响
霍文颖 王志祥 黄艳群 陈 文*
(1.河南农业大学饲料营养河南省工程实验室,郑州 450002;2.河南牧业经济学院,郑州 450046)
通常人们认为肉鸡在遗传背景一定的情况下采食量越大上市体重就越大,因此在生产实际中一般肉鸡自由采食的能量是其维持需要的2~3倍[1],结果导致肉鸡脂肪大量沉积、新陈代谢及骨代谢失调、免疫力降低、死亡率增加,猝死症、腹水症等疾病频发[2-4],同时沉积单位脂肪比沉积单位瘦肉消耗更多能量,降低饲料利用效率[5],因此减少脂肪沉积是现代肉鸡生产必须面对的一个问题。试验证明,采用适度水平的限制饲养,可有效降低动物腹水症、猝死症等各类代谢疾病的发生率及其总死亡率,增强机体的免疫功能,改善肉品质,降低料重比,提高生产效益[6-8]。徐良梅等[9]、李金峰等[10]研究肉种鸡能量限饲对子代肉鸡的影响,结果发现,母代肉种鸡进行20%能量限饲可显著提高28日龄子代肉鸡的腿肌肌节长度、血清总胆固醇和生长激素含量,显著降低腹脂率。研究显示,免疫与代谢在生理和疾病中相互影响,一方面,天然和获得性免疫系统都参与非免疫性疾病,如肥胖产生代谢和免疫方面异常,进而导致对心血管疾病、Ⅱ型糖尿病、癌症和神经退行性病变的易感;另一方面,免疫细胞(如淋巴细胞和白细胞)在多层面受到内部能量代谢的调节[11]。这种存在于免疫应答与代谢之间的相互作用揭示了正确调节和管理能量摄入、保持二者之间的微妙平衡对于机体健康至关重要[12]。能量限食因成为目前发现的能延长人类寿命、增进健康的有效方法而备受关注[13]。有关能量限饲的研究已从脊椎动物扩展到几乎所有的无脊椎动物,但研究结果不一致,机制也存在争议[14]。本试验旨在研究不同能量限饲水平对肉鸡生长性能、血清指标及免疫功能的影响,为肉鸡生产中合理限饲的应用提供理论依据;同时鸡作为一种模式动物,对其血清生化指标及免疫功能的研究,可为进一步探索能量限饲增进动物健康和延长寿命的潜在机制提供物种间的比较。
1 材料与方法
1.1 试验动物与试验设计
选取1日龄健康科宝(Cobb)雏鸡1 000只,网上饲养,按照NRC(1994)建议的肉仔鸡营养需要量配制饲粮,自由采食,常规饲养管理;饲养至22日龄时,从1 000只肉鸡中挑选出体重相似的雄性肉鸡72只,逐只称重后,随机分为3个组,分别为对照组、试验1组(15%能量限饲组)和试验2组(30%能量限饲组),每组24个重复,每个重复1只鸡,单笼饲养。
1.2 试验饲粮
对照组饲粮按照NRC(1994)建议的肉中鸡营养需要量配制成颗粒料,依照Cobb雄性肉鸡相应日龄的推荐采食量每天每只定量供给。3组饲粮的代谢能水平保持一致,调整试验1组和试验2组除代谢能之外的其他养分含量,以对照组为基础控制试验1组和试验2组的采食量分别为对照组的85%和70%,保证试验1组和试验2组摄入的能量比对照组分别低15%和30%,而其他各养分摄入量与对照组相同。试验饲粮组成及营养水平见表1。
1.3 饲养管理
本试验在河南农业大学畜牧站动物实验房进行,试验期20 d。试验期内鸡只定量采食、充足饮水,正常饲养管理,按照肉鸡常规免疫程序免疫接种。每天以重复为单位分别记录各组的日采食量,观察试验鸡的精神状态、食欲及粪便情况,记录死亡鸡只数。

表1 试验饲粮组成及营养水平(风干基础)

续表1项目 Items对照组 Control group 试验1组 Trial group 1试验2组 Trial group 2钙 Ca0.90(0.91)1.06(1.07)1.29(1.27)总磷 TP0.60(0.61)0.69(0.68)0.82(0.81)有效磷 AP0.400.470.57赖氨酸 Lys1.111.311.59蛋氨酸 Met0.400.470.57
1)预混料为每千克饲粮提供 The premix provided the following per kg of diets:VA 1 150 IU,VB12.5 mg,VB26.7 mg,VB66 mg,VB120.05 mg,VD33 500 IU,VE 25 IU,VK34.8 mg,生物素 biotin 2 mg,叶酸 folic acid 2.8 mg,泛酸 pantothenic acid 11 mg,烟酸 nicotinic acid 30 mg,Cu (as copper sulfate) 8 mg,Fe (as ferrous sulfate) 80 mg,Mn (as manganese sulfate) 82 mg,Zn (as zinc sulfate) 60 mg,I (as potassium iodide) 0.40 mg,Se (as sodium selenite) 0.30 mg。
2)括号内为实测值,其余均为计算值。The values in parentheses were measured values, while the others were calculated values.
1.4 测定指标与方法
1.4.1 生长性能
每天定时称料,记录每只鸡的日采食量。分别于28、42日龄禁食12 h后,早上空腹称重,根据初重、末重、日采食量,计算各个阶段鸡只的平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)。
1.4.2 血清指标
分别于28、42日龄时,每组分别挑选10只体重相近的试验鸡,翅下静脉采血置于采血管中,室温静置2 h后3 000 r/min离心10 min制备血清,用免疫比浊法测定血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量;用全自动生化分析仪(RA-1000,Bayer公司,美国)测定血清葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量。
1.4.3 外周血T淋巴细胞亚群
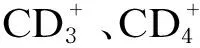
1.4.4 免疫器官指数
分别于28、42日龄时,每组分别挑选10只体重相近的试验鸡屠宰,解剖取胸腺、脾脏、法氏囊并称重,计算免疫器官指数,公式为:
免疫器官指数(g/kg)=免疫器官重(g)/
鸡只活重(kg)。
1.5 数据统计与分析
数据采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法多重比较进行差异显著性检验。P<0.05作为差异显著性判断标准,结果以平均值±标准差(mean±SD)表示。
2 结 果
2.1 能量限饲对肉鸡生长性能的影响
由表2可知,22~28日龄时,与对照组相比,试验1组和试验2组肉鸡的末重和平均日增重均显著降低(P<0.05),试验2组显著低于试验1组(P<0.05);各组的料重比无显著差异(P>0.05)。22~42日龄时,与对照组相比,试验1组和试验2组肉鸡的末重和平均日增重均显著降低(P<0.05),试验2组显著低于试验1组(P<0.05);试验2组的料重比显著高于试验1组和对照组(P<0.05),试验1组与对照组无显著差异(P>0.05)。
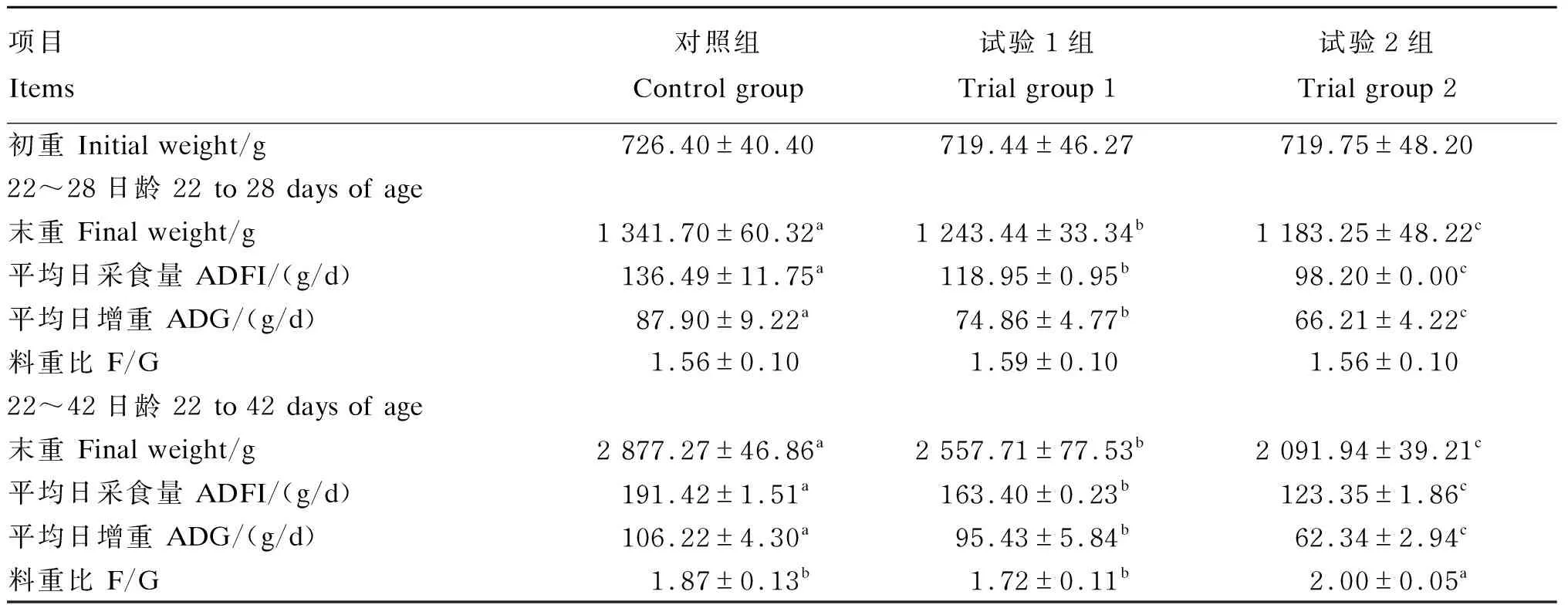
表2 能量限饲对肉鸡生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 能量限饲对肉鸡血清指标的影响
由表3可知,28日龄时,试验1组和试验2组肉鸡的血清IgM含量显著高于对照组(P<0.05),试验1组与试验2组无显著差异(P>0.05);试验1组和试验2组的血清IgG含量与对照组相比有增加趋势(P>0.05);试验2组的血清IgA含量显著高于对照组(P<0.05)。42日龄时,试验1组和试验2组肉鸡的血清IgG和IgA含量显著高于对照组(P<0.05)。
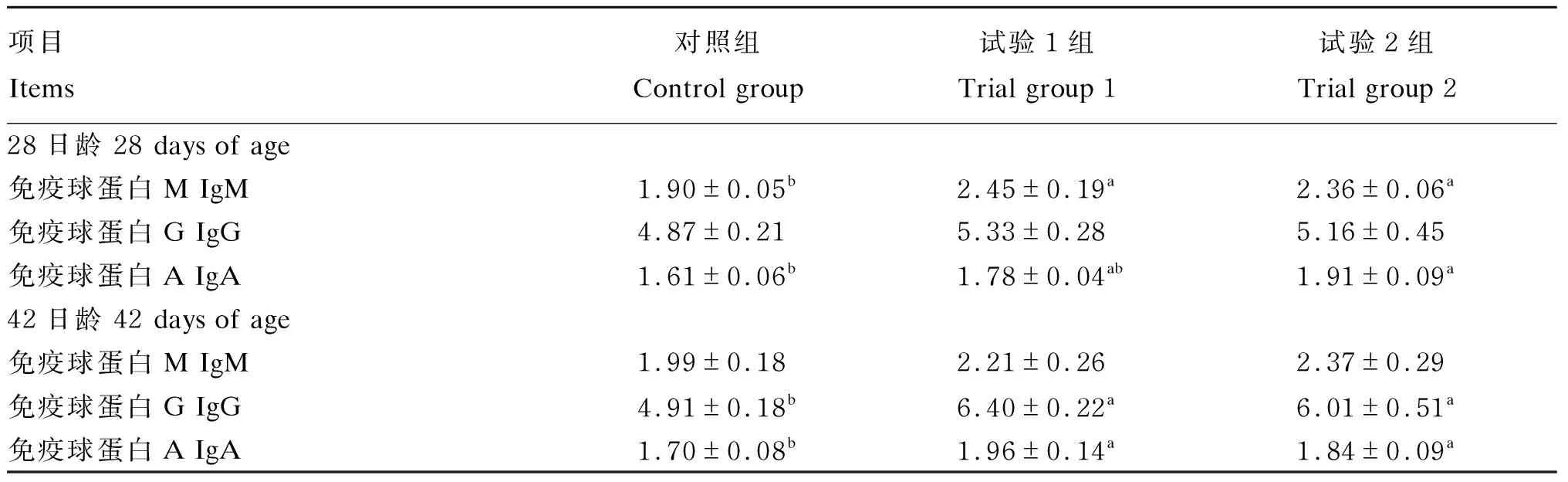
表3 能量限饲对肉鸡血清免疫球蛋白含量的影响
由表4可知,28日龄时,试验2组肉鸡的血清总胆固醇含量显著低于对照组(P<0.05),试验1组低于对照组(P>0.05);试验1组和试验2组的血清高密度脂蛋白胆固醇含量显著低于对照组(P<0.05),试验2组显著低于试验1组(P<0.05);各组的血清葡萄糖、甘油三酯和低密度脂蛋白胆固醇含量无显著差异(P>0.05)。42日龄时,试验2组肉鸡的血清总胆固醇含量显著低于对照组(P<0.05);试验2组的血清甘油三酯和高密度脂蛋白胆固醇含量显著低于试验1组和对照组(P<0.05);试验1组和试验2组的血清葡萄糖含量低于对照组(P>0.05)。

表4 能量限饲对肉鸡血清生化指标的影响
2.3 能量限饲对肉鸡外周血T淋巴细胞亚群的影响
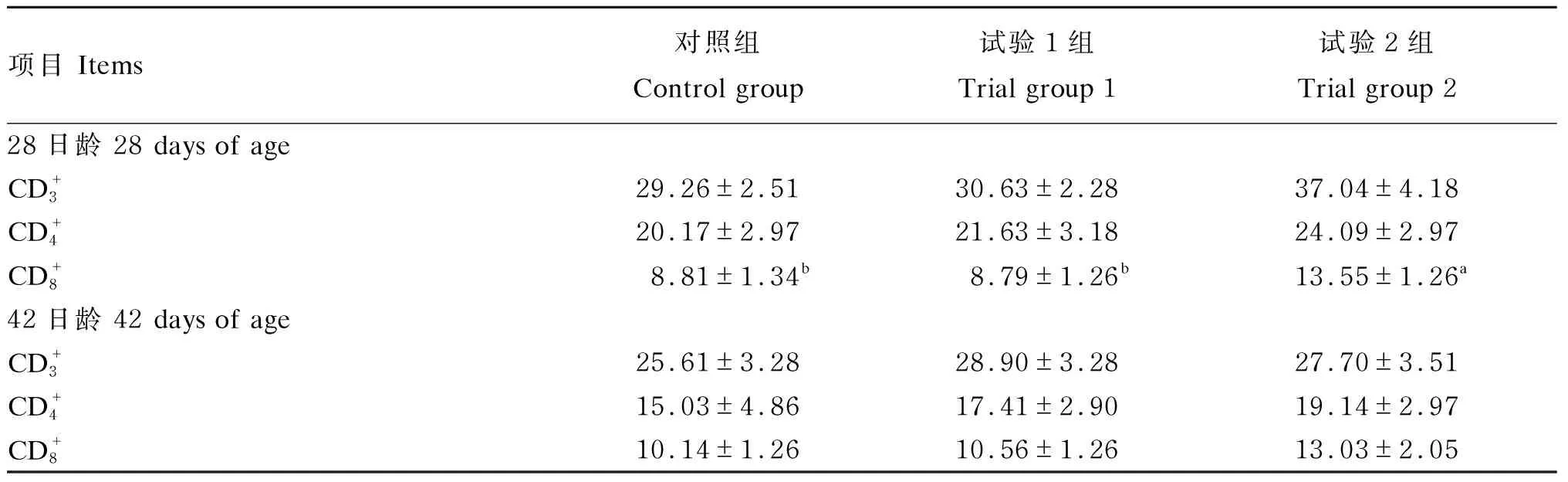
表5 能量限饲对肉鸡外周血T淋巴细胞亚群的影响
2.4 能量限饲对肉鸡免疫器官指数的影响
由表6可知,28日龄时,试验2组肉鸡的法氏囊指数显著大于对照组(P<0.05),试验1组与对照组相比无显著差异(P>0.05);各组的胸腺指数和脾脏指数无显著差异(P>0.05)。42日龄时,试验2组肉鸡的脾脏指数显著大于试验1组和对照组(P<0.05);各组的法氏囊指数和胸腺指数无显著差异(P>0.05)。
3 讨 论
3.1 能量限饲对肉鸡生长性能的影响
本试验结果显示,15%和30%能量限饲显著降低了肉鸡的末重、平均日采食量、平均日增重,30%能量限饲组显著低于15%能量限饲组;22~28日龄时各组的料重比无显著差异,但22~42日龄时30%能量限饲组的料重比显著高于15%能量限饲组和对照组,15%能量限饲组的料重比最低。赵高[15]报道认为,哈伯德肉鸡分别进行能量限制和料量限制饲养,限饲组的平均日增重显著低于自由采食组,料重比显著高于自由采食组,与本试验研究结果相一致。Urdaneta-Rincon等[16]研究显示,5~42日龄肉鸡分别进行5%、10%和15%的料量限饲,限饲组的42日龄体重显著低于自由采食组。Saleh等[17]研究表明,肉鸡生长早期(7~14日龄)采用不同能量梯度的饲粮(能量和粗蛋白质比例一致)按鸡对能量的维持需要饲喂,14、21、42、63日龄体重均显著低于自由采食组,采食量也显著低于自由采食组,而饲料转化率、能量利用效率显著高于自由采食组。Miao等[18]分别采用12.12和13.37 MJ/kg的能量水平饲喂肉鸡至35日龄,结果发现能量限饲降低了日增重,增加了1~21日龄时的饲料转化效率,对22~35日龄时的饲料转化效率无显著影响,与本试验的部分结果一致。Deaton[19]研究显示,7~14日龄肉鸡进行10%的料量限饲对41日龄时体重和整个试验期的生长速度无显著影响,究其原因可能是:1)限饲的时间较短,只有1周;2)10%的料量限制,限饲的程度较低。较短时间内的低程度限饲使肉鸡在后期表现出补偿生长效应。

表6 能量限饲对肉鸡免疫器官指数的影响
3.2 能量限饲对肉鸡血清指标的影响
免疫球蛋白作为防御病原的分子在适应性免疫系统中发挥重要作用。免疫球蛋白典型的分子结构是由2个相同的重(H)链和2个轻(L)链组成,H和L链又分为可变区域和恒定区域。根据所含重链的不同,家禽的免疫球蛋白分为IgA、IgG和IgM。免疫球蛋白广泛参与机体免疫应答,免疫球蛋白含量的高低直接影响机体的免疫力强弱。本试验结果显示,15%和30%能量限饲显著增加了28日龄时肉鸡的血清IgM含量以及42日龄时的血清IgG和IgA含量。有关能量限饲对肉鸡血清免疫球蛋白含量影响的报道较少,徐德立等[20]报道认为,成年雄性黑线仓鼠进行10%的料量限饲,连续限饲21 d,显著增加了血清IgG和IgA含量。Nayak等[21]研究认为,大鼠进行20%和40%的能量限饲,显著增加了脾脏的IgG、IgM和IgA细胞数量。Ebersole等[22]报道认为,能量限饲显著增加了猕猴血清IgM和IgG含量,与本试验结果相一致。但Lara-Padilla等[23]研究显示,小鼠采用隔天禁食的方法连续饲养18周,与自由采食相比,隔天禁食显著降低了小鼠小肠和血清IgA含量,与本试验结果相反。以上结果不同的原因可能是由于限饲量、饲喂方式不同造成的,但具体机制仍需进一步研究。
作为代谢标记物的空腹血清葡萄糖、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆固醇含量与机体脂肪沉积和代谢相关疾病的发生密切相关。血清甘油三酯和葡萄糖含量与家禽胴体脂肪含量呈正相关[24-25]。本试验结果显示,15%能量限饲显著降低了28日龄时肉鸡的血清高密度脂蛋白胆固醇含量,血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇含量有下降趋势但差异不显著,对血清葡萄糖含量无显著影响。30%能量限饲显著降低了28日龄时肉鸡的血清总胆固醇和高密度脂蛋白胆固醇含量,血清甘油三酯和低密度脂蛋白胆固醇含量有降低趋势,对血清葡萄糖含量无显著影响;30%能量限饲显著降低了42日龄时肉鸡的血清总胆固醇、高密度脂蛋白胆固醇和甘油三酯含量。赵高[15]研究显示,能量限饲显著降低了肉鸡血清甘油三酯、胆固醇和高密度脂蛋白胆固醇含量,对血清葡萄糖含量则无显著影响,与本试验结果相一致。王佳伟[26]研究报道,30%能量限饲显著降低了血清甘油三酯和葡萄糖含量,极显著降低了血清胆固醇和高密度脂蛋白胆固醇含量,与本试验结果部分一致。陈永如[27]通过高热量饮食诱导了大鼠胰岛素抵抗模型,发现能量限饲显著降低了大鼠血清甘油三酯和胆固醇含量,与本试验结果基本一致。Wei等[28]选取100名健康志愿者,每个月连续5 d低脂、低能、低糖、低蛋白质、高不饱和脂肪酸饮食,3个循环周期,发现受试者的空腹血清葡萄糖、甘油三酯、低密度脂蛋白胆固醇含量降低,高密度脂蛋白胆固醇含量则无显著变化。由此可以推测,能量限饲改善了机体的脂类代谢,减少了体脂沉积。
3.3 能量限饲对肉鸡外周血T淋巴细胞亚群的影响
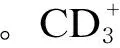
3.4 能量限饲对肉鸡免疫器官指数的影响
鸡的免疫过程主要通过脾脏、胸腺、法氏囊来介导,因此免疫器官的发育程度直接影响鸡的免疫应答,所以促进免疫器官的发育对提高其免疫力至关重要。鸡的免疫力强弱,在一定程度上可通过免疫器官的相对重量即免疫器官指数来反映。免疫器官指数的大小和机体免疫系统的执行能力成正比,因此免疫器官指数的增加或降低意味着免疫功能的变化[36]。28日龄前是免疫器官发育的关键阶段,这个时期是增强肉鸡免疫功能和对疾病抵抗力的关键时期[37]。
本试验结果表明,30%能量限饲显著增加了28日龄时肉鸡的法氏囊指数,对胸腺指数和脾脏指数无显著影响;30%能量限饲显著增加了42日龄时的脾脏指数,对法氏囊指数和胸腺指数无显著影响。这与Chen等[38]报道的30%能量限饲可增加肉鸡的脾脏和法氏囊相对重量的结果相一致。刘路路[39]研究显示,15%能量限饲显著增加了三黄鸡的脾脏指数。张书汁[40]研究认为,与自由采食相比,30%能量限饲极显著增加了肉鸡的脾脏指数。本试验中,能量限饲增加了肉鸡的免疫器官指数的结果与前人的研究结果相一致。这说明能量限饲能够在一定程度上促进免疫器官的发育。
4 结 论
① 能量限饲在一定程度上降低了肉鸡的生长性能,限饲的比例越大对生长性能的影响也越大。
② 能量限饲增加了肉鸡血清IgM、IgA和IgG含量,降低了血清甘油三酯、总胆固醇及高密度脂蛋白胆固醇含量。
④ 30%能量限饲增加了肉鸡28日龄时的法氏囊指数和42日龄时的脾脏指数。
[1] BOEKHOLT H A,VAN DER GRINTEN P,SCHREURS V V A M,et al.Effect of dietary energy restriction on retention of protein,fat and energy in broiler chickens[J].British Poultry Science,1994,35(4):603-614.
[2] ROBINSON F E,CLASSEN H L,HANSON J A,et al.Growth performance,feed efficiency and the incidence of skeletal and metabolic disease in full-fed and feed restricted broiler and roaster chickens[J].The Journal of Applied Poultry Research,1992,1(1):33-41.
[3] YU M W,ROBINSON F E.The application of short-term feed restriction to broiler chicken production:a review[J].The Journal of Applied Poultry Research,1992,1(1):147-153.
[4] BAGHBANZADEH A,DECUYPERE E.Ascites syndrome in broilers:physiological and nutritional perspectives[J].Avian Pathology,2008,37(2):117-126.
[5] CHAMBERS J R,GAVORA J S,FORTIN A.Genetic changes in meat type chickens in the last twenty years[J].Canadian Journal of Animal Science,1981,61(3):555-563.
[6] INGRAM D K,CUTLER R G,WEINDRUCH R,et al.Dietary restriction and aging:the initiation of a primate study[J].Journal of Gerontology,1990,45(5):B148-B163.
[7] 潘家强,李锦春,谭勋,等.早期限饲对肉鸡免疫器官发育和体液免疫功能的影响[J].中国兽医学报,2005,25(5):527-529.
[8] RICHARDS M P,POCH S M,COON C N,et al.Feed restriction significantly alters lipogenic gene expression in broiler breeder chickens[J].The Journal of Nutrition,2003,133(3):707-715.
[9] 徐良梅,路磊,张慧,等.肉种鸡产蛋中期能量限饲对子代肉鸡生长性能、血液生化指标及肌节长度的影响[J].东北农业大学学报,2012,43(6):21-26.
[10] 李金锋,徐良梅,张艳云,等.肉种鸡饲粮能量水平对产蛋后期子代生产性能和脂类代谢的影响[J].中国畜牧杂志,2014,50(3):39-43.
[11] MATHIS D,SHOELSON S E.Immunometabolism:an emerging frontier[J].Nature Reviews Immunology,2011,11(2):81-83.
[12] HOTAMISLIGIL G S.Inflammation,metaflammation and immunometabolic disorders[J].Nature,2017,542(7640):177-185.
[13] MOST J,TOSTI V,REDMAN L M,et al.Calorie restriction in humans:an update[J].Ageing Research Reviews,2017,39:36-45.
[14] FONTANA L,PARTRIDGE L.Promoting health and longevity through diet:from model organisms to humans[J].Cell,2015,161(1):106-118.
[15] 赵高.能量限制对肉鸡脂肪沉积效应研究及鸡Lipin1基因的克隆分析[D].硕士学位论文.郑州:河南农业大学,2008:10-14.
[16] URDANETA-RINCON M,LEESON S.Quantitative and qualitative feed restriction on growth characteristics of male broiler chickens[J].Poultry Science,2002,81(5):679-688.
[17] SALEH E A,WATKINS S E,WALDROUP A L,et al.Effects of early quantitative feed restriction on live performance and carcass composition of male broilers grown for further processing[J].The Journal of Applied Poultry Research,2005,14(1):87-93.
[18] MIAO Z,ZHANG G,ZHANG J,et al.Effect of early dietary energy restriction and phosphorus level on subsequent growth performance,intestinal phosphate transport,and AMPK activity in young broilers[J].PLoS One,2017,12(12):e0186828.
[19] DEATON J W.The effect of early feed restriction on broiler performance[J].Poultry Science,1995,74(8):1280-1286.
[20] 徐德立,徐来祥.食物限制对黑线仓鼠免疫功能的影响[J].生态学报,2015,35(6):1882-1890.
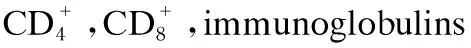
[22] EBERSOLE J L,STEFFEN M J,REYNOLDS M A,et al.Differential gender effects of a reduced-calorie diet on systemic inflammatory and immune parameters in nonhuman primates[J].Journal of Periodontal Research,2008,43(5):500-507.
[23] LARA-PADILLA E,CAMPOS-RODRGUEZ R,JARILLO-LUNA A,et al.Caloric restriction reduces IgA levels and modifies cytokine mRNA expression in mouse small intestine[J].The Journal of Nutritional Biochemistry,2011,22(6):560-566.
[24] WHITEHEAD C C,HOOD R L,HEARD G S,et al.Comparison of plasma very low density lipoproteins and lipogenic enzymes as predictors of fat content and food conversion efficiency in selected lines of broiler chickens[J].British PoultryScience,1984,25(2):277-286.
[25] CAMPOS R L R,NONES K,LEDUR M C,et al.Quantitative trait loci associated with fatness in a broiler-layer cross[J].Animal Genetics,2009,40(5):729-736.
[26] 王佳伟.能量限制对肉仔鸡生产性能以及肝脏基因表达的效应研究[D].硕士学位论文.郑州:河南农业大学,2009:25.
[27] 陈永如.能量限制对大鼠胰岛素抵抗和SIRT1和SIRT4表达的影响[D].硕士学位论文.汕头:汕头大学,2010:21-22.
[28] WEI M,BRANDHORST S,SHELEHCHI M,et al.Fasting-mimicking diet and markers/risk factors for aging,diabetes,cancer,and cardiovascular disease[J] Science Translational Medicine,2017,9(377):eaai8700.
[29] WOLOWCZUK I,VERWAERDE C,VILTART O.Feeding our immune system:impact on metabolism[J].Clinical and Developmental Immunology,2008,2008:639803.
[30] MILNER J J,BECK M A.Micronutrients,immunology and inflammation.The impact of obesity on the immune response to infection[J].Proceedings of the Nutrition Society,2012,71(2):298-306.
[31] 易先国,邓凯伟,李卫,等.家禽CD3分子研究进展[J].动物医学进展,2011,32(2):105-107.
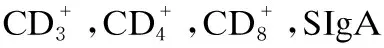
[33] KHAJAVI M,RAHIMI S,HASSAN Z M,et al.Effect of feed restriction early in life on humoral and cellular immunity of two commercial broiler strains under heat stress conditions[J].British Poultry Science,2003,44(3):490-497.
[34] MACINTYRE A N,GERRIETS V A,NICHOLS A G,et al.The glucose transporter Glut1 is selectively essential for CD4T cell activation and effector function[J].Cell Metabolism,2014,20(1):61-72.
[35] SINCLAIR L V,ROLF J,EMSLIE E,et al.Control of amino-acid transport by antigen receptors coordinates the metabolic reprogramming essential for T cell differentiation[J].Nature Immunology,2013,14(5):500-508.
[36] GROSSMAN C J.Interactions between the gonadal steroids and the immune system[J].Science,1985,227(4684):257-261.
[37] 潘家强,孙卫东,谭勋,等.早期限饲对肉鸡体内脂质过氧化作用和抗氧化酶活性的影响[J].畜牧兽医学报,2005,36(5):464-470.
[38] CHEN W,GUO Y M,HUANG Y Q,et al.Effect of energy restriction on growth,slaughter performance,serum biochemical parameters andLpin2/WDTC1/mRNA expression of broilers in the later phase[J].The Journal of Poultry Science,2012,49(1):12-19.
[39] 刘路路.能量限制对三黄鸡生长性能、免疫特性及脾脏基因表达的影响[D].硕士学位论文.郑州:河南农业大学,2016:20-21.
[40] 张书汁.能量限制对肉鸡肠道结构及血液生化指标的影响[D].硕士学位论文.郑州:河南农业大学,2009:15-16.

