液相色谱串联质谱法测定动物源性食品中喹乙醇代谢物残留量的不确定度分析
罗媛媛,万伟杰,胡丽芳
(江西省农业科学院 农产品质量安全重点实验室/江西省农业科学院 农产品质量安全与标准研究所,江西 南昌 330200)
喹乙醇(Olaquindox)又名喹酰胺醇,是一种具有促生长和广谱抗菌作用的饲料添加剂[1]。喹乙醇的性质不稳定,在动物体内会迅速代谢,其中3-甲基喹噁啉-2-羧酸(MQCA)是代谢最主要的产物之一,被认定为指示残留标识物。目前,测定喹乙醇代谢物的方法主要有胶体金免疫层析法[4]、液相色谱法[5-8]和液相色谱串联质谱法[9-13],而有关喹乙醇代谢物测定的不确定度评定只有一篇水产品的文献[14],未见饲料中喹乙醇代谢物测定的不确定度评定研究。
2016年5月31日发布的正式版《检验检测机构资质认定评审准则》要求检验检测机构要建立和保持应用评定测量不确定度的程序。测量不确定度能对检测数据进行客观真实的评价,给出测量结果的可信程度[15]。本文通过对SN/T 0197─2014《出口动物源性食品中喹乙醇代谢物残留量的测定 液相色谱-质谱/质谱法》[16]进行动物源性食品中喹乙醇代谢物残留检测的不确定度评定,希望为实验室质量控制(如产品质量临界值时的判定)提供可靠依据,同时为检测其他产品中喹乙醇代谢物残留量的不确定度提供参考,评定方法参照JJF 1135─2005《化学分析测量不确定度评定》[17]和JJF 1059.1─2012《测量不确定度评定与表示》[18]。
1 实验部分
1.1 试剂和材料
标准品:3-甲基喹噁啉-2-羧酸,氘代3-甲基喹噁啉-2-羧酸甲酯(MQCA_D7)(Sigma公司),纯度为(99.00±0.02)%;甲醇、乙腈、甲酸均为色谱纯;其他为分析纯。
1.2 主要仪器和设备
液相色谱-质谱/质谱仪(配有电喷雾离子源)Agilent1290-6460 triple quad;氮吹仪(英国PEAK毕克气体氮吹仪);日本日立CR22G Ⅲ型高速冷冻离心机;电子天平(瑞士Mettler Toledo公司);旋涡混合器MJ-U007;美国色谱科真空固相萃取装置;pH计(瑞士Mettler Toledo公司);均质器:转速大于10000 r/min。
1.3 测试过程
1.3.1 前处理方法 称取5.00 g样品于50 mL离心管中,加入8 mL蛋白复合体溶液,混匀后加入0.3 mL 0.01 g/mL溶液混匀,放置于空气浴摇床中(47±3) ℃酶解16 h。酶解后的样品溶液放至常温,加入20 mL 0.3 moL/L盐酸溶液,混匀后15000 r/min离心5 min,吸取上清液加入10 mL正己烷涡旋混匀,5000 r/min离心5 min,弃去上层液保留下层液,下层液移入混合型阴离子交换固相萃取柱中,全部样液流出后用10 mL乙酸钠甲醇溶液淋洗,溶液全部流出后抽干。依次用6 mL水﹑6 mL 1 mmoL/L氨水-甲醇(v/v=4∶1)溶液和6 mL甲醇淋洗,抽干,最后用3 mL 2%甲酸乙酸乙酯洗脱液(接液),加入100L内标,浓缩至干。加入1.00 mL 0.1%甲酸-甲醇(v/v=9∶1)溶液溶解残渣供液相色谱-串联质谱仪测定。
1.3.2 标准溶液配制标准储备溶液 标准储备溶液:准确称取标准品适量用甲醇定容,并配制为浓度为1.0 mg/mL的标准储备溶液,于-20 ℃冰箱保存。
标准中间液:用1 mL单标线吸量管吸取储备液1 mL,用甲醇溶解,并定容至10 mL,浓度为100g/mL。
标准工作溶液:根据需要逐级稀释标准中间,配制成浓度为20.0 ng/mL标准工作溶液,现用现配。
内标储备液:称取内标标准品,用甲醇溶解,并配制成浓度约为100 mg/L的内标储备液,于-20 ℃冰箱保存。
内标工作液:根据需要逐级稀释内标标准储备溶液(4),配制成浓度为0.1 mg/L的内标工作溶液,现用现配。
标准储备溶液:准确称取10.1 mg标准品,用甲醇溶解定容至10.0 mL,配制成浓度为1000 mg/L的标准储备溶液,于-20 ℃冰箱保存。
标准中间液:用1 mL单标线吸量管吸取储备液1 mL,用甲醇溶解并定容至10 mL,浓度为100g/mL。
标准工作溶液:根据需要逐级稀释标准中间,配制成浓度为20.0 ng/mL标准工作溶液,现用现配。
基质提取液:空白样品,除不加内标外,其他操作同1.3.1处理后得到的溶液。
基质标准工作液:分别吸取0、25、50、100、200、500L标准工作液,加入100L内标工作液,用样品空白提取液定容至1.0 mL,分别配成0、0.5、1.0、2.0、4.0、10.0 ng/mL浓度系列基质标准工作溶液(表1)。
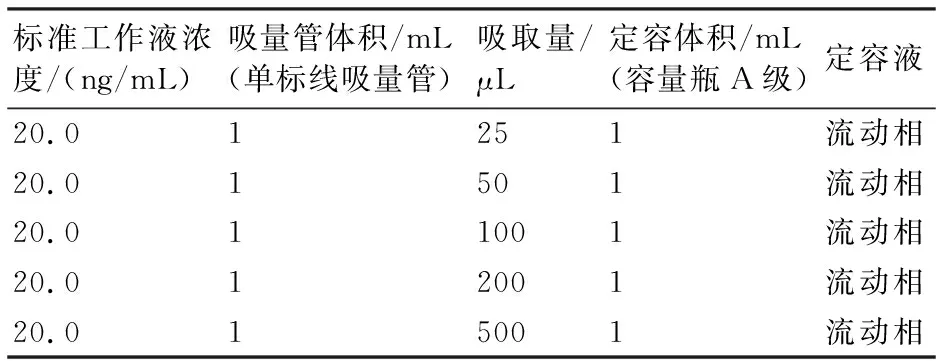
表1 标准工作液的配制
1.3.3 色谱条件 色谱柱:C18柱,2.6 μm,100 mm×3.0 mm(内径),或相当;流动相:A相0.1%甲酸水溶液、B相0.1%甲酸甲醇溶液,流速:0.2 mL/min;柱温:40 ℃;进样量:5L梯度洗脱条件见表2。

表2 5 μL梯度洗脱条件
1.3.4 质谱条件 离子化模式:电喷雾电离源正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);毛细管电压:3500 V;离子源温度(TEM):325 ℃;干燥气温度:300 ℃;干燥气流量:5 L/min;雾化气压力:400 psi;鞘气温度:400 ℃;鞘气流量:12 L/min。其他参考质谱条件见表3。
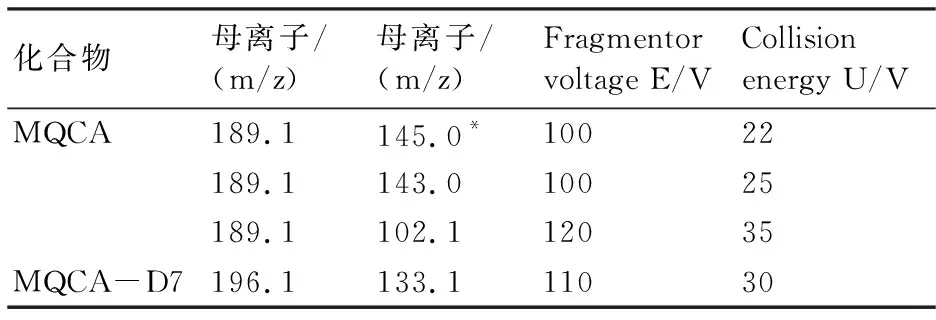
表3 其他参考质谱条件
注:*为定量离子。
1.4 建立数学模型
其中,X:试样中喹乙醇代谢物的含量(g/kg);C:从标准曲线得到的喹乙醇代谢物的浓度(g/mL);V:样品最终定容体积(mL);m:样品质量(g)。
2 结果与分析
2.1 不确定度来源分析
从以上方法可以看出,样品中喹乙醇代谢物测定结果不确定度的主要来源于待测物浓度、测量重复性、回收率、试样称量、试样定容。
2.2 不确定度分量的评定
2.2.1 待测物浓度引入的不确定度 待测物浓度分为标样的配制和标准曲线拟合2个部分。标准液的配制包括储备液的配制、稀释、标准曲线溶液的配制3个步骤。
(1)储备液配制过程产生的不确定度u(C-1)



由储备液配制所产生的相对标准不确定度:
(2)储备液稀释过程产生的相对标准不确定度urel(C-2)
储备液稀释过程见1.3.2,稀释储备液引入的不确定度见表4。

表4 储备液稀释过程中引入的不确定度
则稀释储备液引入的相对标准不确定度为:
(3)标准曲线配制过程产生的相对标准不确定度urel(C-3)
标准溶液配制过程见表1,配制标准系列工作液引入的不确定度见表5。
则配制标准系列溶液产生的相对标准不确定度:
(4)拟合标准工作曲线引入的相对标准不确定度urel(C-4)
分别取5种不同浓度的标准系列溶液重复测定3次,得到对应峰面积A的平均值,拟合成线性回归方程为A=aC+b(a为截距,b为斜率),结果见表6所示。取一阳性样品,进行3次重复测定,得出平均质量浓度C0,其测定结果见表7。则由标准曲线拟合产生的不确定度计算过程如下:


表5 标准系列溶液配制过程引入的不确定度

表6 标准曲线测定结果和不确定度计算
则待测物浓度C引入的相对标准不确定度:

表7 阳性样品检测数据

表8 重复测定结果和不确定度计算
重复性引入的不确定度按下列公式计算:
则测量重复性产生的不确定度:
2.2.3 回收率产生的不确定度u(R) 在空白猪肉、牛肉、鸡肉、鱼肉试样中各添加0.7g/kg的喹乙醇代谢物标准溶液,平行测定6次。回收率结果如表9所示。
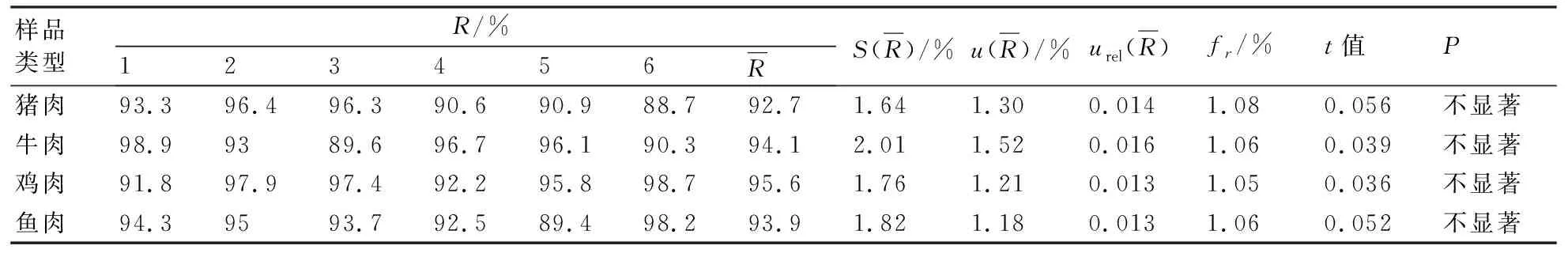
表9 动物源性食品中喹乙醇代谢物加标回收率测定结果和不确定度计算
回收率引入的不确定度按下列公式计算:
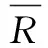
则回收率产生的不确定度
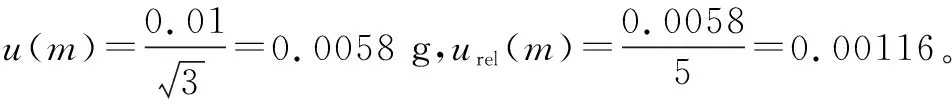
2.2.5 待测液定容产生的不确定度u(V) 样品经酶解、净化、氮气吹干后用分度吸量管移取1.0 mL流动相溶解残物,则不确定度计算如下:
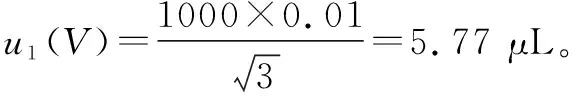
(2)温差引入的不确定度:水的体积膨胀系数为2.10×10-4/℃,实验室室温在±3 ℃之间变动,根据均匀分布进行B类不确定度评定,则温差引入的不确定度为:
2.3 合成不确定度
综上所述,则加标动物源性食品样品中喹乙醇代谢物测定结果合成不确定度计算如下:
=0.077
2.4 扩展不确定度及结果表示
3 结论
本文通过对标准溶液配制、样品测量重复性、目标化合物回收率、样品称量、待测液定容等因素的考虑,发现按SN/T 0197─2014出口动物源性食品中喹乙醇代谢物残留量的测定方法中,测量重复性和回收率所引入的不确定度最大,其次为标准曲线拟合,样品称量和待测液定容引起的不确定度可忽略不计。因此,在实际检测中,可通过增加测定样品平行样和标准系列溶液的次数、保证仪器较高的灵敏度和稳定性、提高检测人员的检测技术来降低测量不确定度,从而使检测结果更加准确可靠。
参考文献:
[1] 胡新岗,方希修,黄银云,等.喹乙醇饲料添加剂应用研究进展[J].动物科学与动物医学,2001,19(5):64-65.
[2] Johnston A M. Evaluation of certain veterinary drug residues in food[J]. Food Control, 1992, 3(4): 220.
[3] Collins T F, Keeler H V, Black T N, et al. Long-term effects of dietary amaranth in ratsⅠ effects on reproduction[J]. Toxicology, 1975, 3(1): 115-128.
[4] 霍如林,朱爱荣,张林,等.胶体金免疫层析法快速检测动物组织中残留的喹乙醇[J].食品工业科技,2014,35(21):297-300.
[5] 贝亦江,王扬,何丰,等.高效液相色谱法测定水产品中喹乙醇代谢物残留量[J].食品科学,2013,34(10):255-258.
[6] 张惠峰,闫先春,甄昕.利用不确定度评定对改进后水产品中喹乙醇的检测方法进行确证研究[J].渔业研究,2016,38(3):244-253.
[7] 赵冬艳,胡冬冬,余伟伟.分子印迹固相萃取-高效液相色谱联用检测饲料中喹乙醇的研究[J].粮食与饲料工业,2016,12(1):72-75.
[8] 倪竹南,谭莹,于村,等.高效液相色谱法快速检测肉类食品中喹乙醇残留[J].中国卫生检验杂志,2014,24(15):2144-2145.
[9] 刘正才,杨方,余孔捷,等.高效液相色谱-质谱联用法测定动物源食品中喹乙醇代谢物残留量[J].食品科学,2012,33(12):210-214.
[10] 林黎,谢丽琪,欧阳姗,等.高效液相色谱-质谱联用法测定牛奶和奶粉中卡巴氧和喹乙醇代谢物的残留量[J].分析实验室,2010,29(2):38-41.
[11] 梅光明,郑斌,陈雪昌,等.超高效液相色谱-质谱联用法测定水产品中喹乙醇代谢物残留量[J].浙江海洋学院学报:自然科学版,2010,29(3):254-259.
[12] 欧阳姗,庞国芳,谢丽琪,等.动物组织中卡巴氧和喹乙醇以及相关代谢产物的液相色谱-串联质谱检测方法[J].分析测试学报,2008,27(6):590-594.
[13] 薛良辰,彭玉芬,刘陆,等.超高效液相色谱-串联质谱法快速检测水产品中喹乙醇及其代谢物3-甲基-喹噁啉-2-羟酸的残留[J].现代食品科技,2013,29(2):413-415.
[14] 杨一微.HPLC法测定水产品中喹乙醇代谢物3-甲基喹噁啉-2-羧酸结果不确定度的评价[J].辽宁医学院学报,2013,34(2):75-76.
[15] 国家质量技术监督局计量司组.测量不确定度评定与表示指南[M].北京:中国计量出版社,2005:1-25.
[16] 国家质量监督检验检疫总局.SN/T 0197─2014出口动物源性食品中喹乙醇代谢物残留量的测定 液相色谱-质谱/质谱法[S].北京:中国计量出版社,2014.
[17] 国家质量监督检验检疫总局.JJF 1135─2005化学分析测量不确定度评定[S].北京:中国计量出版社,2005.
[18] 国家质量技术监督局.JJF 1059.1─2012测量不确定度评定与表示[S].北京:中国计量出版社,2012.
[19] 国家质量监督检验检疫总局.JJG 196─2006常用玻璃量器检定规程[S].北京:中国计量出版社,2006.
[20] 国家质量技术监督局.JJG 646─2006移液器检定规程[S].北京:中国计量出版社,2006.

