小麦 TaPLC1基因与耐热的相关性研究
姚晓露,杨明明,高 翔,2,董 剑,赵万春,张炳慧,王卫东,何庆梦
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.陕西省小麦新品种培育工程研究中心,陕西杨凌 712100)
小麦(TriticumaestivumL.)属于喜凉作物,在生长季内热胁迫会对产量造成影响[1]。据调查,未来平均气温每升高1 ℃,全球小麦将减产6%,而且温度的升高会对小麦的一些生理指标产生影响[2]。作为仅次于水稻的第二大粮食作物,小麦减产会增加粮食安全的风险[3]。作为磷脂酶家族重要的成员,磷酸肌醇特异性磷脂酶C(phosphoinositide-specific PLC,简称PI-PLC)在植物生长发育过程中起到重要作用,参与多种环境胁迫应答[4]。PI-PLC的结构虽然简单,但在植物中的功能却复杂多样。在玉米中, ZmPLC1通过促进细胞的不对称分裂对植株的发育进行调控[5]。在油菜中,过表达 BnPLC2基因可以加速植株生长、提高粒重及油含量[6]。Djafi等[7]发现PI-PLC抑制剂能够抑制植酸的合成,而植酸通路在籽粒发育中非常重要,涉及营养物质的运输。Zhang等[4]对小麦幼苗研究发现,外源施加PI-PLC的抑制剂U73122和Edelfosinec能够抑制幼苗生长,并且增强了幼苗对干旱和盐胁迫的敏感性。Aggarwal等[8-9]发现用脱落酸(ABA)处理小麦籽粒后, TaPLC1基因以及部分植酸通路基因的表达量显著增加,由此可知,激素可能参与PI-PLC对植物生长发育过程中的调控作用。
PI-PLC水解磷脂酰肌醇4,5-二磷酸生成两个重要的信号分子肌醇三磷酸(IP3)和甘油二醇(DAG),进而参与植物的生长发育[10]。PI-PLC一直被认为是胁迫诱导激活的酶[11],U73122被认为是专一的PI-PLC抑制剂,广泛地用于植物PI-PLC的功能研究[12]。热胁迫时,U73122阻止IP3的积累,IP3影响了Ca2+释放,而Ca2+参与植物非生物胁迫[如盐胁迫、干旱胁迫(正)、冷胁迫(负)]的调控[10,13-15]。已有证据表明小麦中TaPLC基因参与非生物胁迫的应答反应[16],影响小麦苗期的抗旱性、耐盐性和耐冷性[4,17]。在拟南芥中,PI-PLC参与热胁迫调节[18]。本研究选取热敏感型及耐热型小麦材料,并用U73122进行处理,分析小麦 TaPLC1基因与耐热的相关性,以期为解析小麦的耐热性机制奠定基础。
1 材料与方法
1.1 供试材料
供试材料为普通小麦品种中国春和TAM107,中国春为热敏感型品种,TAM107为耐热型品种,均由西北农林科技大学农学院品质改良实验室提供。
1.2 材料处理
选取成熟饱满大小均匀一致的中国春和TAM107种子,首先用75%的酒精消毒1 min,无菌水冲洗3次;随后用5% NaClO消毒10 min,无菌水冲洗4~5次,于灭菌水中浸泡24 h 后将种子移种到铺有3层滤纸的培养血上,每皿30粒种子,萌发前保持滤纸湿润,待幼苗的根能够固着在滤纸上后,使用霍格兰氏营养液进行培养,每3 d更换一次培养液。培养温度为 24 ℃/18 ℃(光照14 h/黑暗10 h)。
处理如下,(1)一叶一心时期,用15 μmol·L-1PI-PLC抑制剂U73122浸泡根部4 h,两叶一心期在40 ℃条件下进行热胁迫处理;(2)两叶一心期在40 ℃条件下进行热胁迫处理;(3)不进行抑制剂和热胁迫处理(CK)。各处理均设3个重复,分别在热胁迫0 min、15 min、30 min、1 h、2 h和4 h 取各处理的幼苗叶片,并迅速放入液氮中速冻,然后于-80 ℃ 冰箱保存。将热处理4 h的幼苗转入24 ℃/18 ℃(光照/黑暗)条件下继续培养,观察记录幼苗的生长情况。
1.3 生理指标的测定
热胁迫处理4 h的材料用于测定生理指标。叶片超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定,可溶性糖含量采用蒽酮法测定,叶绿素含量采用Arnon法测定,每个样品设置三个生物学重复[19-20]。用 Excel 2016 和 SPSS 20 软件进行数据分析。
1.4 TaPLC1基因的表达分析
1.4.1 RNA提取及cDNA合成
采用Trizol法从中国春和TAM107正常生长及处理后幼苗的叶中提取RNA,使用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser合成cDNA第一链,-20 ℃保存备用。
1.4.2 引物设计与qRT-PCR
根据 TaPLC1基因的cDNA序列,利用 Primer Premier 5.0设计实时定量PCR(Quantitative Real-time PCR,qRT-PCR)引物,正向引物为5′-GGGCACTCGGGTTACTTC-3′,反向引物为5′-GTAGCCACAGCCACCATT-3′。在18S RNA上设计的引物 T-18S-F/R作为内参,其正向和反向引物序列分别为5′-GCATTTGCCAAGGAT GTTTTC-3′和5′-TGCTATGTCTGGACCTG GTAAGT-3′。引物由北京奥科鼎盛生物科技有限公司合成。
以cDNA为模板,用上述合成引物,在QuantStudio 3实时荧光定量PCR仪上进行 qRT-PCR分析。qRT-PCR反应总体系20 μL:SYBR Premix ExTaqⅡ 10 μL,10 μmol·L-1引物各1 μL,cDNA模板 2 μL,灭菌ddH2O加至20 μL。扩增程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 31 s,40个循环。每个样品设置3个生物学重复。采用 2-ΔΔCT法[21]分析实验数据,确定基因的相对表达水平。
2 结果与分析
2.1 热胁迫和PI-PLC抑制剂对小麦苗期生理指标的影响
两个品种热胁迫4 h时的叶片生理指标测定结果如表1所示。相对于正常幼苗,热敏感型品种中国春和耐热型品种TAM107的叶片在热胁迫后MDA含量、SOD含量和可溶性糖含量不同程度增加,叶绿素含量下降。热胁迫下,以单独热胁迫幼苗为对照,抑制剂处理后中国春和耐热型品种TAM107叶片丙二醛含量、SOD含量和可溶性糖含量与对照相比均有不同程度的增加,叶绿素含量不同程度降低。从表1生理指标整体变化趋势可以看出,热胁迫下,抑制剂处理后中国春的生理指标相对于TAM107 变化更大。
这些生理指标的变化说明,抑制剂处理后两品种对热胁迫均更敏感,PI-PLC抑制剂影响幼苗的耐热性,对热敏感型品种影响更大。
2.2 热胁迫和PI-PLC抑制剂对小麦幼苗表型的影响
两叶一心期观察幼苗表型,进行热胁迫处理,并记录胁迫前后的变化,结果如图1所示。处理前幼苗长势一致、较好,热胁迫处理4 h时中国春发生萎蔫,TAM107轻微萎蔫,处理后12 h均恢复正常。一叶一心期进行过抑制剂处理的两个品种,在热胁迫处理4 h后的第2天,幼苗叶尖出现轻微枯萎变黄现象,处理后第5天严重枯萎,叶片开始卷曲。
2.3 热胁迫下 TaPLC1基因的表达特性分析
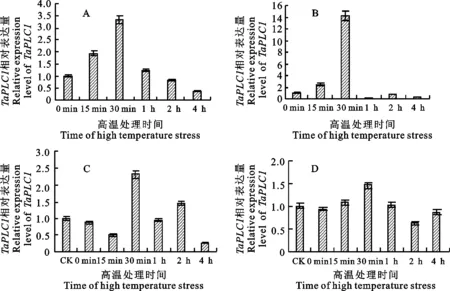
以获得的RNA为模板进行反转录,采用qRT-PCR引物进行荧光定量PCR,测定 TaPLC1基因在两个品种(中国春和TAM107)两叶一心期不同热胁迫处理时间的表达并分析品种之间的差异。由图2可知,以正常植株的叶片作对照,在热胁迫过程中,未经抑制剂处理的中国春叶片中 TaPLC1基因的表达量先上升,在30 min达到最大值,为起始值的3.3倍,之后开始下降;未经抑制剂处理的TAM107叶片中 TaPLC1基因的表达量先上升,在30 min达到最大值,数值为起始值的14.3倍,之后开始大幅度下降,在1 h达到最小值,数值为起始值的17%,之后开始上升,在2 h达到起始值的72%,之后再次下降。抑制剂处理后,中国春叶片中 TaPLC1基因的表达量在热胁迫过程中先下降,15 min之后开始上升,30 min达到最大值,为起始值的2.3倍,之后又下降,整体呈现下降-上升-下降-上升-下降的趋势;TAM107叶片中 TaPLC1基因的表达量先上升,在30 min达到最大值,为起始值的1.4倍,之后开始下降,2 h达到最小值,为起始值的61%,之后又上升。未经抑制剂处理、热胁迫条件下, TaPLC1基因在两个品种中的表达均迅速上调,并在30 min处达到最大值, TaPLC1基因在耐热型小麦品种TAM107中的表达上调幅度明显大于中国春。抑制剂处理后,热胁迫时 TaPLC1基因在两个品种中的表达模式不同,耐热型小麦品种TAM107中的上调幅度较小,响应热胁迫的程度不明显;中国春在热胁迫15 min内未及时响应,但之后迅速响应,在30 min处达到最大值,与未经抑制剂处理幼苗变化幅度差异不明显。
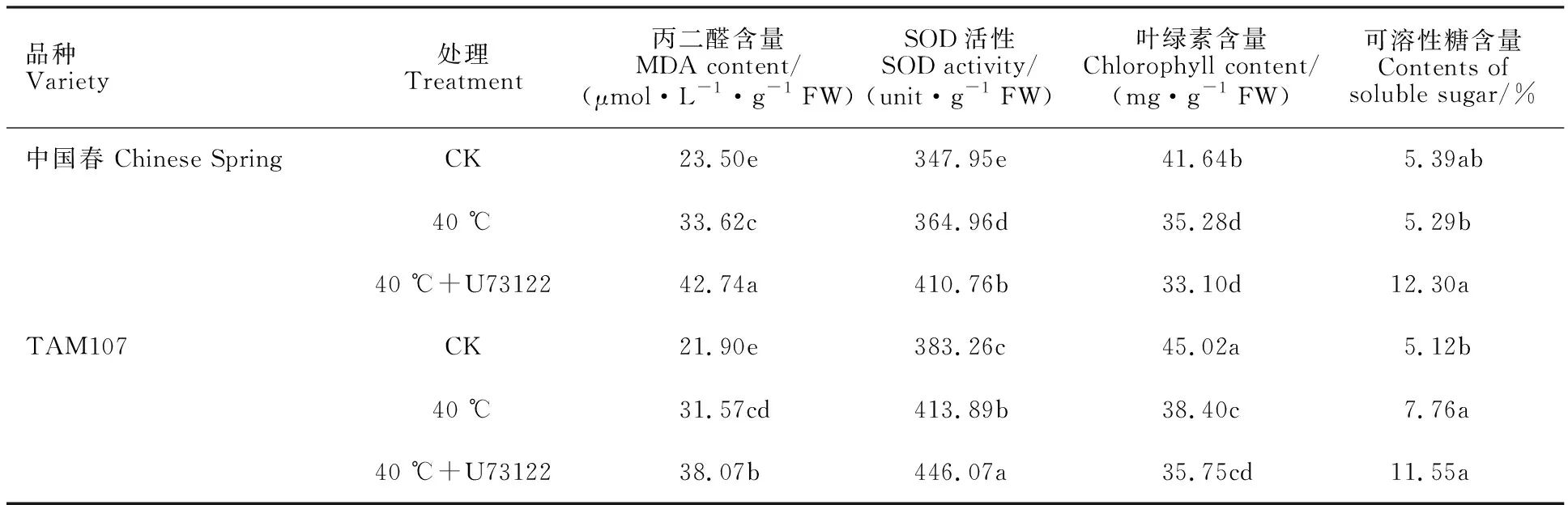
表1 PI-PLC抑制剂处理的幼苗在热胁迫4 h后的相关生理指标Table 1 Relevant parameters of seedlings treated with PI-PLC inhibitors under heat stress for 4 h
CK:未经热胁迫及抑制剂处理的幼苗;40 ℃:40 ℃热胁迫处理4 h;U73122:抑制剂U73122处理;同一列数据后的不同字母表示处理间在0.05水平上差异显著。
CK:Seedlings untreated with heat stress and inhibitors; 40 ℃:40 ℃ heat treatment for 4 h;U73122:U73122 inhibitor treatment;Different letters following data in same column indicates significant difference between treatments at 0.05 level.

A:热胁迫前;B:热胁迫4 h;C:热胁迫4 h后的第2天;D:热胁迫4 h后的第5天。
A:Before heat stress;B:Heat stress for 4 h;C:The second day after heat stress for 4 h;D:The 5th day after heat stress for 4 h.
图1PI-PLC抑制剂处理后小麦幼苗对热胁迫的反应
Fig.1ResponseofwheatseedlingstoheatstressaftertreatedwithPI-PLCinhibitors
对比抑制剂处理和未处理幼苗中的基因表达情况,发现U73122在一定程度上抑制了幼苗中 TaPLC1基因的表达(图2),40 ℃热胁迫4 h后停止胁迫,未经抑制剂处理的幼苗均恢复正常,而 U73122处理的幼苗受到损伤(图1),说明 TaPLC1基因表达被抑制后幼苗对热胁迫的敏感性增加,也说明 TaPLC1可能参与了小麦幼苗的耐热调控过程。
A:未经抑制剂处理的中国春;B:未经抑制剂处理的TAM107;C:经抑制剂处理的中国春;D:经抑制剂处理的TAM107;CK:未经热胁迫及抑制剂处理的幼苗。
A:Chinese Spring untreated with inhibitor; B:TAM107 untreated with inhibitor; C:Chinese Spring treated with inhibitor; D:TAM107 treated with inhibitor; CK:Seedlings untreated with heat stress and inhibitors.
图2TaPLC1在40℃热胁迫下的表达模式
Fig.2ExpressionpatternsofTaPLC1under40℃heatstress
3 讨 论
MDA是膜脂过氧化的重要产物之一,发生膜脂过氧化作用时[22],会产生较高含量的MDA[23]。热胁迫时,热敏感基因型品种较耐热型品种MDA含量增加较多[24]。植物体内的内源保护系统由酶和非酶组成[25],SOD是一种源于生命体的活性物质,植物通过自身调节机制提高SOD活性以适应热胁迫,若长时间遭受热胁迫,SOD活性下降,则会加剧膜脂过氧化作用,引起膜损伤[26],耐热型小麦品种的SOD活性较高[27-30]。叶绿素是一类与光合作用有关的重要色素,热胁迫会加速叶绿素降解,含量下降,在黑麦和小麦中已经得到证实[31-33]。可溶性糖是渗透调节物质,胁迫条件下植物的渗透调节功能与可溶性糖的积累有关[34],在逆境下可溶性糖含量升高有利于植物体对抵抗逆境胁迫,从而在一定程度上可增强生物体对环境胁迫的适应性[26]。本试验中抑制剂处理后两种类型小麦品种的叶片MDA含量均显著升高,说明抑制剂处理后的幼苗叶片发生了更严重的膜脂过氧化作用,而SOD的活性也均显著升高,说明抑制剂处理后幼苗需要更高的SOD活性来应对热胁迫;叶绿素含量均显著下降,在5 d后叶片变黄不再恢复,并且抑制剂处理使小麦需要更多的可溶性糖来抵抗高温,说明抑制剂处理后小麦的耐热性下降。以上结果与前人的研究一致。而抑制剂处理后中国春MDA含量、SOD活性以及可溶性糖含量变化幅度均大于TAM107,叶绿素含量则相差不多,说明PI-PLC可能参与了小麦热胁迫应答反应,并且中国春较TAM107更加敏感。
研究表明,PI-PLC是通过水解产生IP3和DAG来参与植物生长发育的,热激使成纤维细胞PI-PLC降解生成IP3[35],IP3快速上升,而IP3伴随着Ca2+的增加而增加[36]。热激诱导人类表皮癌细胞A-431中IP3的水平增加,但U73122阻止热激引起的IP3增加[37]。本研究表明,小麦受到热胁迫时 TaPLC1迅速增加以应对热胁迫,同时U73122处理过的幼苗 TaPLC1增加幅度变小。TAM107中该基因表达增加的幅度明显变小,可能与其较强的耐热性有关;而中国春中该基因表达增加的幅度变小不明显,可能与其热敏感性有关。抑制剂处理后幼苗的表型,受损比较严重,进一步说明了 TaPLC1基因在热胁迫应答中的重要作用。TAM107的耐热性较强极有可能与 TaPLC1的高表达有关, TaPLC1基因参与小麦耐热性的具体机制有待于进一步研究。
参考文献:
[1] 郭洪雪.高温胁迫对小麦几个生理生化指标及热激蛋白的影响[D].青岛:青岛农业大学,2007:11.
GUO H X.The influence of high temprature on several physiological and biochemical indexes and heat shock proteins of wheat [D].Qingdao:Qingdao Agricultural University,2007:11.
[2] MISHRA D,SHEKHAR S,AGRAWAL L,etal.Cultivar-specific high temperature stress responses in bread wheat(TriticumaestivumL.) associated with physicochemical traits and defense pathways [J].FoodChemistry,2017,221(4):1077.
[3] BITA C E,GERATS T.Plant tolerance to high temperature in a changing environment:Scientific fundamentals and production of heat stress-tolerant crops [J].FrontiersinPlantScience,2013,4(4):273.
[4] ZHANG K,JIN C,WU L,etal.Expression analysis of a stress-related phosphoinositide-specific phospholipase C gene in wheat(TriticumaestivumL.) [J].PloSOne,2014,9(8):e105061.
[5] APOSTOLAKOS P,PANTERIS E B.The involvement of phospholipases C and D in the asymmetric division of subsidiary cell mother cells ofZeamays[J].Cytoskeleton,2008,65(11):863.
[6] GEORGES F,DAS S,RAY H,etal.Over-expression ofBrassicanapusphosphatidylinositol-phospholipase C2 in canola induces significant changes in gene expression and phytohormone distribution patterns,enhances drought tolerance and promotes early flowering and maturation [J].PlantCell&Environment,2009,32(12):1664.
[7] DJAFI N,VERGNOLLE C,CANTREL C,etal.TheArabidopsisDREB2 genetic pathway is constitutively repressed by basal phosphoinositide-dependent phospholipase C coupled to diacylglycerol kinase [J].FrontiersinPlantScience,2013,4(10):307.
[8] BHATI K K,AGGARWAL S,SHARMA S,etal.Differential expression of structural genes for the late phase of phytic acid biosynthesis in developing seeds of wheat(TriticumaestivumL.) [J].PlantScience,2014,224(13):74.
[9] SIPLA A,VISHNU S,KUMAR B K,etal.Hormonal regulation and expression profiles of wheat genes involved during phytic acid biosynthesis pathway [J].Plants,2015,4(2):298.
[10] RUPWATE S D,RAJASEKHARAN R.Plant phosphoinositide-specific phospholipase C:An insight [J].PlantSignaling&Behavior,2012,7(10):1281.
[11] LIU P,XU Z S,PANPAN L,etal.A wheat PI4K gene whose product possesses threonine autophophorylation activity confers tolerance to drought and salt inArabidopsis[J].JournalofExperimentalBotany,2013,64(10):2915.
[12] WONG R,FABIAN L,FORER A,etal.Phospholipase C and myosin light chain kinase inhibition define a common step in actin regulation during cytokinesis [J].BMCCellBiology,2007,8(1):15.
[13] WANG X.Lipid signaling [J].CurrentOpinioninPlantBiology,2004,7(3):329.
[14] 龚 伟,王伯初.钙离子在植物抵抗非生物胁迫中的作用[J].生命的化学,2011,31(1):107.
GONG W,WANG B C.Effects of calcium on plant resistance in abiotic stress [J].ChemistryofLife,2011,31(1):107.
[15] ALBRECHT V,WEINL S,BLAZEVIC D,etal.The calcium sensor CBL1 integrates plant responses to abiotic stresses [J].PlantJournal,2003,36(4):457.
[16] 张 科. TaPLC1参与小麦对盐和干旱的胁迫应答反应[D].保定:河北农业大学,2014:3.
ZHANG K. TaPLC1 participates in wheat stress response to salt and drought [D].Baoding:Hebei Agricultural University,2014:3.
[17] KHALIL H B,WANG Z,WRIGHT J A,etal.Heterotrimeric Gα subunit from wheat(TriticumaestivumL.),GA3,interacts with the calcium-binding protein,Clo3,and the phosphoinositide-specific phospholipase C,PI-PLC1 [J].PlantMolecularBiology,2011,77(1-2):145.
[18] LIU H T,GAO F,CUI S J,etal.Primary evidence for involvement of IP3 in heat-shock signal transduction inArabidopsis[J].CellResearch,2006,16(4):394.
[19] 张宪政,陈玉凤,王荣富.植物生理学试验技术[M].沈阳:辽宁科学技术出版社,1994:144.
ZHANG X Z,CHEN Y F,WANG R F.Plant physiology test technology [M].Shenyang:Liaoning Science and Technology Press,1994:144.
[20] 汤章城.现代植物生理学实验指南[M].北京:科学出版社,1999:95.
TANG Z C.Modern plant physiology experiment guide [M].Beijing:Science Press,1999:95.
[21] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2ΔΔCTmethod [J].Methods,2001,25(4):402.
[22] SOLIMAN W S,FUJIMORI M,TASE K,etal.Oxidative stress and physiological damage under prolonged heat stress in C3,grass Lolium perenne [J].GrasslandScience,2011,57(2):101.
[23] OKUDA T,SAGISAKA S.Abrupt increase in the level of hydrogen peroxide in leaves of winter wheat is caused by cold treatment [J].PlantPhysiology,1991,97(3):1265.
[24] SAIRAM R K,SRIVASTAVA G C,SAXENA D C.Increased antioxidant activity under elevated temperatures:A mechanism of heat stress tolerance in wheat genotypes [J].BiologiaPlantarum,2000,43(2):245.
[25] WANG S,WANG Z,PING W,etal.Evaluation of wheat freezing resistance based on the responses of the physiological indices to low temperature stress [J].ActaEcologicaSinica,2011,309(2):497.
[26] 郭洪雪,宋希云,燕增文,等.高温胁迫对小麦幼苗几个生理生化指标的影响[J].华北农学报,2007,22(s1):71.
GUO H X,SONG X Y,YAN Z W.Effects of heat stress on several physiological and biochemical indexes of wheat [J].ActaAgronomicaSinica,2007,22(s1):71.
[27] UPADHYAYA A,DAVIS T D,LARSEN M H,etal.Uniconazole-induced thermotolerance in soybean seedling root tissue [J].PhysiologiaPlantarum,1990,79(1):78.
[28] JAGTAP V,BHARGAVA S.Variation in the antioxidant metabolism of drought tolerantand drought susceptible varieties ofSorghumbicolor(L.) Moench.exposed to high light,low water and high temperature stress [J].JournalofPlantPhysiology,1995,145(s1-2):195.
[29] DAVIDSON J F,WHYTE B,BISSINGER P H,etal.Oxidative stress is involved in heat-induced cell death inSaccharomycescerevisiae[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1996,93(10):5116.
[30] ALMESELMANI M,DESHMUKH P S,SAIRAM R K,etal.Protective role of antioxidant enzymes under high temperature stress [J].PlantScience,2006,171(3):382.
[31] FEIERABEND J.Capacity for chlorophyll synthesis in heat-bleached 70S ribosome-deficient rye leaves [J].Planta,1977,135(1):83.
[32] LIU Z C,SU D Y.Effect of high temperature on chloroplast proteins in wheat [J].ActaBotanicaSinica,1985,27:63.
[33] BHULLAR S S,JENNER C F,BHULLAR S S,etal.Responses to brief periods of elevated temperature in ears and grains of wheat [J].FunctionalPlantBiology,1983,10(6):549.
[34] ZHAO K F,FAN H,HARRIS P J C.Effect of exogenous ABA on the salt tolerance of corn seedlings under salt stress [J].ActaBotanicaSinica,1995,37(4):295.
[35] CALDERWOOD S K,STEVENSON M A,PRICE B D.Activation of phospholipase C by heat shock requires GTP analogs and is resistant to pertussis toxin [J].JournalofCellularPhysiology,1993,156(1):153.
[36] STEVENSON M A,CALDERWOOD S K,HAHN G M.Rapid increases in inositol trisphosphate and intracellular Ca++after heat shock [J].BiochemicalandBiophysicalResearchCommunications,1986,137(2):826.
[37] KIANG J G,MCCLAIN D E.Effect of heat shock,[Ca2+]i,and cAMP on inositol trisphosphate in human epidermoid A-431 cells [J].AmericanJournalofPhysiology,1993,264(6 Pt 1):C1561.

