Ra1362调控环二鸟苷酸影响结核分枝杆菌H37Ra的生物膜发育和休眠
丁晓娟 刘毅 孙涛 周小丹 李传友 方海红
结核分枝杆菌(Mycobacteriumtuberculosis,MTB)是引起结核病的病原菌。MTB可在宿主体内长期潜伏,甚至终生不发病,这种潜伏即休眠能力使得MTB能够成功逃避宿主的免疫清除和抵御短期的药物治疗。MTB的生物膜形成是其耐药性增强的原因之一。因此,揭示MTB的生物膜发育和休眠潜伏机制对缩短结核病疗程和防控结核病具有重要意义。
环二鸟苷酸(c-di-GMP)是一种细菌胞内的二级信使,通过调节胞内多种重要代谢途径,在细菌不同生长阶段发挥作用[1-2]。c-di-GMP具有多种功能,如生物膜的形成[3]和免疫调节[4]等。c-di-GMP与TetR家族蛋白EthR(Rv3855基因编码)结合可调控MTB对乙硫异烟胺的抗性[5];同时,在慢生长MTB中c-di-GMP也发挥着调控休眠和毒力的作用。笔者前期研究也发现,c-di-GMP合成酶基因的敲除增加了菌株在低氧条件下的休眠能力,进一步推理分析对DosR调控通路相关基因并无明显影响,但对其详细调控机制及对细胞的潜伏感染能力的影响未进行深入探讨[6]。笔者通过基因序列比对在MTB减毒菌株H37Ra的基因组序列中检索到一个含编码GAF-GGEDF-EAL的基因,基因编号是MRA_1362(简写为Ra1362)。该基因编码c-di-GMP的二鸟苷环化酶(DGC)负责合成c-di-GMP[7]。笔者拟进一步对Ra1362基因无痕敲除,观察Ra1362基因在体外对H37Ra生物膜发育及细菌休眠的影响,从而为MTB的休眠或潜伏感染研究提供新的思路。
材料和方法
一、材料
1.菌株和质粒:MTB菌株H37Ra购自中国食品药品检定研究院;大肠埃希菌DH5α和pET28a(+)为本实验室保存;大肠埃希菌BL21(DE3)和pEasy-Blunt simple购自北京全式金有限公司;p1NIL、pGOAL19和pUC19-Gm-INT载体由英国皇家医学院Tanya Parish实验室Tanya Parish教授馈赠。
2.主要试剂和培养基:PrimeSTAR DNA polymerase(日本TaKaRa公司);DNA纯化试剂盒和质粒抽提试剂盒(美国Promega公司);RNA抽提试剂RNAiso plus (TRIzol)(日本TaKaRa公司);反转录及荧光定量PCR试剂:PrimeScript 1st Strand cDNA synthesis kit(日本TaKaRa公司);SYBR Premix Ex TaqTM(日本TaKaRa公司);Tween-80、甘氨酸、CaCl2等化学试剂购自国药集团化学试剂公司;LB培养基(美国Oxiod公司);Middlebrook 7H9液体培养基或7H10固体培养基,厌氧生长用葡萄糖胰蛋白胨琼脂培养基(DTA培养液;美国BD公司);牛血清白蛋白和油酸购自生工生物工程(上海)股份有限公司。
3.引物设计:(1)构建敲除质粒用引物:Ra1362-UPL:ACATCTCGGATGCTATCTGTG;Ra1362-UPR:CACAGATAGCATCCGAGATGTCGGTC-AGCGGCGAAC;Ra1362-DNL:CCCAAGCTTCG-TTGAGCAGATCGTCCTTC;Ra1362-DNR:GG-ATCCCATCAAGATAACGCCGGGTCA;(2)敲除株验证用引物:Mut-ck-L:TGAAGCGGTACGCAGAATC;Mut-ck-R:CAGCCTTCCAGACGCATAACT;(3)定量RT-PCR用引物:1362S2:TCTCCAATGAGTGCCGATGCC;1362A2:GAT-ACTGACGGTGCGGGTGAGC。
二、方法
1.H37Ra感受态制备和电转化:参考文献[8],挑取单菌落,将MTB在7H9完全培养基中培养至吸光度值(A600值)≈0.6,加入终浓度为0.2 mol/L的甘氨酸,继续培养1~3 d后分别以等体积、1/2体积、1/4体积的37 ℃预温的10%甘油充分重悬洗涤细胞3次。最后用适量10%甘油重悬,调整A600值至5.5~8.0。将0.5~1.0 μg质粒加入上述200 μl新鲜制备的MTB感受态细胞中,轻弹混匀,电击转化(参数1000 Ω,25 μF),37 ℃振荡培养(摇床转速200~220 r/min), 复苏2~3 d后,涂于含有相应抗性的7H10平板上。37 ℃培养箱静置培养20~30 d。
2.基因敲除株的构建:提取MTB的基因组DNA,PCR扩增各基因上游和下游片段,再通过PCR将两片段拼接起来,然后连接到pEASY Blunt simple载体上,筛选测序验证阳性克隆并冻存备用。提取质粒,酶切后与p1NIL和pGOAL19载体连接[9],转化大肠埃希菌DH5α,在含卡那霉素和潮霉素及X-gal的平板培养,挑蓝色菌落,酶切筛选阳性克隆,获得的敲除用自杀质粒电转化入MTB中。无抗培养液复苏24 h后涂布在含卡那霉素和潮霉素以及X-gal的固体平板上。1个月左右挑取蓝色克隆在双抗的液体培养基中传代、保菌。按照1∶100体积百分比接种于无抗培养液中,15~18 d后,将菌液涂在含2%蔗糖和X-gal的平板上培养,挑取白色克隆PCR筛选测序验证基因敲除株,命名为△Ra1362。
3.转录谱基因芯片和实时荧光定量PCR:挑取3个菌株的单克隆,包括H37Ra野生型菌株、△Ra1362突变株,基因回补菌株ComRa1362。在苏通培养基(SM培养基)中传代1次后,分别接种于新鲜的50 ml SM培养基(500 ml三角瓶),接种后初始A600值≈0.02,37 ℃,摇床200 r/min继续培养13 d,其中11 d 时将其中一瓶△Ra1362培养物外源添加人工合成的终浓度为100 μmol/L的c-di-GMP。用含1 mm 玻璃珠的离心管收集约15 mlA600值≈1.0的细菌,加上4 ml体积比为3∶1的氯仿:甲醇充分涡旋1 min后,加20 ml RNAiso plus(TRIzol)充分混匀后置于干冰送至上海伯豪生物技术有限公司,进行RNA抽提和生物芯片分析。采用热酚法提取总RNA,QIAGEN RNeasy Mini Kit纯化RNA,利用Agilent单通道表达谱芯片杂交,测试几株细菌的基因表达情况。
收集菌体,抽提RNA后反转录为cDNA,取1 μl 作为模板,加入10 μl 2×SybrGreen Premix Ex Taq,PCR上下游引物(10 μmol/L)各0.4 μl,ROX Reference Dye 0.4 μl,用水补至总体积为20 μl。以MTB 16S rDNA序列作为内参,标准化其他基因的表达量。PCR反应条件:95 ℃预变性3 min;95 ℃ 5 s,60 ℃ 30 s,40个循环。
4.MTB的生物膜形成实验:参照文献[9]并进行了改动,将对数期生长的细菌充分分散,稀释至A600值≈0.02或者2%的比例接种在液体培养基上。分装在25 ml塑料痰培养管中,每管4 ml,直立静置培养。15 d后开始观察、摄影、记录。当细菌贴壁形成生物膜时,将成熟的生物膜培养物中上清液小心吸弃,加入0.5%的结晶紫染液(含10%甲醛用以固定生物膜),室温染色5 min,弃染色液,用蒸馏水反复轻轻冲洗至没有紫色出现为止。干燥后进行摄影记录。
5.MTB的体外快速厌氧休眠模型(rapid anaerobic dormancy model,RADM):将对数期生长的细菌充分分散,以终浓度为A600值≈0.02接种在厌氧用DTA液体培养基中,按照文献[10]操作并略微改进。以顶空体积比1∶1.5的比例分装到青霉素瓶中,盖上胶塞压紧铝盖。每瓶装4 ml培养液,37 ℃ 振荡培养(摇床转速230 r/min)。不同时间点测A600值并记录;稀释涂布7H10固体平板测定菌落形成单位(CFU)。每组(野生株组和敲除株组)另加1组亚甲蓝指示剂对照指示氧气消耗情况,当氧气完全耗尽时亚甲蓝将褪色。
6.DNA染色和荧光素酶活体染色:取1 ml培养物,离心留细胞沉渣,用等体积含0.02% Tween-80的25 mmol/L 4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)(pH=7.7)进行重悬。再次离心去上清,沉渣用1/2体积的N-2-羟乙基哌嗪-N′-2-乙磺酸(HEPES)重悬,其中含有终浓度50 μg/ml二乙酰荧光素(FDA)或300 nmol/L二脒基苯基吲哚(DAPI),在37 ℃温育20 min。离心去上清,沉渣用HEPES洗涤1次,然后用1/10体积进行重悬以获得适于显微镜观察的高浓度细胞。取5 μl样品滴于多聚L-赖氨酸包被的载玻片上,盖上盖玻片,用荧光显微镜进行观察。
结 果
一、H37Ra中Ra1362基因的敲除
采用英国皇家医学院Tanya Parish实验室所构建的MTB无痕敲除系统[8],对Ra1362 (1872 bp)进行无痕敲除,Ra1362筛选了三批(每批50~60个克隆)才获得阳性敲除株。采用两侧翼外侧的引物对,PCR扩增Ra1362敲除株,产物长度2.1 kb;野生株扩增产物长度4.0 kb,PCR产物直接送测序确认无突变后冻存备用。基因敲除菌株命名为△Ra1362。
二、Ra1362调控部分DosR基因表达
转录谱差异分析显示,与野生株相比,19个与MTB休眠相关的DosR调控子基因(共约50个)[11]在△Ra1362中下调表达(表1,第2列),这些基因的表达缺陷能被Ra1362回补株(Com1362)补偿,外源添加人工合成c-di-GMP组也具有同样的效果,这说明确实是由于能合成c-di-GMP的Ra1362基因敲除所引起的(表1,第3和第4列)。另外,将野生株和△Ra1362株应用定量RT-PCR验证了部分基因(13个)的表达情况(图1),与芯片结果一致。
三、Ra1362调控MTB生物膜发育
参照文献[12]研究方法,观察MTB生物膜形成情况,同时加入指示氧气浓度的亚甲蓝作为空白参照。结果表明,亚甲蓝在第10天左右开始褪色,△Ra1362组略早于野生株组(WT组);21 d时△Ra1362已经形成薄膜样生物膜,且明显铺满气液完整界面,并有少许皱褶; 26 d时观察显示△Ra1362的气液交界面上生物膜已形成较厚的皱褶,而野生株的生物膜刚铺满气液界面,且只有少许皱褶;35 d后两者的表面特性无明显差异(图2a)。另外,贴壁的生物膜表型也有一致的结果(图2b)。
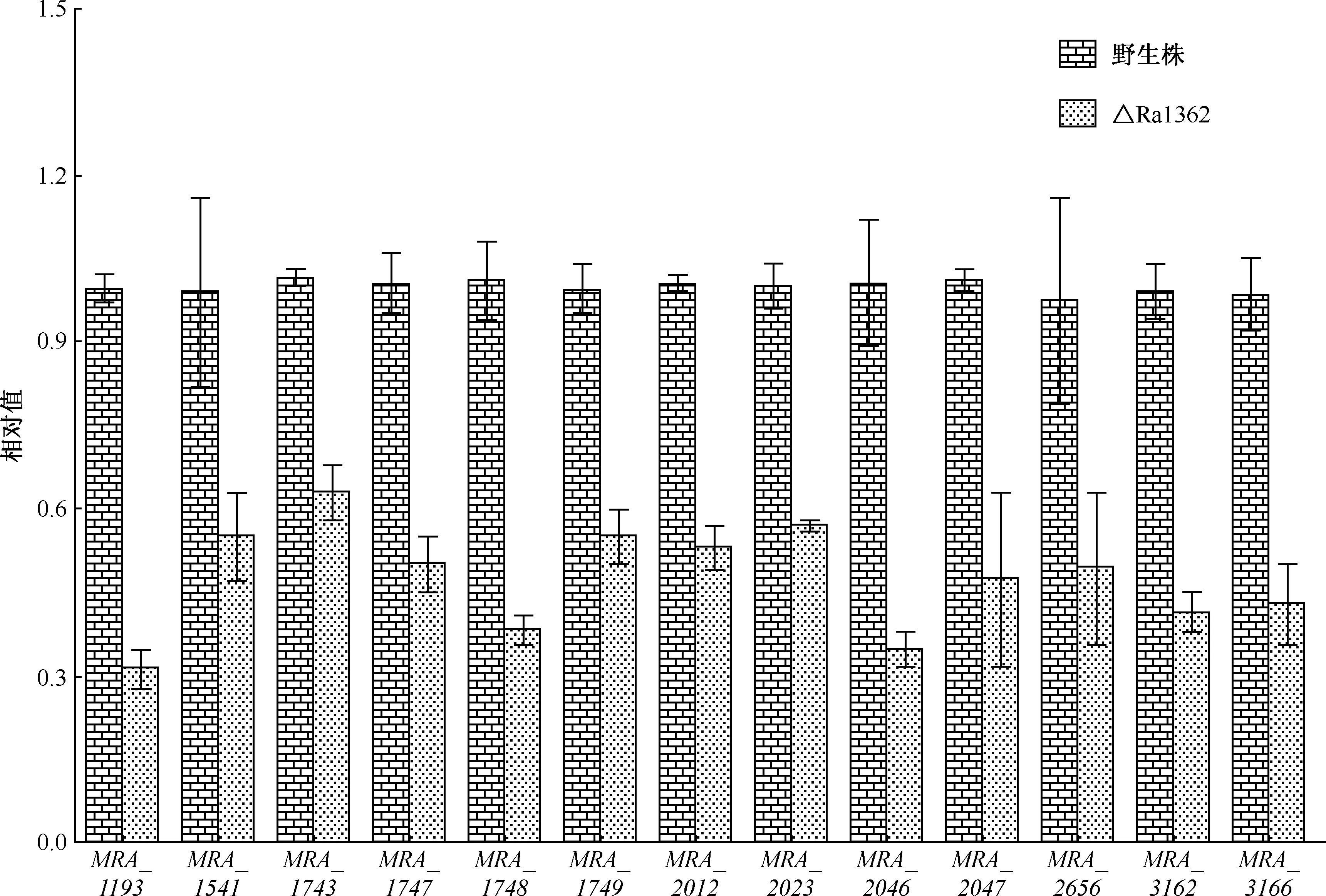
图1 定量RT-PCR测定生长后期DosR相关基因的表达(与16S rDNA相比)
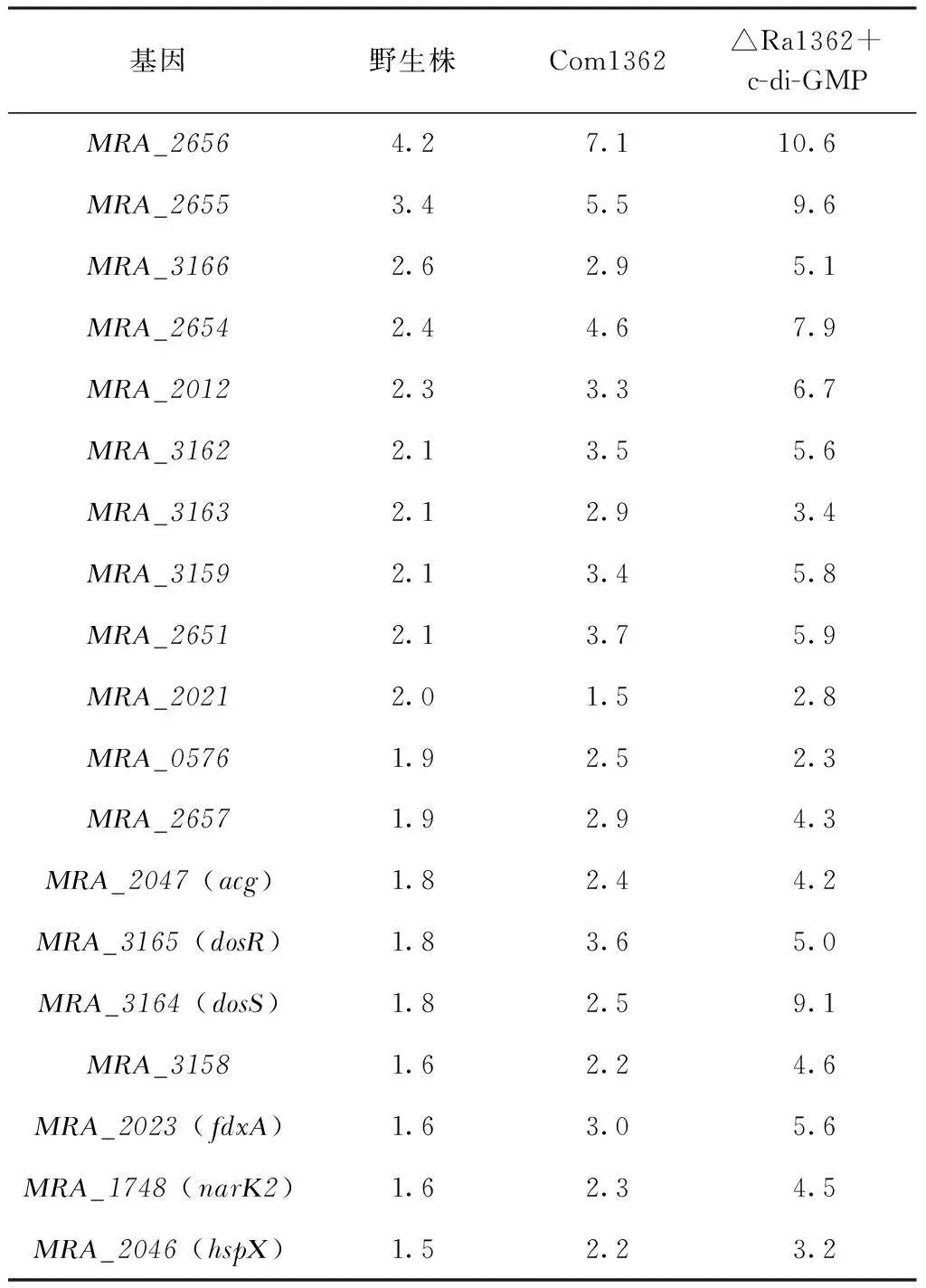
基因野生株Com1362△Ra1362+c-di-GMPMRA_26564.27.110.6MRA_26553.45.59.6MRA_31662.62.95.1MRA_26542.44.67.9MRA_20122.33.36.7MRA_31622.13.55.6MRA_31632.12.93.4MRA_31592.13.45.8MRA_26512.13.75.9MRA_20212.01.52.8MRA_05761.92.52.3MRA_26571.92.94.3MRA_2047 (acg)1.82.44.2MRA_3165 (dosR)1.83.65.0MRA_3164 (dosS)1.82.59.1MRA_31581.62.24.6MRA_2023 (fdxA)1.63.05.6MRA_1748 (narK2)1.62.34.5MRA_2046 (hspX)1.52.23.2
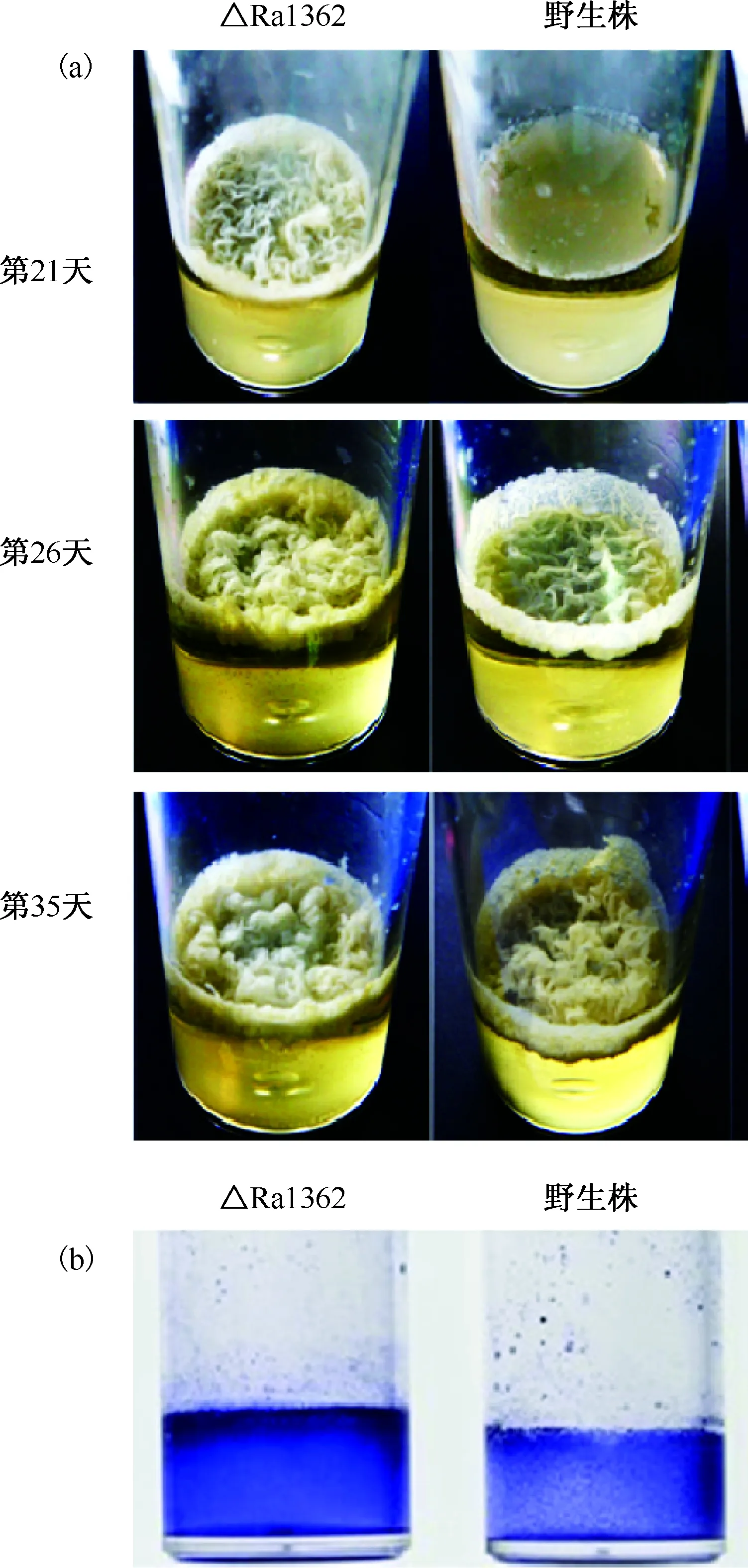
图a示△Ra1362株和野生株分别在培养第21、26和35天时气液界面的细菌生物膜的发育情况;图b示△Ra1362株和野生株培养35 d后贴壁的生物膜表型发育情况(结晶紫染色)图2 野生株和△Ra1362株在痰液管中培养时的生物膜发育情况
四、Ra1362调控MTB在厌氧条件下的生存能力
为了验证△Ra1362对MTB在厌氧条件下生存情况的影响,在RADM中比较野生株和△Ra1362株生存能力的差异。氧气消耗能力比较:利用亚甲蓝作为氧气消耗的指示剂,当氧气完全耗尽时将褪色。结果显示,△Ra1362组中亚甲蓝褪色的时间为160 h,比野生株组要快12 h(图3),即△Ra1362株更快将顶空中的氧气消耗到最低程度。

图3 野生株和△Ra1362株厌氧培养160 h后颜色比较
定量RT-PCR检测得出,厌氧正调控有关的MRA_3165(DosR)基因在△Ra1362中相对表达量为28.75,明显高于野生株的表达水平(相对表达量为21.2);与休眠负调控有关的MRA_1748相对表达量由野生株的1.01下降为△Ra1362的0.45,MRA_2022基因相对表达量由野生株的0.98下降为△Ra1362的0.3。MRA_1748和MRA_2022基因在△Ra1362中表达量下降明显,这说明Ra1362和厌氧条件下的调控密切相关。
RADM的不同时间点取样并稀释涂布平板测定细菌菌落形成单位(CFU),结果表明,5 d时,△Ra1362株与野生株组的CFU数量无明显差异,8~10 d时,△Ra1362的CFU仅约为野生株的5%~10%(未做统计);另一方面,自第5天起,△Ra1362在平板上形成肉眼可见的克隆CFU所需时间较野生株长5~7 d,这表明厌氧压力后敲除株平板恢复生长的能力弱于野生株;厌氧培养40 d后,两者在平板上均不能形成克隆;但培养60 d后通过DNA染色和荧光素酶活体染色发现,这些细菌并没有死亡(图4),这提示细菌可能处于不能恢复正常生长的休眠状态。

图中所有细胞均可被二脒基苯基吲哚(DAPI)染成蓝色,活细胞可被二乙酸荧光素(FDA)染成绿色图4 快速厌氧模型中厌氧培养60 d后细菌的细胞染色情况
讨 论
MTB通过气溶胶方式感染人体后,在长期进化过程,形成了一些适应吞噬体内低氧或厌氧条件下的生存策略。生物膜通常被认为是细菌在环境生存不利时形成的一种具有保护作用的多细胞结构,对外界不利环境的耐受性往往会增强[13-15]。c-di-GMP常作为生物膜转录后调控模式在不同细菌中被阐明[9, 16]。胞内c-di-GMP是否能感应外界环境的变化从而启动MTB类似的休眠?为了回答这个问题,笔者在前期实验证实MTB H37Ra株中Ra1362具有c-di-GMP合成和降解能力的基础上[7],将该合成酶基因敲除。敲除株在体外培养过程更快形成生物膜,以适应外界低氧环境,从而促进体外生物膜发育。笔者认为,Ra1362基因敲除后,胞内c-di-GMP浓度下降,随着生长的进行,培养环境中的氧气浓度下降,胞内感应外界低氧环境能力随之下降,到生长对数期刚结束,被细菌误认为不利环境因而很快形成生物膜,从而导致细菌成膜能力增强。
转录谱差异分析结果提示,胞内c-di-GMP信号转导途径可能参与了MTB的休眠调控作用,部分DosR休眠基因受c-di-GMP正调控,c-di-GMP调控休眠基因上调表达,从而提高MTB的休眠能力,外源添加c-di-GMP能够透过细胞膜进入胞内执行相同的调控功能。同时,定量RT-PCR验证部分基因的表达情况与芯片结果一致,说明c-di-GMP能通过一个网络调控休眠基因的表达,或者说c-di-GMP通过某种信号感应调节Dos系统基因的表达,但不是调控Dos系统的唯一途径,休眠的启动并不完全依赖c-di-GMP。
鉴于转录谱芯片揭示Ra1362能调节Dos系统部分基因表达水平下降,为了模拟细菌的休眠状态,笔者在体外建立了一个Dos系统应答缺氧环境,即快速厌氧休眠模型。在建模过程,笔者发现△Ra1362中烟酰胺腺嘌呤二核苷酸(氧化态)/烟酰胺腺嘌呤二核苷酸(还原态) (NAD/NADH)比例与野生株相比有降低趋势,但以A600值测定的生长曲线并没有明显的变化,这些结果跟文献[17]中报道将DosR敲除株的反应类似。笔者用定量RT-PCR 的方法验证了厌氧状态和有氧状态下与Dos系统相关基因的表达,显示DosR基因只在厌氧时才有较高表达,与休眠负调节有关的MRA_1748和MRA_2022在△Ra1362株中表达量也明显下降。活细胞染色和体外恢复生长培养结果也提示,细菌都处于活细胞状态但是并不能恢复正常生长,跟野生株相比△Ra1362株这种不可恢复生长状态相对更明显。因此,有理由认为c-di-GMP与DosR在低氧下调节胞内代谢内稳态的模式相似,即通过胞内氧化还原稳态调节应答低氧压力,从而下调Dos系统部分抑制基因的表达。前期研究发现,c-di-GMP合成酶基因的敲除对DosR调控通路相关基因并无影响[6],笔者通过体外培养的特点进行推理分析,并没有用RT-PCR或者转录谱芯片进行筛选。本次研究通过RT-PCR及转录谱芯片发现该通路中较多的基因受到了Ra1362正调控与前期研究不同,可能还与两种菌株使用的培养条件不同有关[18],H37Ra的厌氧模型使用的DTA培养基,而H37Rv使用的是7H9培养基。
综上,笔者认为,一方面MTB H37Ra在生长早期MTB依赖c-di-GMP感应缺氧或者氧化还原压力,负调控生物膜的发育;另一方面,合成c-di-GMP缺失后,感应外界环境变化能力也变弱,从而抑制负调控休眠基因的表达以维持体内氧化还原内稳态。这表明c-di-GMP合成酶基因Ra1362在MTB H37Ra生长过程抑制生物膜发育及细菌休眠。
[1] Römling U,Galperin MY,Gomelsky M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiol Mol Biol Rev, 2013, 77(1): 1-52.
[2] Pesavento C, Hengge R. Bacterial nucleotide-based second messengers. Curr Opin Microbiol, 2009, 12(2):170-176.
[3] Bobrov AG, Kirillina O, Ryjenkov DA, et al. Systematic analy-sis of cyclic di-GMP signalling enzymes and their role in biofilm formation and virulence inYersiniapestis. Mol Microbiol, 2011, 79(2): 533-551.
[4] Hu DL, Narita K, Hyodo M, et al. c-di-GMP as a vaccine adjuvant enhances protection against systemic methicillin-resis-tantStaphylococcusaureus(MRSA) infection. Vaccine, 2009, 27(35): 4867-4873.
[5] Zhang HN, Xu ZW, Jiang HW, et al. Cyclic di-GMP regulatesMycobacteriumtuberculosisresistance to ethionamide. Sci Rep, 2017, 7(1): 5860.
[6] Hong Y, Zhou X, Fang H, et al. Cyclic di-GMP mediatesMycobacteriumtuberculosisdormancy and pathogenecity. Tuberculosis (Edinb), 2013, 93(6): 625-634.
[7] 王琳. 结核分枝杆菌c-di-GMP代谢相关蛋白的生物化学研究. 安徽: 中国科学技术大学, 2010.
[8] Parish T, Stoker NG.Mycobacteriumtuberculosisprotocols. Clifton: Humana Press,2001.
[9] Kulka K, Hatfull G, Ojha AK. Growth ofMycobacteriumtuberculosisbiofilms. J Vis Exp, 2012, (60).pii: 3820.
[10] Kumar A, Toledo JC, Patel RP, et al.MycobacteriumtuberculosisDosS is a redox sensor and DosT is a hypoxia sensor. Proc Natl Acad Sci U S A, 2007, 104(28): 11568-11573.
[11] Peddireddy V, Doddam SN, Ahmed N. Mycobacterial dormancy systems and host responses in tuberculosis. Front Immunol, 2017, 8: 84.
[12] Ojha AK, Baughn AD, Sambandan D, et al. Growth ofMycobacteriumtuberculosisbiofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol Microbiol, 2008, 69(1): 164-174.
[13] Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms: from the natural environment to infectious diseases. Nat Rev Microbiol, 2004, 2(2): 95-108.
[14] Donlan RM. Biofilms on central venous catheters: is eradication possible? Curr Top Microbiol Immunol, 2008, 322: 133-161.
[15] Hatt JK, Rather PN. Role of bacterial biofilms in urinary tract infections. Curr Top Microbiol Immunol, 2008, 322: 163-192.
[16] Martínez LC, Vadyvaloo V. Mechanisms of post-transcriptional gene regulation in bacterial biofilms. Front Cell Infect Microbiol, 2014, 4:38.
[17] Leistikow RL, Morton RA, Bartek IL, et al. TheMycobacteriumtuberculosisDosR regulon assists in metabolic homeostasis and enables rapid recovery from nonrespiring dormancy. J Bacteriol, 2010, 192(6): 1662-1670.
[18] Dokladda K, Billamas P, Palittapongarnpim P. Different behaviours of promoters inMycobacteriumtuberculosisH37Rv and H37Ra. World J Microbiol Biotechnol, 2015, 31(2): 407-413.

