丙戊酸引起癫痫患者纤维蛋白原减少的相关因素分析
齐晓涟,杨迦雯(首都医科大学宣武医院药剂科,北京 100053)
丙戊酸是一种传统的抗癫痫药物(AEDs),其是3种发作类型(全身强直-阵挛发作、失神发作和肌阵挛发作)的一线药物且是唯一的首选药物[1],是一种较为安全、有效的广谱抗癫痫药[2]。该药对于癫痫单纯部分性发作和复杂部分性发作也有一定疗效[3]。丙戊酸作为抗多种发作类型癫痫的一线药物,使用广泛,在长期用药期间易出现不良反应。自丙戊酸在临床广泛应用以来,国内外在不良反应的发生率和发生机制上已进行了大量研究,丙戊酸常见的药品不良反应有肝脏毒性、体质量增加和代谢综合征、致畸毒性等[4]。近年来国内也有较多关于丙戊酸不良反应的报道,一项涉及633例长期服用丙戊酸癫痫患者发生的不良反应研究[5]提示:中枢神经系统的不良反应占34.92%,消化系统损伤占28.57%,血液系统损害占16.67%。许多中外文献报道,神经外科术后及患有癫痫的患者服用丙戊酸后常出现纤维蛋白原减少[6-14]。纤维蛋白原的减少可引起患者继发性鼻腔出血、消化道出血、脑外科术后颅内出血等严重后果,需引起临床重视。基于上述报道,本研究就使用丙戊酸与发生纤维蛋白原减少事件之间的相关性进行探讨,以期为临床丙戊酸的安全使用提供参考。
1 研究对象与方法
1.1 研究对象
根据主要研究目的严格筛选纳入研究的病例,纳入2017年1月1日至3月1日首都医科大学宣武医癫痫诊疗中心(儿科、神经内科一、二诊疗组、功能神经外科)既往确诊为癫痫且已接受口服丙戊酸治疗并规律服药1周以上的住院患者。系统整理信息后排除以下患者:(1)年龄大于65岁的患者;(2)存在肝脏疾病、血液系统疾病、免疫系统疾病、合并感染性疾病的患者;(3)使用纤维蛋白原类药物、凝血酶类药物和具有严重肝毒性药物的患者;(4)同期未进行纤维蛋白原、血常规、凝血功能、肝肾功能检查或其他用药数据缺失的患者。
1.2 研究药品
患者服用丙戊酸药品包括:湖南省湘中制药有限公司的丙戊酸钠糖衣片(批准文号:国药准字H43026874,规格:每片0.2 g)、丙戊酸镁缓释片(批准文号:国药准字H20030537,规格:每片0.25 g)和丙戊酸镁片(批准文号:国药准字H10890013,规格:每片0.2 g);杭州赛诺菲民生制药有限公司的丙戊酸钠缓释片(批准文号:国药准字H20010595,规格:每片500 mg)和丙戊酸钠口服溶液剂(批准文号:国药准字H20041435,规格:300 mL∶12 g)。
1.3 研究方法
采用回顾性调查的方法,收集患者的一般情况,包括年龄、性别、身高、体质量、诊断结果;丙戊酸用药情况,包括药品名称、剂型、规格、用法用量,合并用药情况等;指标检测情况,包括同期肝功能、血常规、凝血功能的各项指标。肝功能指标包括丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBIL)、白蛋白(ALB);血常规指标包括白细胞计数(WBC)、中性粒细胞百分率(NEUT)、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT);凝血功能指标包括凝血酶原时间活动度(PTA)、国际标准化比值(INR)、凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、纤维蛋白原等指标。其他相关监测信息包括丙戊酸血药浓度、血氨水平。然后利用Excel软件建表,按照血浆纤维蛋白原情况、年龄、丙戊酸钠剂型、剂量情况录入数据进行分组统计。
1.4 统计学方法
采用SPSS 22.0软件进行统计分析,先用t检验(参数)和Mann Whiyney U检验(非参数)对各指标的组间差异进行分析,再采用单因素和二项Logistic回归分析引起纤维蛋白原减少的影响因素,并对相关的连续性变量绘制受试者工作特征曲线(Receiver operating characteristic curve,简称ROC曲线)筛选切点。P<0.05表示差异有统计学意义。
2 结果
2.1 患者一般情况
2017年1月1日-2017年3月1日首都医科大学宣武医院癫痫诊疗中心共收住癫痫诊断明确,并持续1周以上服用丙戊酸患者112例,根据排除标准,剔除53例,剩余59例纳入本项研究。
在纳入研究的59例患者中,男性40例(67.8%),女性19例(32.2%),男性中发生纤维蛋白原减少(低于正常值2.0 g/L)的有17例,占男性的42.5%,女性中发生纤维蛋白原减少的有8例,占女性的36.84%;其中年龄≤14岁的患者35例,>14岁的患者24例,平均年龄为(17.2±15.7)岁。将纳入研究的59例患者根据纤维蛋白原减少情况分为纤维蛋白原减少组和纤维蛋白原正常组,通过对两组患者的性别和年龄进行比较,发现纤维蛋白原减少与患者年龄呈负相关(P=0.042),与患者性别无关(P=0.679)。两组患者的性别、年龄见表1。

表1 两组患者的性别、年龄Tab 1 The patients’gender and age between 2 groups
2.2 患者的用药情况
2.2.1 丙戊酸剂量 本次纳入研究的患者丙戊酸的平均剂量是18.1 mg/(kg·d),纤维蛋白原减少组患者丙戊酸的平均剂量是22.8 mg/(kg·d),纤维蛋白原正常组患者丙戊酸的平均剂量14.8 mg/(kg·d),两组比较差异有统计学意义(P=0.003)。
2.2.2 丙戊酸剂型 本次纳入研究的患者中服用缓释剂(丙戊酸镁缓释剂和丙戊酸钠缓释剂)的共32例,其中发生纤维蛋白原减少的有14例,发生率为43.8%;服用普通剂型(丙戊酸钠糖衣片、丙戊酸镁片、丙戊酸钠口服溶液剂)的共27例,其中发生纤维蛋白原减少的有10例,发生率为37.0%。服用缓释剂患者中纤维蛋白原减少发生率与服用普通剂型患者中纤维蛋白原减少的发生率进行比较,差异无统计学意义(P=0.790)。
2.2.3 合并用药 本次纳入研究的患者中,合并用药涉及奥卡西平、卡马西平、托吡酯、拉莫三嗪以及氯硝西泮。参考药品说明书中药物相互作用,将丙戊酸合并使用卡马西平、氯硝西泮以及拉莫三嗪的患者设为相互作用组,将丙戊酸单药应用以及合并使用奥卡西平、托吡酯的患者设为非相互作用组。其中相互作用组患者44例,发生纤维蛋白原减少的有19例,发生率为43.2%;非相互作用组患者15例,发生纤维蛋白原减少的有5例,发生率为33.3%。两组患者纤维蛋白原减少的发生率比较,差异无统计学意义(P=0.502)。
2.3 患者的血常规、肝功能、凝血功能指标情况
本次纳入研究的患者中,纤维蛋白原减少组和纤维蛋白原正常组患者的血常规和肝功能指标中只有NEUT、PLT两项指标的均值间差异具有统计学意义(P<0.05);凝血功能指标中只有PTA和TT两项指标的均值间差异均有统计学意义(P<0.05)。两组患者血常规、肝功能和凝血功能指标比较见表2。
表2 两组患者血常规、肝功能和凝血功能指标比较(±s)Tab 2 Comparison of blood routine test,liver function and coagulation function indexes between 2 groups(±s)
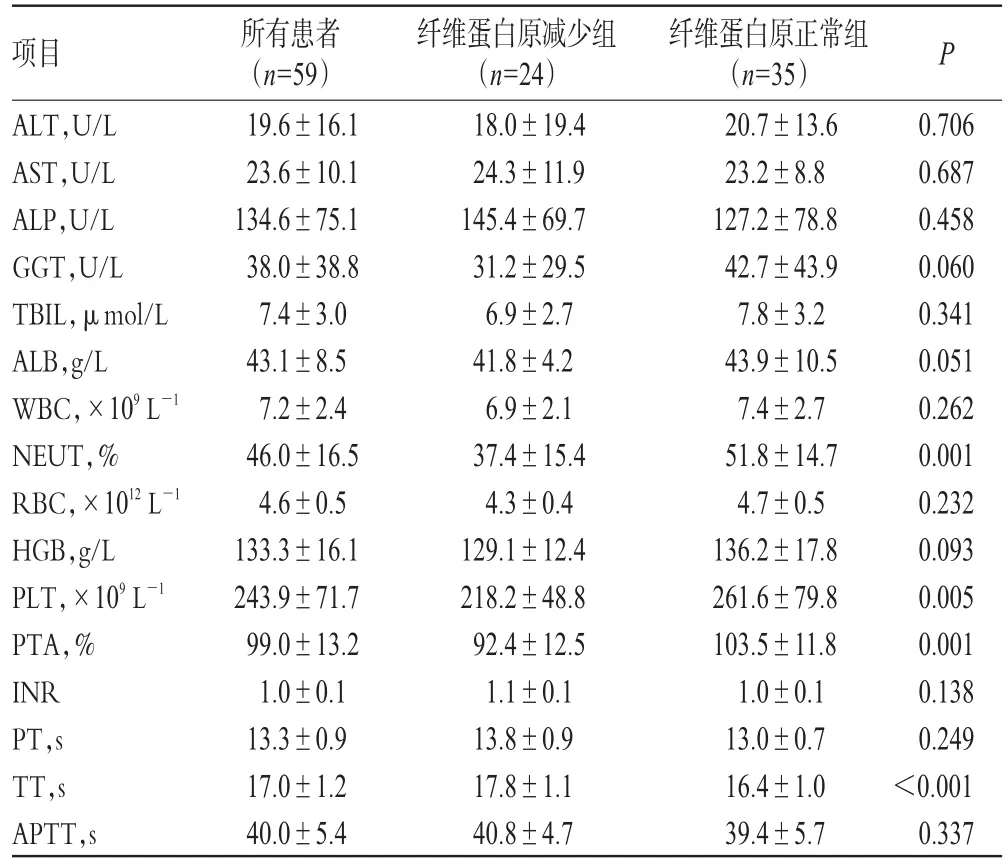
表2 两组患者血常规、肝功能和凝血功能指标比较(±s)Tab 2 Comparison of blood routine test,liver function and coagulation function indexes between 2 groups(±s)
项目ALT,U/L AST,U/L ALP,U/L GGT,U/L TBIL,μmol/L ALB,g/L WBC,×109L-1 NEUT,%RBC,×1012L-1 HGB,g/L PLT,×109L-1 PTA,%INR PT,s TT,s APTT,s所有患者(n=59)19.6±16.1 23.6±10.1 134.6±75.1 38.0±38.8 7.4±3.0 43.1±8.5 7.2±2.4 46.0±16.5 4.6±0.5 133.3±16.1 243.9±71.7 99.0±13.2 1.0±0.1 13.3±0.9 17.0±1.2 40.0±5.4纤维蛋白原减少组(n=24)18.0±19.4 24.3±11.9 145.4±69.7 31.2±29.5 6.9±2.7 41.8±4.2 6.9±2.1 37.4±15.4 4.3±0.4 129.1±12.4 218.2±48.8 92.4±12.5 1.1±0.1 13.8±0.9 17.8±1.1 40.8±4.7纤维蛋白原正常组(n=35)20.7±13.6 23.2±8.8 127.2±78.8 42.7±43.9 7.8±3.2 43.9±10.5 7.4±2.7 51.8±14.7 4.7±0.5 136.2±17.8 261.6±79.8 103.5±11.8 1.0±0.1 13.0±0.7 16.4±1.0 39.4±5.7 P 0.706 0.687 0.458 0.060 0.341 0.051 0.262 0.001 0.232 0.093 0.005 0.001 0.138 0.249<0.001 0.337
2.4 与纤维蛋白原减少密切相关的危险因素
将患者的性别、年龄、丙戊酸剂量、丙戊酸剂型、合并用药、6项血常规指标(WBC、NEUT、RBC、HGB、HCT、PLT)和6项肝功能指标(ALT、AST、ALP、GGT、TBIL、ALB)等17项变量引入SPSS 22.0统计软件二元Logistic回归分析计算模型,其中仅有丙戊酸剂量、NEUT、RBC、PLT对纤维蛋白原减少的发生率具有重要意义,是构成纤维蛋白原减少的相关危险因素,其中丙戊酸剂量的相关危险因素比值比(Odds ration,OR)大于1,其余3项的危险因素OR均小于1。将纤维蛋白原减少与丙戊酸剂量绘制ROC曲线,结果显示,纤维蛋白原减少的ROC曲线下面积为0.766,敏感度为98.5%,特异度为54.3%(即图中拐点),切点所示丙戊酸剂量为13.311 7 mg/(kg·d)。二项Logistic回归分析结果见表3;纤维蛋白原减少与丙戊酸剂量的ROC曲线见图1。
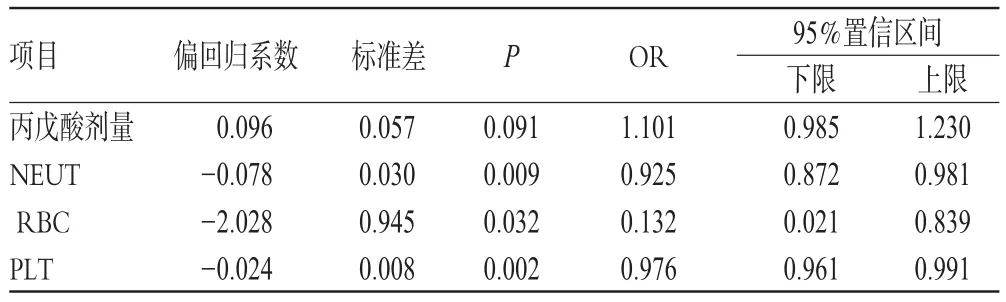
表3 二项Logistic回归分析结果Tab 3 Results of binary Logistic regression analysis
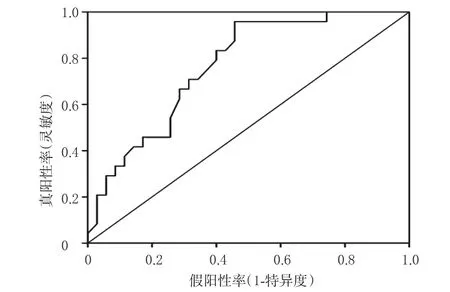
图1 纤维蛋白原减少与丙戊酸剂量的ROC曲线Fig 1 ROC curve of fibrinogenopenia and dosage of valproic acid
3 讨论
目前,丙戊酸引起纤维蛋白原减少的具体机制尚不明确,本次调查发现丙戊酸引起的血浆纤维蛋白原减少在性别分析中无统计学意义,提示丙戊酸引起的纤维蛋白原减少不存在性别差异。在本次调查中,14岁及以下患者服用丙戊酸后纤维蛋白原减少的发生率为51.4%,14岁以上患者服用丙戊酸后纤维蛋白原减少的发生率为25.0%,从上述结果看,年龄14岁及以下患者的纤维蛋白原减少发生率高于14岁以上患者,差异具有统计学意义(P<0.05)。但从二项Logistic回归分析的角度,年龄因素未入选模型方程,不能完全证明纤维蛋白原减少与年龄的相关性。
由于本研究中入组患者以儿科患者居多,成人患者较少,且即使是在儿科患者中,年龄上的分布也具有局限性。考虑到收集样本的偏倚,以及样本量的限制,分析结果与文献不完全一致[13,15],若在更大范围样本内进行更精细的年龄分层,可以对相关性做进一步的分析。
在本研究中纤维蛋白原减少组与纤维蛋白原正常组每天平均用药剂量具有显著性差异,二项Logistic回归分析,也将剂量因素纳入模型,且进一步提示用药剂量对纤维蛋白原减少具有促进作用。这与Tong V等[16]研究的呈剂量依赖的Ⅰ型丙戊酸肝脏毒性反应,可影响血中的肝酶水平,致出现纤维蛋白原减少的结论相一致。
查询药品说明书的药动学相关研究可以发现,在体内代谢过程中,影响丙戊酸代谢过程的药物及作用包括:卡马西平可降低丙戊酸血药浓度,且使两药的毒性代谢物浓度均升高;氯硝西泮与丙戊酸合用可增强后者毒性,削弱疗效;拉莫三嗪和丙戊酸竞争抑制肝药酶代谢,使后者血药浓度改变;奥卡西平和托吡酯分别与丙戊酸钠合用,一般对丙戊酸的血药浓度无影响。本研究以相互作用分组,对两组患者纤维蛋白原减少发生率的比较结果显示差异无统计学意义,提示丙戊酸纤维蛋白原减少与联合其他药物治疗关系不密切。这与曾艳等[17]的研究结论相一致。需要注意的是,在考虑该因素对于纤维蛋白原减少的影响时,由于变量较多,合并用药情况太复杂,需要足够大的样本量才能满足统计需求。
纤维蛋白原是一种由肝脏合成的可溶性、具有凝血功能的糖基化蛋白[11]。纤维蛋白原减少的原因包括合成减少(遗传性低纤维蛋白原血症、肝病等)和消耗增加(如溶解纤维蛋白治疗、蛋白丢失等)。研究表明,消化系统损害和血液系统损害位于常见丙戊酸类药物不良反应排名中的第二、三位[5]。故从纤维蛋白原的合成部位(肝)与纤维蛋白原发挥生理功能的部位(血液系统)分析丙戊酸引起纤维蛋白原减少较为合理。
在本次研究中,反映肝功能的各项转氨酶指标以及胆红素指标在纤维蛋白原减少组和纤维蛋白原对照组间差异均无统计学意义,二项Logistic回归分析中也没有反映肝功能的指标入选,因此不能说明纤维蛋白原减少与肝功能指标,尤其是转氨酶的变化相关。已有报道丙戊酸最常见的临床表现为转氨酶的升高,转氨酶的升高一般是由丙戊酸的酶诱导能力决定而不是肝细胞毒性介导[18],因此笔者推测丙戊酸的代谢产物具有肝毒性可影响部分肝功能,如纤维蛋白原的合成,但不会对转氨酶指标有显著影响。
丙戊酸单药治疗被认为是低凝状态和出血并发症的危险因素[19]。本研究中,仅NEUT、PLT在纤维蛋白原减少组和纤维蛋白正常组间有显著性差异,二项Logistic回归分析结果(NEUT、RBC和PLT的OR均小于1)提示,NEUT、RBC和PLT降低时,纤维蛋白原减少发生率升高。但丙戊酸造成纤维蛋白原减少的影响因素尚不明确,二者之间是否存在因果关系尚不得而知。Brennan SO等[20]发现丙戊酸导致的纤维蛋白原减少患者存在Aα167Arg→Lys的突变,且使纤维蛋白原发生功能性改变的研究提示了丙戊酸的表观遗传学效应与发生纤维蛋白原减少事件的关系。
在本次调查中,纤维蛋白原减少组与纤维蛋白原正常组间的PTA和TT的均值差异具有统计学意义。TT是直接反映纤维蛋白原减少或降解的指标,故在纤维蛋白原减少组体现为TT显著延长;而PTA是反映肝功能的指标,表明在纤维蛋白原减少组的肝功能较纤维蛋白原正常组有明显下降。笔者推测:临床使用丙戊酸出现纤维蛋白原减少时需考虑其肝脏的毒性作用,需及时调整剂量。2011年,Topf HG等[21]应用血栓弹力图分析了纤维蛋白原改变对凝血功能的影响,表明血液中的凝血酶和抗凝血酶改变并不是丙戊酸引起出血的原因,支持了本研究的推论。
本项研究提示丙戊酸剂量、NEUT、RBC、PLT与丙戊酸钠引起纤维蛋白原减少密切相关,其中丙戊酸剂量的OR>1,说明用药剂量与纤维蛋白原减少事件的发生成正相关;而NEUT、RBC和PLT的OR均<1,该3项指标与发生纤维蛋白原减少事件成负相关。用药剂量相关纤维蛋白原下降的ROC曲线下面积为0.766(敏感度为98.5%,特异度为54.3%),大于0.5,说明具有良好的初步预测价值。即每日剂量≥13.311 7 mg/kg的患者更容易发生纤维蛋白原减少,甚至出血风险。
对于长期使用丙戊酸钠的患者即使使用正常剂量,也要注意定期监测纤维蛋白原变化情况,剂量大于13.311 7 mg/(kg·d)时,可加强纤维蛋白原监测频率。对于长期服用丙戊酸钠预行手术的患者,术前有必要进行常规的凝血功能监测,以警惕术中术后存在的出血风险。因此,若在以后的研究中能纳入更多的临床病例数,对分析丙戊酸引起纤维蛋白原减少的发生率以及丙戊酸与纤维蛋白原减少之间的关系,具有重要的意义。
本研究的局限性包括:(1)样本量较小,此结论可能存在偏倚;(2)单中心研究无法完全避免医师的主观偏倚。故此结论有待大样本、多中心研究进一步证实。
[1]中华医学会神经病学分会脑电图与癫痫学组.抗癫痫药物应用专家共识[J].中华神经科杂志,2011,44(1):56-65.
[2]彭敏,邓楠.丙戊酸钠的血药浓度及其影响因素分析[J].中国药房,2013,24(26):2422-2426.
[3]曹丰,陈艳敏.丙戊酸钠血药浓度监测及意义[J].中国药物应用与监测,2005,6(2):23-25.
[4]NANAU RM,NEUMAN MG.Adverse drug reactions induced by valproic acid[J].Clin Bio Chem,2013,46(15):1323-1338.
[5]邹明,马虹英,龚志成.633例长期服用丙戊酸类药物癫痫患者的一般不良反应统计与分析[J].中国医院药学杂志,2011,31(3):256-258.
[6]何清,王菁华,刘亚林.丙戊酸钠注射液致血小板、纤维蛋白原严重减少[J].药物不良反应杂志,2005,7(6):433.
[7]董生,齐晓涟,胡永生.丙戊酸钠致7例患者血浆纤维蛋白原降低的初步调查[J].药物不良反应杂志,2008,10(6):409-411.
[8]齐晓涟,张小莉,董生.15例丙戊酸钠致血浆纤维蛋白原降低分析[J].药物流行病学杂志,2010,19(4):206-208.
[9]李锦梅,王丽丽.1例丙戊酸钠致低纤维蛋白原血症并颅内出血患者的护理[J].中国实用护理杂志,2012,28(35):38-39.
[10]陈海飞,李征洋,唐杰庆,等.丙戊酸钠导致低纤维蛋白原血症与颅内出血一例[J].中华血液学杂志,2012,33(8):682-682.
[11]CHEN HF,XU LP,LUO ZY,et al.Valproic acid-associated low fibrinogen and delayed intracranial hemorrhage:case report and mini literature review[J].Drug Des Devel Ther,2013.DOI:10.2147/DDDT.847718.
[12]陈海飞,李征洋,唐杰庆,等.丙戊酸导致低纤维蛋白原血症与颅内出血一例并文献复习[J].中国综合临床,2013,29(z1):155-156.
[13]孙欣,傅征然,陈春红,等.丙戊酸致癫痫患儿纤维蛋白原水平降低13例临床分析[J].药物不良反应杂志,2016,18(6):425-428.
[14]郭晨煜,郑文文,李凯敏,等.丙戊酸钠致血小板减少及低纤维蛋白原血症[J].药物不良反应杂志,2016,18(3):216-217.
[15]KOENIG S,GERSTNER T,KELLER A,et al.High incidence of valproate-induced coagulation disorders in children receiving valproic acid:a prospective study[J].Blood Coagul Fibrinolysis,2008,19(5):375-382.
[16]TONG V,TENG XW,CHANG KH,et al.Valproic acidⅠ:time course of lipid peroxidation biomarkers,liver toxicity,and valproic acid metabolite levels in rats[J].Toxicol Sci,2005,86(2):427-435.
[17]曾艳,刘立丽,闫素英.丙戊酸钠血清浓度接近或超过治疗浓度范围上限患者的肝功能、血常规结果分析[J].中国药物应用与监测,2013,14(2):66-70.
[18]ZIMMERMAN HJ,ISHAK KG.Valproate-induced hepatic injury:analyses of 23 fatal cases[J].Hepatology,1982,2(5):591-597.
[19]ISRAELIAN LA,LUBNIN AIU,TSEITLIN AM,et al.Hemostatic disorders caused by chronic use of valproic acid in neurosurgical patients.Thromboelastographic monitoring[J].Anesteziol Reanimatol,2010(4):50-54.
[20]BRENNAN SO,OLIVER J,DAVIS RL.Epigenetic,polymorphic and mutational(Aα 167Arg→Lys)contribution to a functionally abnormal flbrinogen[J].J Thromb Haemost,2011,9(7):1402-1410.
[21]TOPF HG,LISCHETZKI G,TROLLMANN R,et al.The effect of valproate therapy on thrombin generation determined by calibrated automated thrombography[J].Klin Padiatr,2011,223(3):165-168.

