炮制方法及提取溶剂对何首乌中主要成分含量的影响Δ
朱 敏,姚 毅,居文政,刘志辉,方祝元(南京中医药大学附属医院/江苏省中医院,南京 210036)
何首乌首载于《开宝本草》,为蓼科植物何首乌(Polygonum multiflorumThunb.)的干燥块根,临床使用有生熟之分,生何首乌苦、甘、涩,微温,功能为解毒消痈、截疟、润肠通便。制何首乌为生何首乌经蒸或煮后的炮制品,善补肝肾、益精血、乌须发、强筋骨[1],为滋补良药。含何首乌的复方制剂目前已广泛用于高脂血症、血管性痴呆、脱发、慢性肝炎、肝纤维化等多种疾病的治疗[2-3]。随着何首乌制剂的广泛应用,近年来,国内外临床上陆续出现因服用何首乌或含何首乌的制剂引起黄疸、肝功能异常、急性中毒性肝炎、慢性乙型肝炎等肝损伤的病例[4-7],引起了各国对何首乌及其制剂安全性的广泛关注。现代研究结果显示,何首乌中主要含有二苯乙烯苷类、蒽醌类、磷脂类及鞣质类成分,其中二苯乙烯苷类成分、大黄素等蒽醌类成分以及鞣质类成分与其肝毒性关系较大[8-10],不同提取溶剂提取后样品对何首乌的肝细胞毒性也有较大影响[11],本研究以何首乌生品及其不同方法的炮制品为研究对象,考察不同提取溶剂提取后对何首乌中所含没食子酸、二苯乙烯苷、大黄素、大黄素甲醚含量的影响,为规范何首乌的炮制及提取方法提供参考依据。
1 材料
1.1 仪器
2695-2996型高效液相色谱仪(美国Waters公司);BP-211D型电子天平(德国Sartorius公司);超纯水系统(美国Millipore公司);MZ-SYH26-2CB型电蒸锅(美的集团股份有限公司);KQ-1000型医用超声波清洗器(昆山市超声仪器有限公司)。
1.2 药材、对照品与试剂
生何首乌、制何首乌饮片均购自安徽省万生中药饮片有限公司(批号均为150301),经南京中医药大学附属医院朱育凤主任中药师鉴定为蓼科植物何首乌Polygonum multiflorumThunb.的干燥块根及其炮制品;黑豆(市售);没食子酸(批号:141109)、2,3,5,4′-四羟基二苯乙烯葡萄糖苷(以下简称二苯乙烯苷,批号:16081506)、大黄素(批号:151008)、大黄素甲醚(批号:17022010)4种对照品均购自成都普菲德生物技术有限公司(纯度:均≥98%);甲醇为色谱纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Symmetry-C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱(0~30 min,10%→80%A;30~40 min,80%→90%A;40~45 min,90%A;45~48 min,90%→10%A),流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;检测器:二极管阵列检测器;检测波长:270 nm(没食子酸)、320 nm(二苯乙烯苷)、254 nm(大黄素、大黄素甲醚)。取各供试品溶液及混合对照品溶液,按“2.1”项下色谱条件进样检测。各待测成分与相邻峰之间的分离度均>1.5,表明各成分互不干扰。
2.2 采用不同溶剂提取生品与炮制品
2.2.1 何首乌生品(S) 称取何首乌饮片生品4份,每份200 g,分别加8倍量溶剂(①水;②50%乙醇;③70%乙醇;④90%乙醇)浸泡1 h后,提取2次,合并2次提取液,减压浓缩干燥得干浸膏S1(水提生品)、S2(50%乙醇提生品)、S3(70%乙醇提生品)、S4(90%乙醇提生品)。
2.2.2 何首乌制品(Z) 称取市售何首乌制品4份,每份200 g,分别加8倍量溶剂(①水;②50%乙醇;③70%乙醇;④90%乙醇)浸泡1 h后,提取2次,合并2次提取液,浓缩干燥得干浸膏Z1(水提制品)、Z2(50%乙醇提制品)、Z3(70%乙醇提制品)、Z4(90%乙醇提制品)。
2.2.3 何首乌清蒸品(Q) 清蒸方法依据为2015年版《中国药典》(一部)方法[1]。取何首乌生品适量,加清水拌匀,润透,置于电蒸锅内,蒸汽加热至内外均呈棕褐色(每次加热约30 min,放凉后再加热,如此反复6次),切片干燥即得。取所得何首乌清蒸品4份,每份200 g,分别加8倍量溶剂(①水;②50%乙醇;③70%乙醇;④90%乙醇)浸泡1 h后,提取2次,合并2次提取液,浓缩干燥得干浸膏Q1(水提清蒸品)、Q2(50%乙醇提清蒸品)、Q3(70%乙醇提清蒸品)、Q4(90%乙醇提清蒸品)。
2.2.4 何首乌黑豆汁蒸品(H) 取何首乌生品适量,加黑豆汁拌匀,润透,置于电蒸锅内,蒸汽加热至内外均呈棕褐色(每次加热约30 min,放凉后再加热,如此反复6次),切片干燥即得。取所得何首乌黑豆汁蒸品4份,每份200 g,分别加8倍量溶剂(①水;②50%乙醇;③70%乙醇;④90%乙醇)浸泡1 h后,提取2次,合并2次提取液,浓缩干燥得干浸膏H1(水提黑豆汁蒸品)、H2(50%乙醇提黑豆汁蒸品)、H3(70%乙醇提黑豆汁蒸品)、H4(90%乙醇提黑豆汁蒸品)。
2.3 溶液的制备
2.3.1 混合对照品溶液 分别精密称定没食子酸、二苯乙烯苷(避光操作)、大黄素、大黄素甲醚对照品适量,用甲醇溶解后,制成质量浓度分别为5.06、4.53、1.29、2.66mg/mL的对照品贮备液。分别取适量置于10 mL量瓶中,加甲醇定容,制成质量浓度分别为0.51、0.45、0.13、0.27 mg/mL的混合对照品溶液。
2.3.2 供试品溶液 精密称取“2.2”项各干浸膏适量,加80%甲醇超声(功率:280 W,频率:53 kHz)溶解定容,离心(离心半径为7 cm,转速为13 000 r/min)10 min,取上清液即得。
2.4 线性关系考察
取“2.3.1”项下混合对照品溶液,倍比稀释,制成系列混合对照品溶液。精密量取上述系列混合对照品溶液各10 μL,按“2.1”项下色谱条件进样检测,记录峰面积,以峰面积积分值为纵坐标(y)、进样量为横坐标(x,μg),进行线性回归,得各成分的回归方程和线性范围;同时取该系列对照品溶液,逐渐稀释,当信噪比为10∶1时,得定量限。线性关系与定量限测定结果详见表1。
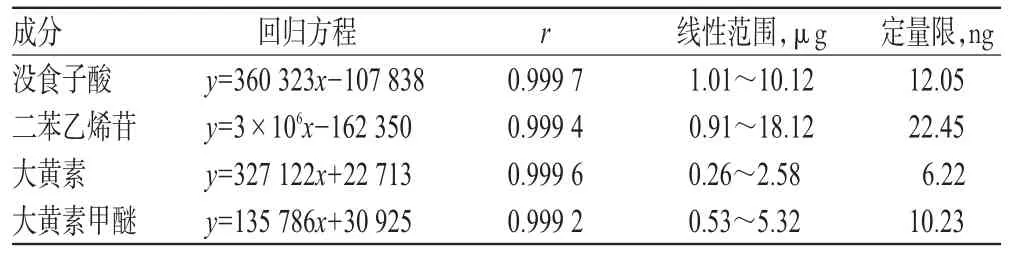
表1 线性关系与定量限测定结果Tab 1 Measurement results of linear relationship and limit of quantification
2.5 精密度试验
精密吸取混合对照品溶液10 μL,按“2.1”项下色谱条件连续进样6次,记录所测各成分的峰面积值。结果,没食子酸、二苯乙烯苷、大黄素、大黄素甲醚的峰面积RSD分别为0.08%、0.17%、0.25%、0.29%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.2.2”项下供试品溶液S1、S3,分别于室温下存放0、5、10、20、30、48 h后进样检测,记录供试品中各成分的峰面积。结果,同一样品中各成分在48 h内峰面积的RSD均不大于2.00%(n=6),表明供试品溶液在48 h内稳定性良好。
2.7 重复性试验
按“2.3.2”项下供试品溶液制备方法,制备S1、S3供试品溶液,各6份,按“2.1”项下色谱条件进样检测,记录待测各成分的峰面积。结果,2种供试品溶液中各成分峰面积的RSD均不大于3.00%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取已知4种成分含量的样品S1、S3各6份,分别精密加入一定量的对照品,制备供试品溶液,测定含量。计算得S1中没食子酸、二苯乙烯苷、大黄素、大黄素甲醚的平均加样回收率分别为96.34%、100.66%、102.09%、98.78%,RSD均不大于3.00%(n=6);S3样品中没食子酸、二苯乙烯苷、大黄素、大黄素甲醚的平均加样回收率分别为102.92%、101.75%、104.47%、98.61%,RSD均不大于3.00%(n=6)。
2.9 样品含量测定结果
各供试品溶液及混合对照品溶液的色谱峰见图1;依据各待测成分色谱峰峰面积,计算供试品中待测成分的含量,测定结果见表2。
由表2可知,何首乌炮制品(Z、H、Q)中二苯乙烯苷、没食子酸、大黄素、大黄素甲醚的含量均比生品(S)高。
以水为提取溶剂时,市售制何首乌饮片(Z1)较清蒸品(Q1)、黑豆汁蒸品(H1)中没食子酸的含量高;大黄素和大黄素甲醚的含量较低;黑豆汁蒸品中(H1)没食子酸、二苯乙烯苷、大黄素的含量均低于清蒸品(Q1)。
以50%乙醇为提取溶剂时,市售制何首乌饮片(Z2)中没食子酸、二苯乙烯苷和大黄素的含量均高于清蒸品(Q2)、黑豆汁蒸品(H2);黑豆汁蒸品(H2)中没食子酸、二苯乙烯苷的含量均低于清蒸品(Q2),大黄素、大黄素甲醚的含量均高于清蒸品(Q2)。
以70%乙醇为提取溶剂时,市售制何首乌饮片(Z3)中二苯乙烯苷、大黄素、大黄素甲醚的含量则均低于清蒸品(Q3)和黑豆汁蒸品(H3),没食子酸的含量则较后两者高;黑豆汁蒸品(H3)中二苯乙烯苷、大黄素、大黄素甲醚的含量高于清蒸品(Q3),没食子酸的含量则较清蒸品(Q3)低。
以90%乙醇为提取溶剂时,上述4种成分在市售制何首乌中的含量均低于清蒸品(Q4)和黑豆汁蒸品(H4),黑豆汁蒸品(H4)中没食子酸、二苯乙烯苷、大黄素、大黄素甲醚的含量均高于清蒸品(Q4)。
总的说来,3种何首乌炮制品的4种提取液中4种主要成分的含量均较生品中更高;没食子酸以水提时含量最高,二苯乙烯苷以90%乙醇提取时含量最低,大黄素和大黄素甲醚以50%和70%乙醇提取时含量较高;各炮制品中各成分的含量变化未呈现一定的规律性。
3 讨论
何首乌主要含有二苯乙烯类、蒽醌、磷脂、多糖及鞣质类成分[12],毒性成分的研究结果显示,其中的二苯乙烯苷,大黄素、大黄酚、大黄酸等蒽醌类以及鞣质类成分均有不同程度的肝毒性[13-15],然而大黄素等蒽醌类成分在其他中药中却未见有致肝损伤不良反应的报道,有研究表明蒽醌类成分尚具有保肝作用[16]。鞣质类成分虽有毒性相关的报道,但大多数中药中均含有鞣质,与肝毒性的发生不一定有相关性。何首乌中的二苯乙烯苷在2015年版《中国药典》(一部)中也是作为控制何首乌饮片质量的指标性成分。可见,现阶段关于何首乌致肝损伤物质基础的研究结果尚存在很大争议,部分结论甚至是对立的,研究认为,何首乌炮制后能降低其毒性,但炮制前后主要成分的含量变化,文献中的研究结论也存在较大差异[17-20]。
各版《中国药典》(1964版-2015版)中记载何首乌的炮制方法,主要为蒸或炖,所用辅料主要为水、黑豆汁和黄酒[1,21-22],2015年版《中国药典》(一部)中采用稀乙醇和甲醇加热回流的方法处理样品,对指标性成分二苯乙烯苷和蒽醌类成分分别进行含量测定,据此,本研究选用清蒸和黑豆汁蒸这2种方法对生首乌进行炮制,并用水及不同体积分数的乙醇对炮制前后的何首乌分别进行提取,用甲醇-0.1%磷酸水作为流动相进行目标成分的含量测定。研究结果显示,在本研究所用提取及检测方法下,各待测成分出峰情况较好,且分离效果较好。何首乌经炮制后,其主要成分二苯乙烯苷、鞣质类水解产物没食子酸及游离蒽醌类成分大黄素、大黄素甲醚的含量较生品均升高,其中二苯乙烯苷成分对光不稳定,需在避光条件下制备;市售制首乌饮片与传统清蒸、黑豆汁蒸何首乌在上述成分的含量上没有呈现有规律性的差异变化。本研究还发现,4种成分的含量与提取溶剂有较大的关系,没食子酸在水提液中比醇提液中含量高,二苯乙烯苷以90%乙醇提取后含量较低,大黄素和大黄素甲醚以50%和70%乙醇提取后含量较高。

图1 高效液相色谱图Fig 1 HPLC chromatograms

表2各样品含量测定结果[n=3,mg/g(生药)]Tab 2 Results of content determination of samples[n=3,mg/g(crude drug)]
现代研究认为,何首乌炮制后能显著降低其毒性[23],但2015年版《中国药典》(一部)中却未明确规定何首乌的炮制工艺参数,炮制工艺参数的不一致直接导致何首乌中成分的组成和含量的变化,从而产生不同程度的毒副作用。因此,何首乌减毒增效炮制工艺的规范化研究是其现代研究的基础和关键。
从现有研究结果看,毒性的改变不仅仅是炮制前后单一成分含量降低或升高的结果,可能与各主要成分含量的比例及成分间的相互作用有关,笔者后续将从成分相互作用的角度进一步研究何首乌炮制减毒的物质基础,为何首乌炮制机制的阐释提供依据。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:175-177.
[2]楼招欢,吕圭源,俞静静.何首乌成分、药理及毒副作用相关的研究进展[J].浙江中医药大学学报,2014,38(4):495-500.
[3]彭晓波.何首乌的研究与应用[J].中国现代药物应用,2008,2(19):117.
[4]俞捷,谢洁,赵荣华,等.何首乌肝脏不良反应研究进展[J].中草药,2010,41(7):1206-1210.
[5]朱云,刘树红,王伽伯,等.何首乌及其制剂导致药物性肝损伤的临床分析[J].中国中西医结合杂志,2015,35(12):1442-1447.
[6]张力,杨晓晖,邓媛瑗.何首乌及其制剂国外安全性信息的评价与思考[J].中国中药杂志,2009,34(18):2414-2418.
[7]葛珍珍,张超,冯光远,等.何首乌提取物对正常与荷肝癌小鼠的急性肝毒性研究[J].中国药房,2014,25(15):1358-1361.
[8]覃鲁珊,赵海平,赵艳玲,等.大黄蒽醌与鞣质对大鼠肝脏的保护和损伤双向作用[J].中国中西医结合杂志,2014,34(6):698-703.
[9]马喆,赵珺睿,董冉冉,等.基于高内涵分析技术的何首乌提取物及其主要成分肝毒性研究[J].中草药,2016,47(22):4021-4029.
[10]LI HL,WANG XB,LIU Y,et al.Hepatoprotection and hepatotoxicity of Heshouwu,a Chinese medicinal herb:Context of the paradoxical effect[J].Food Chem Toxicol,2017,108(Pt B):407-418.
[11]吕旸,王伽伯,嵇扬,等.提取溶剂对何首乌肝细胞毒性的影响[J].中国实验方剂学杂志,2013,19(20):268-272.
[12]LIN LF,NI B,LIN HM,et al.Traditional usages,botany,phytochemistry,pharmacology and toxicology of Polygonum multiflorum Thunb.:A review[J].J Ethnopharmacol,2015,159(15):158-183.
[13]LV GP,MENG LZ,HAN DQ,et al.,Effect of sample preparation on components and liver toxicity of Polygonum multiflorum[J].J Pharm Biomed Anal,2015,109(10):105-111.
[14]胡锡琴,李敏,杨红莲,等.何首乌中鞣质与二苯乙烯苷不同配比对大鼠肝功能指标的影[J].上海中医药杂志,2011,45(4):56-59.
[15]胡锡琴,李娅琳,王磊.何首乌中鞣质对大鼠肝脏生化指标的影响[J].药物评价研究,2010,33(1):63-65.
[16]LP SP,TSE ASM,POON MKT,et al.Antioxidant activities of Polygonum multiflorum Thunb:in vivo and in vitro[J].Phytother Res,1997,11(1):42-44.
[17]翟旭峰,李柯,娄勇军,等.中药何首乌炮制前后特征化学成分的分析[J].中南药学,2016,14(7):704-708.
[18]马致洁,李晓菲,吕旸,等.基于肝细胞毒价检测的何首乌炮制工艺比较研究[J].中国中药杂志,2015,40(12):2325-2329.
[19]ZHU ZW,LI J,GAO XM,et al.Simultaneous determination of stilbenes,phenolic acids,flavonoids and anthraquinones in Radix polygoni multiflori by LC-MS/MS[J].J Pharm Biomed Anal,2012,62(2):162-166.
[20]LIANG ZT,CHEN HB,YU ZL,et al.Comparison of raw and processed Radix Polygoni Multiflori(Heshouwu)by high performance liquid chromatography and mass spectrometry[J].Chinese Medicine,2010,12(5):29-37.
[21]卫生部药典委员会.中华人民共和国药典:一部[S].1963年版.北京:人民卫生出版社,1964:141-142.
[22]卫生部药典委员会.中华人民共和国药典:一部[S].1977年版.北京:人民卫生出版社,1978:430-431.
[23]WU XQ,CHEN XZ,HUANG QC,et al.Toxicity of raw and processed roots of Polygonum multiflorum[J].Fitoterapia,2012,83(3):469-475.

