黄诺马苷人工抗原合成及鉴定
郭佳佳,郭艳丽,兰 怡,李琳琳,王 烨,毛新民
(新疆医科大学1药学院,乌鲁木齐 830011;2附属中医医院,乌鲁木齐 830000;3中医学院,乌鲁木齐 830011)
黄诺马苷人工抗原合成及鉴定
郭佳佳1,郭艳丽1,兰怡2,李琳琳1,王烨1,毛新民3
(新疆医科大学1药学院,乌鲁木齐830011;2附属中医医院,乌鲁木齐830000;3中医学院,乌鲁木齐830011)
摘要:目的制备中药两色金鸡菊的活性成分黄诺马苷(Flavanomarein,FM)的人工抗原,为制备FM的单克隆抗体奠定基础。方法利用曼尼希法将FM与多聚赖氨酸(Poly-lysine,PLL)偶联,并采用薄层色谱法进行鉴定,皮下免疫BALB/c小鼠,采用间接ELISA和间接竞争ELISA法对小鼠血清的抗体进行效价与特异性检测。结果薄层色谱结果显示FM与PLL偶联成功;间接竞争ELISA结果显示,采用FM-PLL免疫的3号小鼠产生了抗FM的抗体(Y=-0.037 2X+0.862 1,R2=0.969。结论成功合成了黄诺马苷人工抗原,为进一步研究FM的免疫学检测方法提供了实验基础。
关键词:黄诺马苷;人工抗原;BALB/c小鼠;ELISA
中图分类号:R284.1
文献标识码:A
文章编号:1009-5551(2018)05-0615-05
doi:10.3969/j.issn.1009-5551.2018.05.021
基金项目:NSFC-新疆联合基金重点项目(U1303223);省部共建中亚高发病成因与防治国家重点实验室
作者简介:郭佳佳(1990-),女,硕士,研究方向:糖尿病药理学。
通信作者:毛新民,男,博士,教授,博士生导师,研究方向:糖尿病药理学,E-mail:mxm3277@sina.com。
本文引用:郭佳佳,郭艳丽,兰怡,等.黄诺马苷人工抗原合成及鉴定[J].新疆医科大学学报,2018,41(5):615-618,624.doi:10.3969/j.issn.1009-5551.2018.05.021
SynthesisofFlavanomareinArtificialAntigenandDetermination
GUOJiajia1,GUOYanli1,LANYi2,LILinlin1,WANGYe1,MAOXinmin3
(1SchoolofPharmacy,Urumqi830011,China,2TheAffiliatedTraditionalChineseMedicineHospital,Urumqi830000,China,3CollegeofTraditionalChineseMedicine,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo synthesize the antigen of flavanomarein(FM),an active component of Coreopsis tinctoria,for the preparation of monoclonal antibodies against FM,and to provide a technical basis for the rapid detection of FM by enzyme-linked immunosorbent assay(ELISA).MethodsFM was conjugated to poly-lysine(PLL)using Mannich method and identified by TLC.BALB/c mice were immunized subcutaneously,and the antibodies potency and specificity of mouse serum were determined with indirect ELISA and indirect competitive ELISA assay.ResultsThe results of TLC showed that FM artificial antigen was successfully synthesized.The results of indirect competitive ELISA showed that No.3 mice immunized with FM-PLL produced anti-FM antibodies(Y=-0.037 2X+ 0.862 1,R2=0.969).ConclusionFlavanomarein artificial antigen were synthesized successfully,which provided the experimental basis for further study of FM immunological detection.
Keywords:flavanomarein;artificial antigen;BALB/c mice;ELISA
两色金鸡菊(Coreopsis tinctoria)又名雪菊,属于菊科(Compositae)金鸡菊属(Coreopsis)的干燥头状花序,通常为单瓣、重瓣或半重瓣,舌状花,黄色或者金黄色,其花期在6~9月。
金鸡菊属于北温带的植物,其原产地为北美地区,在国内新疆的和田有较为丰富的雪菊。两色金鸡菊记载于《新疆植物志》,同雪莲一样珍贵,都是较为珍贵的药材之一[1]。在著名的《新华本草纲要》中曾这样记载两色金鸡菊,两色金鸡菊全草名曰蛇目菊,具有清热解毒、活血化痰的功效,现代药学研究也同样表明其具有降血糖[2-3]、降血压、降血脂[4-5]、抗氧化[6-7]、抗癌[8-9]、抗炎[10]、抗病毒[11]等功效,在临床上也用于治疗高血压和冠心病[2,12-15]。在民间,人们常用雪菊的头状花序泡茶饮用,因为雪菊在心血管疾病方面具有显著的防治作用[16]。
目前,从两色金鸡菊中分离得到共计18种黄酮类化合物,其母核包括黄酮类、黄酮醇类、查耳酮类、二氢黄酮类、异黄酮类及橙酮类[1]。本课题组前期研究表明:两色金鸡菊醇提物单次灌胃给药后,检测出黄诺马苷(异奥卡宁-7-O-β-D-吡喃葡萄糖苷)以原型成分入血,在小鼠心、肝、脾、肺、肾、脑各组织中均检测出黄诺马苷。因此,本研究旨在合成黄诺马苷的人工完全抗原,为制备单克隆抗体提供基础[17]。
1 材料与方法
1.1试剂与仪器仪器:微量可调移液器(Eppendorf,德国);分析天平(DTG 160,上海精密科学仪器有限公司);磁力搅拌器(海门其林贝儿);卡马半自动点样仪(CAMAG-LINOMAT-5,瑞士);卡马薄层色谱数码成像系统(CAMAG REPROSTAR-3,瑞士);硅胶G板(青岛海洋化工厂)。试剂:黄诺马苷标准品(EXTRASYNTHESE,法国);DMSO(Sigma公司,美国);多聚赖氨酸(Sigma公司);无水二甲基甲酰胺(DMF,北京索莱宝公司);乙烷磺酸(MES,Sigma公司);弗氏完全佐剂(FCA,Sigma公司);弗氏不完全佐剂(FIA,Sigma公司);HRP-羊抗鼠(Genesgript,美国);TMB显色液(北京索莱宝公司);Na2CO3分析纯(天津永晟精细化工有限公司);NaHCO3分析纯(天津永晟精细化工有限公司);甲醇(天津永晟精细化工有限公司);乙酸乙酯(天津永晟精细化工有限公司);无水乙醇(天津永晟精细化工有限公司);冰乙酸(天津市豪宇精细化工有限公司)。
1.2方法
1.2.1曼尼希法[18]制备黄诺马苷人工抗原3mg PLL溶于750μL MES中,作为A液;3mg FM溶于250μL 无水DMF(二甲基甲酰胺)中,加入250μL甲醛(37 %),作为B液;将A液缓慢加入到B液中,37℃条件下避光搅拌反应24h;磷酸盐缓冲液(PBS)透析72 h,中间多次换PBS,收集液体,-20℃保存待用。
1.2.2人工抗原薄层色谱法鉴定首先活化高效液相硅胶G板,将薄层板G板置于105℃活化30min。用蒸馏水配制1mg/mL的黄诺马苷与PLL标准溶液,并配置适宜浓度的合成产物溶液,实验前处理样品。并过0.22 μm滤膜,备用。配置展开剂,使其充分混匀(展开剂为乙酸乙酯∶丙酮∶冰醋酸∶水=8∶4∶0.3∶1),向展开缸倒入展开剂10mL左右浸没缸底一侧。然后使用自动点样仪依次点样,将点好样的薄层板放入展开缸未倒展开剂一侧,盖上盖子饱和15~30min。然后将饱和过的薄层板放入有展开剂的一侧开始展开,至上缘1~2cm处停止展开。取出薄层板,晾干。用1%的AlCl3溶液显色,105℃加热1min,放入紫外灯(365 nm)下显色拍照。
1.2.3动物免疫饲养8周龄雌性BALB/c小鼠4只,由新疆医科大学实验动物中心提供,动物许可证号:SYXK(新)2016-0002,实验动物质量合格证号:No.00001150。FM-PLL免疫3只,另外一只不进行免疫作为阴性对照。免疫方法如下:初次免疫,免疫剂量为100μg/只,根据BCA试剂盒检测蛋白浓度,将FM-PLL用生理盐水稀释为1mg/mL,并与等体积的弗氏完全佐剂(Freund's complete adjuvant,FCA)混合,用移液枪反复吹打,直到形成油包水(W/O)状态,即取一滴乳化物滴到水中长时间不分散。采用背部皮下多点注射的方式免疫小鼠(200μL/只);2周后进行第一次免疫,取同免疫原等体积的弗氏不完全佐剂(Freund′s incomplete adjuvant,FIA)将免疫原充分乳化,进行背部皮下多点注射(200μL/只);此后每隔2周进行加强免疫1次,方法同第二次。第二次加强免疫后1周,尾尖采血取少量血,37 ℃放置30min后,然后以3000 rpm/min离心10min,分离血淸,置于-20℃冰箱保存待测。
1.2.4间接ELISA法测定血清中抗体的效价首先采用棋盘滴定法优化酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)方法中包被原、二抗和封闭液等浓度的条件,然后进行相关的检测。具体方法如下:以FM-PLL为包被抗原,免疫后的小鼠血清作为一抗,在450 nm处,同一稀释倍数下抗血清与阴性血清OD比值(P/N)>2.1定义为阳性,以血清的最大稀释倍数定义为该血清的效价。间接ELISA方法如下:(1)包被:将FM-PLL用CBS稀释至1∶1000作为包被原,以100μL/孔加入96孔酶标板中,37℃孵育2h。PBST洗板3次,每次2min。(2)封闭:采用10mg/mL明胶作为封闭液,200μL/孔,37 ℃孵育1h。以PBST洗板3次,每次2min,拍干。(3)加一抗:将抗血清和阴性血清用PBS稀释500、1000、2 000、4000、8 000、16 000倍,100μL/孔,37℃孵育1h。以PBST洗板3次,每次2min,拍干。(4)加二抗:将HRP-羊抗鼠二抗用PBS稀释15 000倍,100μL/孔,37℃孵育30min。以PBST洗板3次,每次2min,拍干。(5)显色:采用TMB显色液显色,100μL/孔,37℃孵育15min。(6)终止:每孔加入2mmol/L硫酸50μL终止反应,在15min内450 nm处测定OD值。
1.2.5间接竞争ELISA法测定抗血清中抗体的特异性此方法与间接ELISA法基本相似,只是在加入一抗50μL的同时加入同体积50μL的黄诺马苷小分子,加入黄诺马苷小分子的浓度越高,抗血清的抗体与包被原结合的抗体就越少,在450 nm处测得的OD值就越低,以此可以辨别抗血清中的抗体是否可以特异性的结合黄诺马苷,小分子浓度为:0.001、0.01、0.1、1、10μg/mL。
2 结果
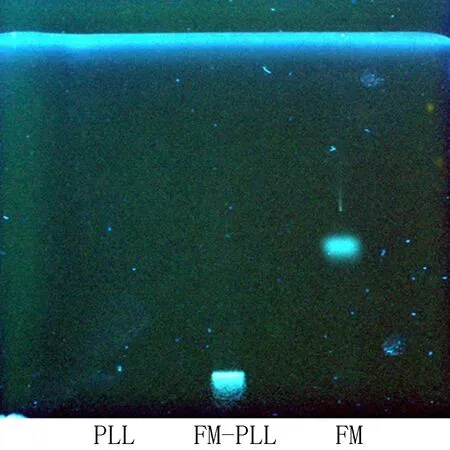
2.1FM-PLL的薄层鉴定在相同的展开条件,365 nm紫外灯照射下,FM在相应的位置呈显著的荧光斑点;由于PLL是大分子蛋白物质,在相同的展开条件,展开后仍在原点位置,同时在365 nm紫外灯照射下也不会呈现相应的荧光斑点;在相同的展开条件,365 nm紫外灯照射下,合成产物FM-PLL并没有在与FM相同的位置,而是在原点位置显示了相应的荧光斑点,结果见图1。由此可以判断,该人工抗原的偶联是成功的,并且合成物无小分子斑点,表明完全纯化去除小分子。
2.2间接ELISA法检测抗血清效价随着血清稀释倍数的增加,1、2、3号小鼠抗血清的OD450值呈逐渐下降的趋势,阴性小鼠抗血清的OD450值不随血清稀释倍数的增加而变化,结果如表1、图2所示。在450 nm处,同一稀释倍数下抗血清与阴性血清OD比值(P/N)>2.1定义为阳性,结果显示三只小鼠均为阳性,显示均产生了抗体,其中2号效价最高,大于16 000,1号和3号效价偏低,在4000,见表2。
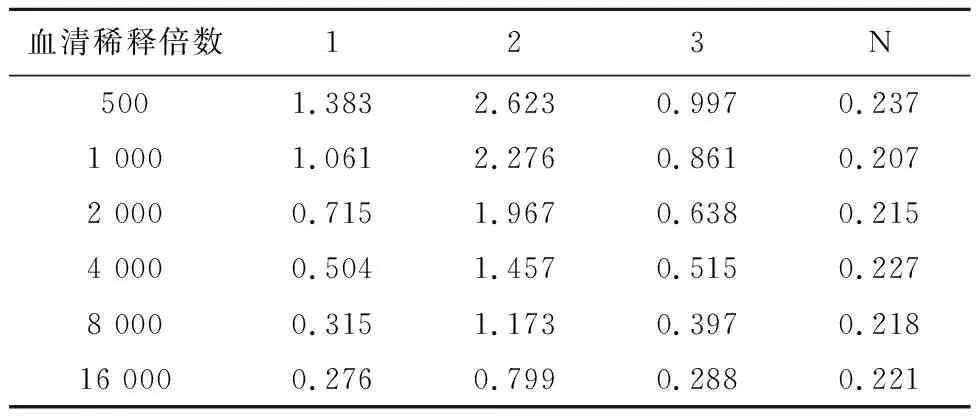
表1 FM-PLL抗血清效价OD450值

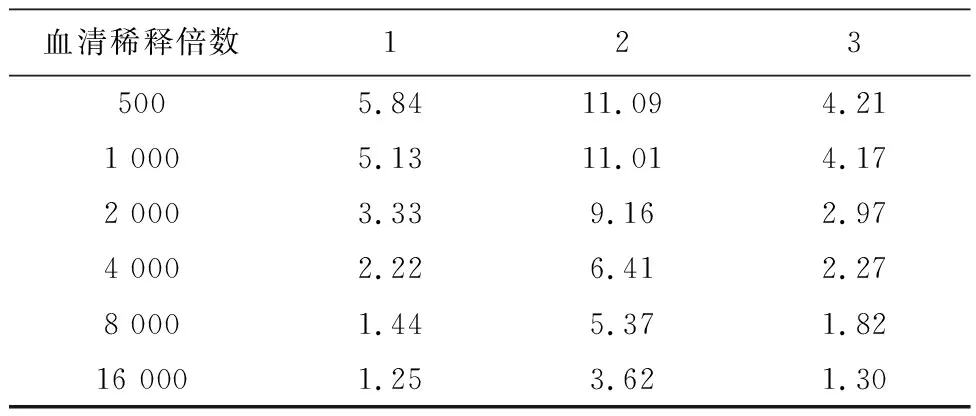
血清稀释倍数1235005.8411.094.21 1 0005.1311.014.17 2 0003.339.162.97 4 0002.226.412.27 8 0001.445.371.82 16 0001.253.621.30
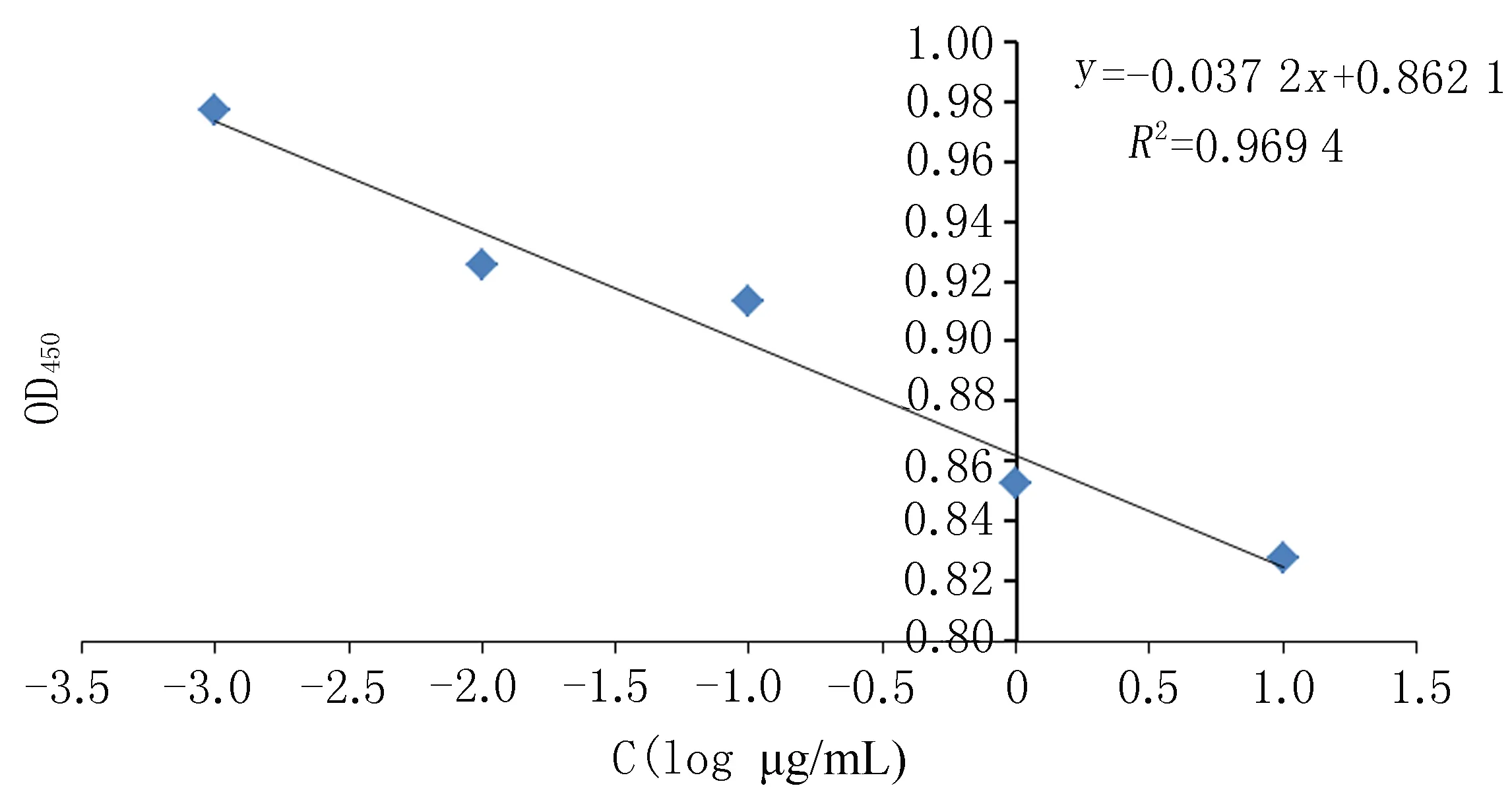
2.3间接竞争ELISA法测定抗血清中抗体的特异性利用包被原与加入的小分子竞争性与血清中抗体结合;小分子浓度越高,血清中抗体与包被原上抗原结合越少,OD450值越低。从表3数据可以看出,随小分子浓度的增加,1号和2号小鼠的OD450值并无明显变化,而3号小鼠随小分子浓度的增加,OD450值逐渐降低,表明其可以特异性结合小分子。如图3和表4所示,3号小鼠间接竞争ELISA结果显示:Y=-0.037 2X+0.862 1,R2=0.969,OD450值随黄诺马苷溶液浓度的增加而降低,表示该抗体可以特异性的结合黄诺马苷小分子,说明产生了抗目标小分子黄诺马苷的抗体。
3 讨论
两色金鸡菊中活性成分黄诺马苷的分子量为450.4,属于小分子半抗原,只具有免疫反应性,而不具有免疫原性,因此不能直接激发免疫系统识别并产生相应的抗体。通常情况下,大分子蛋白具有明显的抗原性,可诱导免疫应答并激发脾细胞分泌出相应的抗体。因此,黄诺马苷必须与大分子蛋白偶联制备成人工抗原,进而诱导免疫应答并激发脾细胞分泌出相应的抗体。中药的成分非常复杂,但是利用免疫亲和色谱柱可以将中药中的某种活性小分子去除,并且不会破坏中药的其他成分,然后取去除前后的中药进行药理实验,不仅可以方便的表现出该中药活性小分子在体内的分布和代谢过程,同时也能揭示出该活性小分子在中药中的作用。

表3 FM-PLL间接竞争ELISA OD450值

表4 FM-PLL间接竞争ELISA
目前,有很多人工抗原合成的方法,如高碘酸钠氧化法、曼尼希法、碳二亚胺法、活泼酯法、戊二醛法、琥珀酸酐法等[19]。由于半抗原被利用的连接基团或部位不同而产生了不同的偶联方法,进而决定了半抗原表位构型的表达差异,不同的偶联方法不仅可以影响到半抗原的免疫原性,更决定着其免疫抗体的特异性[20]。
目前,国内外尚未见黄诺马苷人工抗原的制备,本课题组前期采用高碘酸钠氧化法将黄诺马苷和牛血清白蛋白(BSA)进行偶联,其原理是将糖基上的邻二羟基结构氧化为醛基,醛基再与蛋白上的氨基结合得到稳定的以碳-氮单键连接的结合物,从而实现了黄诺马苷与载体蛋白的偶联。薄层结果显示偶联成功,但免疫小鼠后,间接竞争ELISA结果显示小鼠血清对小分子无特异性,分析其原因可能由于高碘酸钠在氧化糖基上邻二羟基结构的同时破坏了黄诺马苷分子中其他邻二羟基结构,也有可能BSA的结构不易暴露氨基等等。因此,本实验参考文献[18],采用了曼尼希法合成黄诺马苷人工抗原,将黄诺马苷与更易暴露氨基的载体蛋白多聚赖氨酸偶联。经薄层色谱法检测,偶联物不随展开剂展开,而停留在点样原点,显现出蛋白特征,但经显色剂处理后,在点样处可见明显色斑,与黄诺马苷对照品的颜色一致,说明停留在原点的偶联物同时又具有小分子的特征,由此可见,黄诺马苷与载体蛋白偶联成功。将合成的人工抗原免疫小鼠后,从间接ELISA的结果可以看出,1、2、3号小鼠均具有良好的效价,结合间接竞争ELISA的结果可以看出,3号小鼠的血清与黄诺马苷有着竞争抑制现象,说明3号小鼠产生了抗目标小分子黄诺马苷的抗体。
中药中有很多活性成分,因此分析检测时有一定的难度,对于这类化合物建立快速、灵敏、特异性强的检测方法以及对中药和复方中微量有效成分的检测,探索中药小分子活性成分的作用机制等方面具有非常重要的意义。基于抗体特异性的免疫分析方法如ELISA具有以下优点:耗时少、可以大批量的处理样品、灵敏度和准确度均较高,并且有多种技术形式,此外,将免疫分析方法应用于中医药的研究具有广阔的前景[21]。因此,通过合成黄诺马苷人工抗原,进而产生抗黄诺马苷的特异性抗体,建立相应的免疫分析方法,为从新的角度进一步考察两色金鸡菊中的活性成分黄诺马苷的作用打下了一定的技术基础。基于小分子单克隆抗体的中药活性成分免疫学分析方法,具有以下优点:灵敏度高,特异性强,前处理非常简单,高通量,且不依赖贵重的仪器,操作也较为简便[22-23]。本实验旨在制备黄诺马苷的人工抗原,免疫小鼠产生抗黄诺马苷的抗体为后期制备细胞融合得到抗体以及敲除雪菊中黄诺马苷奠定基础。
[收稿日期:2017-12-19]
(本文编辑王艳)

