绵羊MHC-DQB2 exon3单倍型的构建及其与布鲁氏菌病易感性相关性
严 国, 王元元, 罗 成, 齐江姣, 牟 云, 高剑峰
(石河子大学生命科学学院,新疆石河子 832003)
布鲁氏菌病简称布病,是由布鲁氏杆菌引起的严重危害人民健康和农牧业发展的人畜共患传染病,是《中华人民共和国传染病防治法》规定的乙类传染病,羊为该病最主要的传染源[1]。调查显示,2012—2014年新疆牛羊布病阳性率呈逐年上升趋势[2]。因此,这一疾病对新疆这一畜牧业主产区所造成的损失也逐年增长,遏制该疾病的传播已成为亟待解决的重大问题。
主要组织相容性复合体(major histocompatibility complex,MHC)是脊椎动物的高度多态性基因群[3]。MHC蛋白的主要功能是抗原递呈,在机体的免疫系统中发挥着至关重要的作用,与许多疾病的抗病性和易感性密切相关,MHC作为相关性研究的候选基因,受各研究领域的密切关注,已经成为现代分子遗传研究的焦点。绵羊的MHC位于20号染色体,MHCⅡ区与人的相似,区域内的 DQ 和 DR 2个基因家族表现丰富的多态性[4],而绵羊的多态性更集中在 DQ 家族[5-7]。
单核苷酸多态性(single nucleotide polymorphism,SNP),是指由单个碱基的变化引起DNA序列发生改变的多态性,是基因组序列内最为常见的变异形式。SNP作为第三代分子遗传标记,本身具有显著特点,如数量多、分布广泛、且稳定遗传等[8]。这些特点在疾病相关基因的研究中发挥着尤为重要的作用,尤其是那些位于基因编码区的SNPs,可能会使基因编码的蛋白质的产量或质量发生改变,使其与某种疾病的发生直接相关,因而备受各研究领域的关注[9]。由于单个SNP在复杂疾病中所起到的作用微小[10-11],而由SNPs构建的单倍型提供的遗传信息却比单个的SNP更多、更准确、更符合多基因疾病的遗传性,所以单倍型分析越来越成为复杂疾病关联研究的有效工具,这为相关免疫性状的关联研究及抗病分子标记辅助选择奠定了一定的基础。因此,本研究通过 PCR-SSCP 技术结合测序的方法检测哈萨克羊的MHC-DQB2 exon3的多态位点,探讨SNPs与布鲁氏菌病易感性相关性,此外构建其单倍型,并初步推测与布鲁氏菌病易感性相关的单倍型,为今后开展布鲁氏菌抗性分子标记辅助选择研究提供了一定的依据,为进一步定位具有易感性的遗传位点而最终进行抗病育种奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 样本来源 本试验所用血液样本部分(45支)来自于新疆维吾尔自治区畜牧兽医站,全部为布鲁氏菌病阳性;部分(100支)采自新疆乌苏市3个羊场,以颈静脉采血法采血 5 mL 于肝素钠抗凝管,4 ℃保存,以备基因组DNA提取。
1.1.2 主要试剂 布鲁氏菌检测试剂盒购自哈药集团生物疫苗有限公司;Tris平衡酚购自北京索莱宝科技有限公司;引物由北京六合华大基因科技股份有限公司合成;琼脂糖为西班牙琼脂糖(Biowest Agarose);2×TaqPCR Master Mix 和 DL 2000 marker购自北京天根公司;过硫酸铵购自美国Sigma公司;丙烯酰胺、甲叉双丙烯酰胺、TEMED购自美国Promega公司;亲和硅烷、剥离硅烷购自北京鼎国生物技术中心。
1.2 试验方法
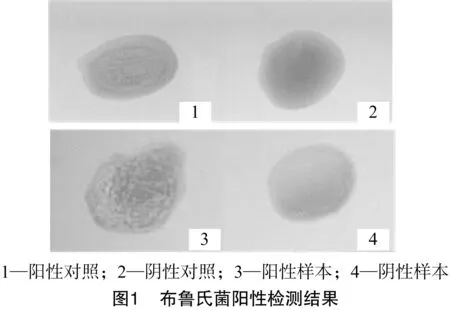
1.2.1 布鲁氏菌阳性检测 采用虎红平板检测法对100只哈萨克绵羊进行布鲁氏菌检测,在干净载玻片上取30 μL被检绵羊血清与等量的虎红平板抗原混合均匀,在5 min内以阳性血清反应为对照,观察并记录结果,被检血清出现较为明显的颗粒状或絮状凝集则判定为布鲁氏菌阳性,否则判定为阴性。以同样的方法对所有样品重复检测2次,以确保检测结果准确。
1.2.2 基因组DNA的提取与检测 基因组DNA的提取:取2 mL无明显血凝块的新鲜血液,采用酚-氯仿法对其进行基因组DNA提取。
DNA纯度与浓度的检测:采用生物光谱计检测DNA纯度和浓度,用Plate assay法和琼脂糖凝胶电泳法对DNA验证的浓度及纯度进行验证,并对高浓度样品进行适当稀释,于 -18 ℃ 保存备用。
1.2.3 引物设计 参照绵羊MHC-DQB2的基因序列(GenBank登录号:EU176819),利用引物设计软件 Primer Premier 5.0设计该基因exon3的特异引物。引物序列为:F:5′-CCTCAGTGGAACCTACAGTGACC-3′;R:5′-TGCCC TTACTCCACTCCACCG-3′。
1.2.4 PCR扩增 PCR扩增体系为:上下游引物各 0.75 μL,模板3.5 μL,无菌双蒸水7 μL,2×TaqPCR Master Mix 8 μL,总体积20 μL。PCR扩增程序:94 ℃预变性5 min;94℃变性30 s,55 ℃复性30 s,72 ℃延伸40 s,35 个循环;72 ℃ 延伸8 min;4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测,经凝胶成像系统拍照保存。
1.2.5 SSCP电泳 取3 μL的PCR产物与10 μL的变性上样缓冲液(去离子甲酰胺9.5 mL;0.3%二甲苯青0.1 mL;0.5 mol/L EDTA 0.4 mL,pH值8.0)充分混匀,于PCR仪 98 ℃ 变性10 min,立即冰浴骤冷至少3 min,低温恒温循环系统温度恒定至9 ℃,取10 μL变性产物上样于10%的非变性聚丙酰胺凝胶(Acr ∶Bis=39 ∶1),300 V预电泳15 min,而后3 W恒定功率过夜电泳10 h。次日电泳结束后,银染显色并在X光片观片灯上分析带型并拍照保存。
1.2.6 PCR扩增及测序 经PCR -SSCP分析之后,选取不同基因型样本,重新进行PCR扩增并电泳检测后,送至北京六合华大基因公司进行测序。测序结果用DNASTAR软件进行比对分析。
1.2.7 数据统计及分析 利用Excel整理统计数据,采用χ2适合性检验法分别分析病例组与正常组哈萨克羊MHC-DQB2基因exon3多态位点的基因频率和基因型频率是否符合Hardy-Weinberg(HWE)平衡定律,P>0.001表示无统计学差异,符合Hardy-Weinberg平衡定律,反之P<0.001 则说明不符合Hardy-Weinberg平衡定律。所有统计学分析均采用SPSS 17.0统计软件包,通过比较分析每个SNP的基因频率或基因型频率分别在病例组和正常组中的差异性,从而分析其与布鲁氏菌病易感性的相关性。
1.2.8 单倍型构建 去除等位基因频率<0.05以及不符合Hardy-Weinberg平衡定律的SNPs位点,选择同时符合以上2个条件的位点,用SHEsis在线软件进行单倍型的构建,取连锁不衡系数(D′值)作为连锁不平衡指标。
2 结果与分析
2.1 布鲁氏菌检测
采用虎红平板凝集试验检测绵羊种布鲁氏菌阳性,结果在100个哈萨克羊个体中检出布鲁氏菌阴性个体84个,阳性个体为16个,布鲁氏菌阳性检出率为16%,检测结果如图1所示。
2.2 基因组DNA的提取电泳检测
哈萨克羊全血中提取的基因组DNA经生物光谱计和Plate assay法检测,发现基因组DNA浓度在40~1 000 μg/mL。纯度经1%的琼脂糖凝胶电泳检测,出现整齐、清晰的单一条带,符合后期试验要求。
2.3 MHC-DQB2基因的PCR扩增结果检测
将哈萨克羊MHC-DQB2 exon3 PCR扩增产物于1%的琼脂糖凝胶检测,检测结果与DL 2000 marker比较与预期的相符,因而判断为目的片段。
2.4 SSCP分析
分别对病例、正常组哈萨克羊个体MHC-DQB2 exon3的PCR扩增产物进行SSCP电泳,部分电泳结果见图2。由于本试验应用PCR-SSCP方法具有高度灵敏性,所以出现的基因型比较多,是否还有一些其他未检测出的基因型,还有待于扩大样本数量以进一步研究。
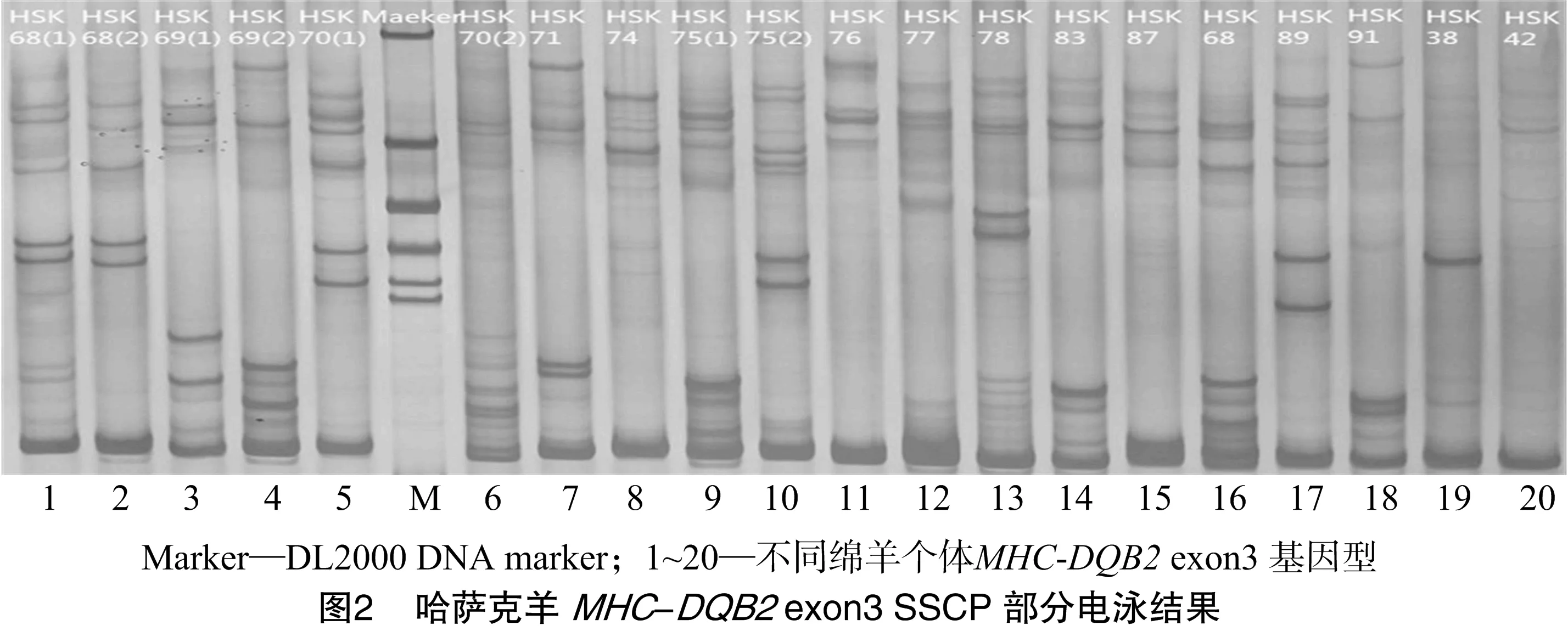
2.5 哈萨克羊MHC-DQB2基因exon3 SNPs分析
通过PCR-SSCP技术及测序的序列比对结果分析,哈萨克羊MHC-DQB2基因exon3在282 bp内共发现22个多态位点,经Hardy-Weinberg平衡定律检验无差异统计学意义,表明具有群体代表性。这些位点中不存在插入和缺失位点,有1个位点属于四态性,1个位点属于三态性,其余20个位点属于二态性。这些二态性位点中转换位点有16个,包括8个A/G转换位点和8个C/T转换位点;颠换位点有4个,包括A/T颠换位点2个,A/C、G/C颠换位点各1个。相比而言,转换率为颠换率的4倍,这可能是因为CpG(碱基C、G以及连接两者的磷酸酯键 p)结构上的胞嘧啶残基是基因组中最易发生突变的位置,大多数是甲基化的,可自发地脱去氨基形成碱基T,因此导致了C→T(互补链上G→C)的突变增多,从而导致了转换位点远高于颠换位点[12]。
2.6 哈萨克羊MHC-DQB2基因exon3的单氨基酸多态性(SAP)分析
对哈萨克羊DQB2 exon3氨基酸序列进行分析,在93个氨基酸位点中,有20个属于氨基酸多态位点,占总氨基酸位点数的21.5%。其中,有6个氨基酸突变为有义突变,其余均为无义突变(表1)。
2.7 哈萨克羊MHC-DQB2 exon3多态性与布鲁氏菌病易感性的关系
许多疾病的抗性和易感性都与MHC有关联,作为针对某些疾病的抗性和易感性的候选基因的MHC,已经成为现代分子免疫遗传的研究热点之一。本研究对MHC-DQB2基因的多态性与布鲁氏菌病易感性进行关联分析发现,MHC-DQB2可能是与布鲁氏菌病易感性相关的基因之一。哈萨克羊MHC-DQB2 exon3 每个SNP的等位基因及基因型频率在病例组和正常组中的分布差异见表2、表3,其中140 A/C/T/G位点、155T/C的等位基因在病例和正常样本中的分布存在显著差异(P<0.05),初步分析认为MHC-DQB2 exon3的140 A/C/T/G、155T/C与绵羊布鲁氏菌病易感性相关,相关的研究内容目前尚未见报道。针对该基因每个多态位点的基因型进行关联分析,发现位点AA/Aa/aa基因型在病例和正常样本中的分布无显著差异(P>0.05)。
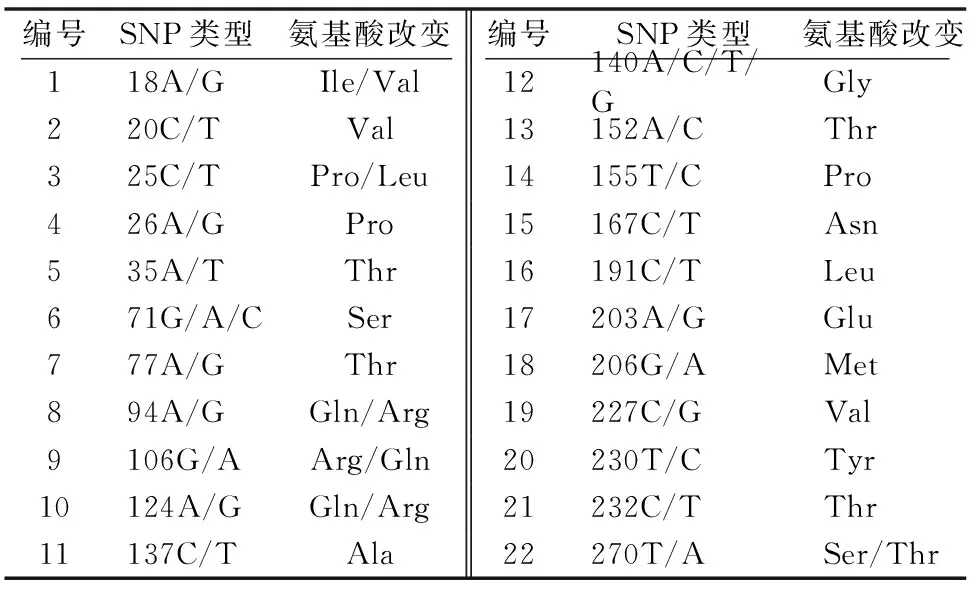
表1 哈萨克羊MHC-DQB2基因exon3的SNPs位点及氨基酸变异位点

表2 中国美利奴羊MHC-DQB2基因exon3基因频率
注:“*”表示病例组与正常对照组中国美利奴羊MHC-DQB2相同等位基因间差异显著(P<0.05)。
2.8 病例和正常组MHC-DQB2 exon3的连锁不平衡分析及单倍型的构建
对符合Hardy-Weinberg平衡定律的SNPs位点进行连锁不平衡分析,通过SHSsis在线软件[13]计算连锁不平衡系数D′值,观察各位点之间的连锁不平衡程度,判断是否存在连锁不平衡。在MHC-DQB2 exon3的22个SNPs位点中,最终筛选出符合条件的18个位点进行单倍型的构建,连锁不平衡图见图3。方格内数字就是连锁不平衡系数D′值乘以100譬如99表示D′=0.99。D′值越大,意味着相关联的2个SNPs间连锁不平衡程度越强。通常认为D′>0.9为高度连锁,D′>0.7 认为2个SNPs位点位于同一个Block区域,可以进行单倍型分析。图3中各个方块的颜色由浅至深,表示连锁程度由低到高。经连锁不平衡分析发现整个MHC-DQB2 exon3存在7个LD Block(表4),将其依次命名为Block1~Block7。
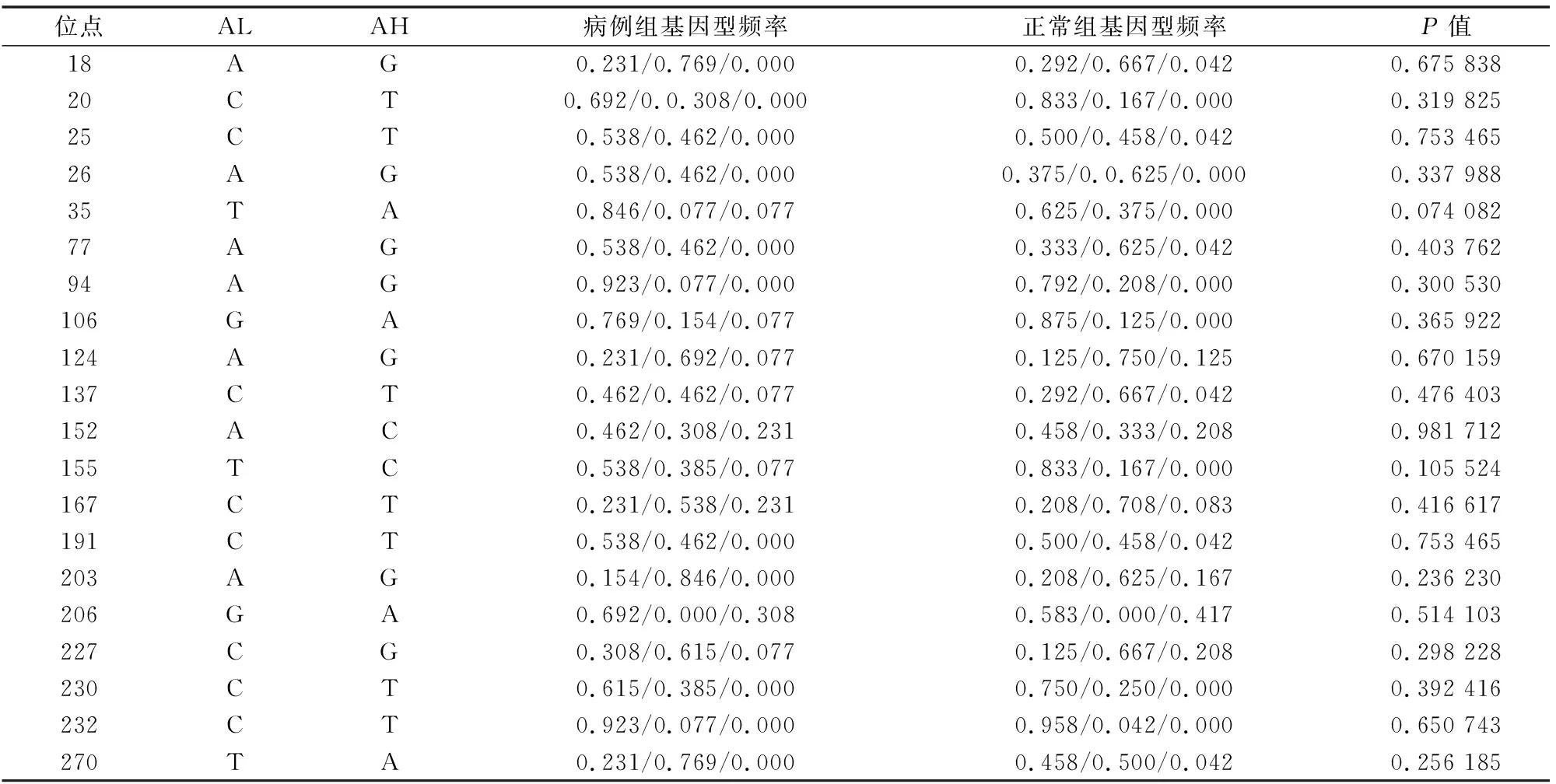
表3 中国美利奴羊MHC-DQB2基因exon3基因型频率
注:基因型表示为AA/Aa/aa(其中A代表高频率等位基因;a代表低频率等位基因); AH代表高频率基因名称;AL代表低频率基因名称。

由于一个群体中单倍型的频率不能<0.03,因此单倍型频率未达到0.03的未参与统计,对应的单倍型组合也应忽略,SHEsis在线软件在单倍型分析过程中,系统会自动删除不符合条件的单倍型组合,因而哈萨克羊MHC-DQB2 exon3最终分析了21种单倍型组合(表3、表4),经分析发现在病例组中Hap4、Hap6频率都显著低于正常组(P<0.05),这表明这2个单倍型可能与布鲁氏菌病抗性有关,或者说具有这2个单倍型的个体对布鲁氏菌病不易感,其中,Hap6频率在病例和正常组中存在极显著差异(P<0.01);病例组Hap9频率显著高于正常组(P<0.05),表明具有这一单倍型的个体可能更易感布鲁氏菌病。综合推测,这2种单倍型可能与布鲁氏菌病易感性具有相关性。
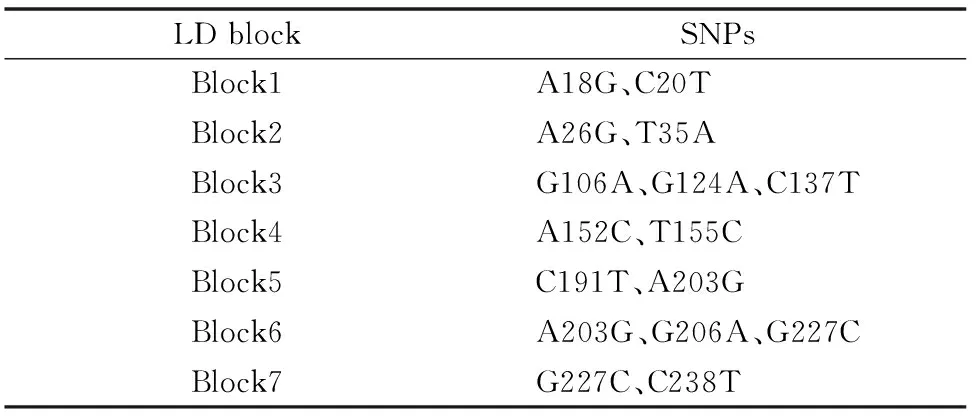
表4 每个连锁不平衡 block 中 SNPs 组成
3 讨论
MHC ClassⅡ区段是一段具有高度多态性的基因,相对于人而言,绵羊的基因多态性在DQ区较之DR区更为丰富。因此,本研究选取了DQB2 exon3作为研究对象,通过PCR-SSCP技术结合测序技术, 对哈萨克羊DQB2 exon3进行了多态性分析,最终发现了22个SNPs位点,而其中只有2个位点在病例和正常组间存在显著差异;在22个SNPs位点中只有6个位点为单氨基酸多态位点(SAPs),其他位点均为无义突变,且都是由密码子的简并性引起的。对比发现,本研究有义突变率较之其他研究成果[14-15]低,这可能是由exon3与exon2所编码的氨基酸链在MHC蛋白上所处的位置及其所发挥的功能不同引起的,也有可能是因为绵羊品种的不同造成的。MHC蛋白的主要功能是抗原递呈,在机体的免疫系统中发挥着非常重要的作用,与家畜的抗病性和易感性有着密切的关系。本研究通过对MHC-DQB2 exon3多态性与绵羊布鲁氏菌病易感性相关性研究,初步筛选了与布鲁氏菌病易感性相关的SNPs位点,但由于MHC是一组紧密连锁的基因群,在一条染色体上的等位基因很少发生同源染色体间的交换,构成了一个单体型(单倍型),在遗传过程中MHC单体型是以一个完整的遗传单位由亲代传给子代[16]。因此,本研究对符合要求的SNPs位点构建了单倍型,得到了3种与布鲁氏菌病易感性相关的单倍型,其中有2个单倍型在病例和正常组间达到了显著差异水平(P<0.05),1个达到了极显著差异水平(P<0.01)。这为今后开展布鲁氏菌抗性分子标记辅助选择研究提供了一定依据,为进一步寻找具有易感性遗传位点而最终进行抗病育种奠定了基础,但MHC-DQB2 exon3 的2个SNP位点及3个单倍型能否作为抗布鲁氏菌病的遗传标记,还需要对这些哈萨克羊个体进行攻毒试验以进一步验证以及其如何参与绵羊布鲁氏菌病的发生和发展的机制仍需进一步研究探讨。

表5 病例和正常组MHC-DQB2 exon3单倍型分析
参考文献:
[1]李振宪. 家畜布鲁氏菌病防控现状及应对策略[J]. 中国畜牧兽医文摘,2016,32(9):108.
[2]马晓菁,库尔班·居麦,舒 展,等. 2012—2014年新疆动物布鲁氏菌病流行病学调查与分析[J]. 畜牧与兽医,2016,48(5):111-114.
[3]陈芳芳,潘 玲,耿照玉,等. MHC分子多态性的起源、演变与抗病机理[J]. 畜牧兽医学报,2010,41(9):1061-1067.
[4]Hickford J,Zhou H,Fang Q. Haplotype analysis of the DQA genes in sheep:Evidence supporting recombination between the loci[J]. Journal of Animal Science,2007,85(3):577-582.
[5]Herrmann-Hoesing L M,White S N,Kappmeyer L S,et al. Genomic analysis ofOvisaries(Ovar) MHC class IIa loci[J]. Immunogenetics,2008,60(3/4):167-176.
[6]Kenter M,Otting N,Anholts J,et al. Evolutionary relationships among the Primate Mhc-DQA1 and DQA2 alleles[J]. Immunogenetics,1992,36(2):71-78.
[7]Oorschot R V,Maddox J F,Adams L A,et al. Characterization and evolution of ovine MHC classⅡ DQB sequence polymorphism[J]. Animal Genetics,1994,25(6):417-424.
[8]唐一通,肖 娜,李智山,等. 单核苷酸多态性检测方法研究进展[J]. 现代生物医学进展,2013,13(27):5393-5397.
[9]马 超. 单核苷酸多态性与广州汉族人群前列腺癌的相关性研究[D]. 广州:南方医科大学,2014.
[10]杨 俊. 上位作用特征基因的选择与分类方法研究[D]. 长沙:国防科学技术大学,2011.
[11]Jakobsdottir J,Gorin M B,Conley Y P,et al. Interpretation of genetic association studies:markers with replicated highly significant odds ratios may be poor classifiers[J]. PLoS Genetics,2009,5(2):e1000337.
[12]尚军亮. 全基因组单核苷酸多态性交互作用研究[D]. 西安:西安电子科技大学,2013.
[13]Shi Y Y,He L. SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J]. Cell Research,2005,15(2):97-98.
[14]陈月娥,李建华,苟亚峰,等. 中国美利奴羊MHC-DRB1 exon2单倍型构建及与布鲁氏菌病易感性关联分析[J]. 中国科学(生命科学),2014,44(5):495-501.
[15]王文文,许万云,胡梦薇,等. 中国美利奴羊OLA-DQB1基因exon2遗传多态性与布鲁氏菌病易感性的关联分析[J]. 中国畜牧兽医,2015,42(6):1495-1503.
[16]亢孝珍,额尔敦木图,姜建强,等. 主要组织相容性复合体(MHC)基因研究进展[J]. 中国畜牧兽医,2014,41(5):28-33.

